人教版高中化学选择性必修1第三章水溶液中的离子反应与平衡第一节电离平衡第2课时电离平衡常数课件(共68张PPT)
文档属性
| 名称 | 人教版高中化学选择性必修1第三章水溶液中的离子反应与平衡第一节电离平衡第2课时电离平衡常数课件(共68张PPT) |

|
|
| 格式 | ppt | ||
| 文件大小 | 9.6MB | ||
| 资源类型 | 试卷 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2025-06-25 00:00:00 | ||
图片预览











文档简介
(共68张PPT)
第三章 水溶液中的离子反应与平衡
第一节 电离平衡
第2课时 电离平衡常数
一、电离平衡常数
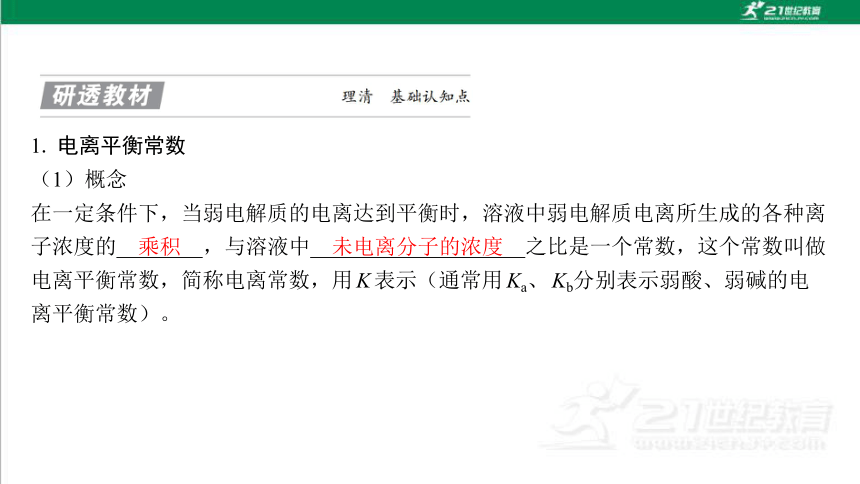
1. 电离平衡常数
(1)概念
在一定条件下,当弱电解质的电离达到平衡时,溶液中弱电解质电离所生成的各种离 子浓度的 ,与溶液中 之比是一个常数,这个常数叫做 电离平衡常数,简称电离常数,用K表示(通常用Ka、Kb分别表示弱酸、弱碱的电 离平衡常数)。
乘积
未电离分子的浓度
(2)表示方法:弱酸的电离平衡常数用 表示,弱碱的电离平衡常数用 表示。
①一元弱酸、一元弱碱的电离平衡常数
Ka
Kb
②多元弱酸的电离平衡常数
多元弱酸各步电离常数的大小比较:Ka1 Ka2,因此,多元弱酸的酸性主要 由 决定。
(3)意义
电离平衡常数表示弱电解质的电离能力。一定温度下,K值越大,弱电解质的电离程 度越 ,酸性(或碱性)越 。
第一步电离
大
强
(4)电离平衡常数的影响因素
①内因:弱电解质本身的性质。
②外因:电离平衡常数只跟 有关,温度升高,电离平衡常数 。
温度
增大
小
大
(5)电离平衡常数与电离度(α)的关系
①一元弱酸
起始浓度 c酸 0 0
转化浓度 c酸·α c酸·α c酸·α
平衡浓度 c酸·(1-α)c酸·α c酸·α
②一元弱碱(如NH3·H2O,电离常数为Kb)
c酸·α2
【判断】
×
×
×
×
A. 加水稀释,电离平衡正向移动,溶液中所有离子浓度都减小
B. 通入少量HCl气体,电离平衡逆向移动,c(CH3COO-)减小,Ka不变
C. 加入少量冰醋酸,电离平衡正向移动,c(H+)增大,电离度减小
D. 升高温度,电离平衡正向移动,c(H+)增大,pH减小
A
A. HF的电离平衡常数为5.6×10-4
B. 根据①②两个反应可知三种酸的酸性相对强弱
D. 同体积、同浓度的三种酸与NaOH恰好完全反应,消耗NaOH物质的量不相等
D
A. x点对应溶液的pH约为3.2
B. x点与y点对应溶液中CH3COOH的电离平衡常数:Kx>Ky
C. 室温下,0.01 mol·L-1的CH3COOH溶液中,CH3COOH的电离度约为4%
D. 升高温度,c(H+)增大,Ka的大小保持不变
C
二、电离常数的计算和应用
1. 电离常数的计算——“三段式”法
例:25 ℃ a mol·L-1的CH3COOH溶液,达到电离平衡时,已电离的CH3COOH为x mol·L-1。试计算该温度下CH3COOH的电离常数(Ka)。
起始浓度/(mol·L-1) a 0 0
变化浓度/(mol·L-1) x x x
平衡浓度/(mol·L-1) a-x x x
【注意】
由于弱电解质的电离程度比较小,平衡时弱电解质的浓度为(a-x) mol·L-1,一 般近似为a mol·L-1。
2. 电离平衡常数的应用
(1)根据电离平衡常数可以判断弱酸酸性(或弱碱碱性)的相对强弱,相同条件 下,电离平衡常数越大,酸性(或碱性)越强。
(2)根据电离平衡常数可以判断盐与酸(或碱)反应是否发生,相同条件下相对强 的酸(或碱)可以制相对弱的酸(或碱)。
(3)根据浓度商(Q)与电离平衡常数(K)的相对大小判断电离平衡的移动
方向。
B. 曲线b表示δ(HClO)的变化
C. 次氯酸的电离常数Ka约为10-7.5
C
4.2×10-7
(2)已知室温时,0.1 mol·L-1某一元酸HA在水中有0.1%发生电离,此酸的电离常 数约为 。
1×10-7
3. (2025·四川眉山高二阶段)化学中,酸的电离平衡常数(Ka)是评估酸性强弱的 重要依据。已知部分酸的电离平衡常数如表所示(25 ℃):
酸 CH3COOH H2CO3 HClO B(OH)3
电离 平衡 常数 Ka=1.75×10-5 Ka1=4.5×10-7
Ka2=4.7×10-11 Ka=4.0×10-8 Ka=5.7×10-10
回答下列问题:
(1)T ℃下,CH3COOH的电离平衡常数为1.0×10-5,则T (填 “>”“<”或“=”)25。估算T ℃下,0.1 mol/L CH3COOH溶液的c(H+) = mol/L;保持温度不变,将该溶液加水稀释至0.01 mol/L,下列物理量 增大的是 (填字母)。
c.c(H+) d.电离度α
<
1×10-3
ad
CO2
三、强酸与弱酸的比较
1. 相同体积、相同物质的量浓度的一元强酸(如盐酸)与一元弱酸(如醋酸) 的比较
比较
项目
酸 c(H+) 酸性 中和碱的能力 与足量活泼金 属反应产生H2 的总量 与同一金属反 应时的起始反 应速率
一元强酸
一元弱酸
大
强
相同
相同
大
小
弱
小
2. 相同体积、相同c(H+)的一元强酸(如盐酸)与一元弱酸(如醋酸)的比较
比较
项目
酸 c(H+) 酸性 中和碱的能力 与足量活泼金 属反应产生H2 的总量 与同一金属反 应时的起始反 应速率
一元强酸
一元弱酸
相同
相同
小
少
相同
大
多
C
A. ①②③ B. ②③④
C. ②③⑤ D. ③④⑤
解析:①0.1 mol/L MOH溶液可以使酚酞溶液变红,只能说明溶液显碱性,但不能说 明MOH为弱碱,故①不符合题意;②常温下,0.1 mol/L MOH溶液中氢氧根离子浓度 小于0.1 mol/L,说明MOH在溶液中不能完全电离,属于弱碱,故②符合题意;③常 温下,0.1 mol/L MOH溶液的导电能力比0.1 mol/L NaOH溶液弱,说明MOH在溶液中 不能完全电离,属于弱碱,故③符合题意;④0.1 mol/L MOH溶液与等体积0.1 mol/L 盐酸恰好完全反应,只能说明MOH是一元碱,但不能说明MOH为弱碱,故④不符合 题意;⑤常温下,向V L pH=11的MOH溶液中加水稀释至溶液体积为10V L,测得稀 释后溶液pH>10,说明MOH在溶液中存在电离平衡,不能完全电离,属于弱碱,故 ⑤符合题意;综上,②③⑤符合题意,故选C。
题后归纳
判断弱电解质的三个角度
角度1:弱电解质的定义,即弱电解质不能完全电离。如0.1 mol·L-1的 CH3COOH溶液的pH>1。
角度2:弱电解质溶液中存在电离平衡,条件改变,平衡移动。如pH=1的 CH3COOH溶液加水稀释10倍后,1<pH<2。
角度3:弱电解质形成的盐类能水解。如判断CH3COOH为弱酸可利用下面 两个实验:
(1)配制某浓度的醋酸钠溶液,向其中加入几滴酚酞溶液,溶液变为浅红色。
(2)用玻璃棒蘸取一定浓度的醋酸钠溶液滴在pH试纸上,测其pH,pH>7。
2. 在a、b两支试管中分别装入形态相同、质量相等的锌粒(锌足量),然后向两支 试管中分别加入相同物质的量浓度、相同体积的稀盐酸和稀醋酸。填写下列空白:
(1)a、b两支试管中的现象:
相同点是 ,
不同点是 ,
原因是 。
都产生无色气泡,锌粒逐渐溶解
a中起始反应速率较大
HCl是强酸,CH3COOH是弱酸,盐酸中c(H+)较大
>
=
反应开始时,盐酸中c(H+)较大,但二者最终能电离出的H+的总物质的量
相等
=
<
开始时c
(H+)相同,反应速率相同,由于n(HCl)<n(CH3COOH),由于Zn足量,则
生成n(H2):HCl<CH3COOH
课时作业(十六) 电离平衡常数
[对点训练]
题组一 电离常数的含义
A. 电离平衡常数(K)越小,表示弱电解质电离能力越弱
B. 电离平衡常数(K)与温度无关
C. 相同温度下,不同浓度的同一弱电解质,其电离平衡常数(K)不同
D. 多元弱酸各步电离平衡常数相互关系为Ka1<Ka2<Ka3
A
1
2
3
4
5
6
7
8
9
10
11
12
A. 25 ℃下,向该溶液中加入一定量的盐酸时,K=8×10-5
B. 25 ℃下,向该溶液中加入一定量的盐酸时,K=8×10-4
C. 标准状况下,CH3COOH溶液中K=1.75×10-5
D. 升高到一定温度,可能K=7.2×10-5
D
解析:K为醋酸的电离常数,只与温度有关,与离子浓度无关,温度不变,平衡常数 不变,A、B均不符合题意;由于醋酸电离过程吸热,升高温度,K增大,降低温 度,K减小,所以标准状况下(0 ℃),K应小于1.75×10-5,C不符合题意;升高 温度,电离常数增大,故升高到一定温度K可能是7.2×10-5,D符合题意。
1
2
3
4
5
6
7
8
9
10
11
12
题组二 电离常数的应用及计算
弱酸 醋酸 次氯酸 碳酸
电离平
衡常数 Ka=1.75×0-5 Ka=4.0×10-8 Ka1=4.5×10-7
Ka2=4.7×10-11
A. 三种酸的酸性由强到弱的顺序是CH3COOH>H2CO3>HClO
B. 少量的CO2与NaClO溶液反应生成HClO与Na2CO3
D. 向NaClO溶液中滴加醋酸,可生成HClO,使杀菌、消毒能力增强
B
1
2
3
4
5
6
7
8
9
10
11
12
1
2
3
4
5
6
7
8
9
10
11
12
4. (2025·四川遂宁高二期中)已知25 ℃时,下列四种弱酸的电离常数:
弱酸 CH3COOH HClO HCN H2CO3
电离常数 1.75×10-5 4.0×10-8 6.2×10-10 Ka1=4.5×10-7
Ka2=4.7×10-11
D
B. 多元弱酸的酸性强弱主要由第一步电离决定
D. 向分别盛有0.1 mol·L-1 CH3COOH和HCN溶液的试管1、2中分别滴加等浓度的 NaHCO3溶液,试管1、2中现象相同
1
2
3
4
5
6
7
8
9
10
11
12
1
2
3
4
5
6
7
8
9
10
11
12
1
2
3
4
5
6
7
8
9
10
11
12
(2)常温下,0.1 mol·L-1的H2A溶液中H2A、HA-、A2-在三者中所占的物质的量分 数(分布分数)随pH变化的关系如图所示。
H2A的电离方程式为 ,H2A的二级电离常数 Ka2= 。已知25 ℃时HF的Ka=10-3.45,将少量H2A的溶液加入足量NaF溶液 中,发生反应的离子方程式为 。
10-4.2
1
2
3
4
5
6
7
8
9
10
11
12
1
2
3
4
5
6
7
8
9
10
11
12
题组三 强酸和弱酸的比较
A. 300 s内平均反应速率:v(HCl)<v(CH3COOH)
B. 醋酸的平均反应速率呈现“快—慢”的趋势
C. 反应结束后锥形瓶中:c(MgCl2)=c[(CH3COO)2Mg]
D. 反应到100 s时锥形瓶中:c(HCl)=c(CH3COOH)
C
1
2
3
4
5
6
7
8
9
10
11
12
1
2
3
4
5
6
7
8
9
10
11
12
A. ①④⑥⑦ B. ③⑥⑦
C. ②④⑥ D. ④⑤⑥⑦
B
1
2
3
4
5
6
7
8
9
10
11
12
解析:HA与水以任意比例互溶,说明HA的溶解度大,而不能证明HA的电离程度, 所以不能证明HA为弱酸,故①不符合题意;HA溶液能导电,说明HA在水溶液中能 电离出阴、阳离子,为电解质,而不能证明HA的电离程度,所以不能证明HA为弱 酸,故②不符合题意;HA溶液中存在HA分子,说明HA部分电离,能证明HA为弱电 解质,故③符合题意;测得HA的pH比盐酸pH大,但是不知道二者的浓度,所以不能 确定HA是否完全电离,则不能证明HA为弱酸,故④不符合题意;在漂白剂溶液中滴 加HA能增强漂白效果,说明HA酸性大于HClO的,但是不能确定HA是否完全电离, 则不能证明HA为弱酸,故⑤不符合题意;0.1 mol/L的HA溶液的pH=2,说明HA部 分电离,能证明HA为弱电解质,故⑥符合题意;形状、大小、质量均相同的锌粒与 相同物质的量浓度的盐酸和HA反应,HA产生氢气速率慢,说明HA中氢离子浓度 小,即HA不完全电离,能证明HA为弱电解质,故⑦符合题意;故选B。
1
2
3
4
5
6
7
8
9
10
11
12
[综合强化]
B. 已知酸性:HCOOH>CH3COOH,则HNO3在HCOOH中的pKa<9.4
C. 酸性强弱顺序为HCl>HNO3>CH3COOH
D. 接受质子的能力:CH3COOH>H2O
C
1
2
3
4
5
6
7
8
9
10
11
12
1
2
3
4
5
6
7
8
9
10
11
12
9. (2025·四川雅安高二期中)HClO4、H2SO4、HNO3和HCl都是强酸,它们的酸性在 水溶液中差别不大。以下是某温度下这四种酸在冰醋酸中的电离常数:
酸 HClO4 H2SO4 HCl HNO3
Ka 1.6×10-5 6.3×10-9 1.6×10-9 4.2×10-10
A. 在冰醋酸中这四种酸都没有完全电离
B. 在冰醋酸中HClO4是这四种酸中最强的酸
C. 水不能区分这四种酸的酸性强弱,但冰醋酸可以区分这四种酸的酸性强弱
D
1
2
3
4
5
6
7
8
9
10
11
12
解析:根据电离平衡常数可知,在冰醋酸中这四种酸都没有完全电离,故A正确;在 冰醋酸中,高氯酸的电离平衡常数最大,则高氯酸的酸性最强,故B正确;这四种酸 在水中都完全电离,在冰醋酸中电离程度不同,即水对于这四种酸的酸性强弱没有区 分能力,但冰醋酸可以区分这四种酸的酸性强弱,故C正确;在冰醋酸中硫酸是分步 电离的,故D错误。
1
2
3
4
5
6
7
8
9
10
11
12
D
A. HClO的电离常数Ka=1.0×10-7.5
C. 该氯气—氯水体系中c(H+)=c(Cl-)+c(ClO-)+c(OH-)
D. 用氯处理饮用水时,pH越小杀菌效果越好
1
2
3
4
5
6
7
8
9
10
11
12
1
2
3
4
5
6
7
8
9
10
11
12
1
2
3
4
5
6
7
8
9
10
11
12
10-1.2
10-4.2
草酸的一级电离电离出的H+抑制了草酸的二
级电离
1
2
3
4
5
6
7
8
9
10
11
12
(2)T ℃下,H2C2O4的一级电离平衡常数为10-3,则T (填“>”“<”或 “=”)25。
解析:(2)由于电离为吸热过程,所以电离平衡常数随温度升高而增大,T ℃下, H2C2O4的一级电离平衡常数为10-3<25 ℃时Ka1,则T<25。
<
103
1
2
3
4
5
6
7
8
9
10
11
12
(4)醋酸与草酸均为有机弱酸,常温下,0.1 mol·L-1 CH3COOH溶液的c(H+)= 10-3 mol·L-1,则CH3COOH的电离度= (用百分数表示)。向该溶液中加入 冰醋酸,CH3COOH的电离度 (填“增大”“减小”或“不变”,下同), 溶液中的c(H+) 。
1%
减小
增大
1
2
3
4
5
6
7
8
9
10
11
12
12. (2025·重庆市万州第二高级中学高二期中)下表是几种常见弱酸的电离平衡常数 (25 ℃),回答下列问题:
酸 CH3COOH HNO2 HCN HClO
电离平衡
常数(Ka) 1.75×10-5 5.6×10-4 6.2×10-10 4.0×10-8
(1)当温度升高时,K值 (填“增大”“减小”或“不变”)。
解析:(1)弱酸的电离为吸热过程,当温度升高时,促进电离,则K值增大。
增大
1
2
3
4
5
6
7
8
9
10
11
12
(2)上述四种酸中,酸性最弱、最强的酸分别是 、 (用化学式表 示)。
解析:(2)K值越大,电离程度越大,酸性越强,题给四种酸中,酸性最弱、最强 的酸分别是HCN、HNO2。
(3)下列能使CH3COOH溶液中CH3COOH的电离程度增大,而电离平衡常数不变的 操作是 (填字母)。
A. 升高温度
B. 加水稀释
C. 加少量的CH3COONa固体
D. 加少量冰醋酸
E. 若加入少量NaOH溶液,且溶液温度几乎不变
HCN
HNO2
BE
1
2
3
4
5
6
7
8
9
10
11
12
解析:(3)弱酸的电离为吸热过程,当温度升高时,促进电离,则K值增大,A不 符合题意;越稀越电离,加水稀释,促进电离,温度不变,K值不变,B符合题意; 加少量的CH3COONa固体,醋酸根离子浓度增大,抑制电离,温度不变,K值不变, C不符合题意;加少量冰醋酸,增大醋酸浓度,虽然平衡向右移动,但电离程度减 小,D不符合题意;加少量氢氧化钠溶液,消耗H+,平衡向右移动,电离程度增大, 温度不变,K值不变,E符合题意;答案为BE。
1
2
3
4
5
6
7
8
9
10
11
12
(4)依上表数据判断醋酸和次氯酸钠溶液能否反应,如果不能反应说出理由,如果 能发生反应请写出相应的离子方程式: 。
(5)已知草酸是一种二元弱酸,其电离常数Ka1=5.6×10-2,Ka2=1.5×10-4,写 出草酸的电离方程式: 、 。
1
2
3
4
5
6
7
8
9
10
11
12
(6)用食醋浸泡有水垢的水壶,可以清除其中的水垢,通过该事实 (填 “能”或“不能”)比较醋酸与碳酸的酸性强弱,请设计一个简单的实验验证醋酸与 碳酸的酸性强弱。实验方案: 。
解析:(6)用食醋浸泡有水垢的水壶,可以清除其中的水垢,则水垢中的碳酸钙和 醋酸发生了反应,故通过该事实能比较醋酸酸性大于碳酸的。实验中可依据强酸制备 弱酸的原理来证明酸性强弱。则要通过实验验证醋酸与碳酸的酸性强弱,方案为往石 灰石中加入醋酸,观察溶液中是否有气泡产生,若有气泡产生可证明醋酸的酸性大于 碳酸的。
能
往石灰石中加入醋酸,观察是否有气泡产生
1
2
3
4
5
6
7
8
9
10
11
12
第三章 水溶液中的离子反应与平衡
第一节 电离平衡
第2课时 电离平衡常数
一、电离平衡常数
1. 电离平衡常数
(1)概念
在一定条件下,当弱电解质的电离达到平衡时,溶液中弱电解质电离所生成的各种离 子浓度的 ,与溶液中 之比是一个常数,这个常数叫做 电离平衡常数,简称电离常数,用K表示(通常用Ka、Kb分别表示弱酸、弱碱的电 离平衡常数)。
乘积
未电离分子的浓度
(2)表示方法:弱酸的电离平衡常数用 表示,弱碱的电离平衡常数用 表示。
①一元弱酸、一元弱碱的电离平衡常数
Ka
Kb
②多元弱酸的电离平衡常数
多元弱酸各步电离常数的大小比较:Ka1 Ka2,因此,多元弱酸的酸性主要 由 决定。
(3)意义
电离平衡常数表示弱电解质的电离能力。一定温度下,K值越大,弱电解质的电离程 度越 ,酸性(或碱性)越 。
第一步电离
大
强
(4)电离平衡常数的影响因素
①内因:弱电解质本身的性质。
②外因:电离平衡常数只跟 有关,温度升高,电离平衡常数 。
温度
增大
小
大
(5)电离平衡常数与电离度(α)的关系
①一元弱酸
起始浓度 c酸 0 0
转化浓度 c酸·α c酸·α c酸·α
平衡浓度 c酸·(1-α)c酸·α c酸·α
②一元弱碱(如NH3·H2O,电离常数为Kb)
c酸·α2
【判断】
×
×
×
×
A. 加水稀释,电离平衡正向移动,溶液中所有离子浓度都减小
B. 通入少量HCl气体,电离平衡逆向移动,c(CH3COO-)减小,Ka不变
C. 加入少量冰醋酸,电离平衡正向移动,c(H+)增大,电离度减小
D. 升高温度,电离平衡正向移动,c(H+)增大,pH减小
A
A. HF的电离平衡常数为5.6×10-4
B. 根据①②两个反应可知三种酸的酸性相对强弱
D. 同体积、同浓度的三种酸与NaOH恰好完全反应,消耗NaOH物质的量不相等
D
A. x点对应溶液的pH约为3.2
B. x点与y点对应溶液中CH3COOH的电离平衡常数:Kx>Ky
C. 室温下,0.01 mol·L-1的CH3COOH溶液中,CH3COOH的电离度约为4%
D. 升高温度,c(H+)增大,Ka的大小保持不变
C
二、电离常数的计算和应用
1. 电离常数的计算——“三段式”法
例:25 ℃ a mol·L-1的CH3COOH溶液,达到电离平衡时,已电离的CH3COOH为x mol·L-1。试计算该温度下CH3COOH的电离常数(Ka)。
起始浓度/(mol·L-1) a 0 0
变化浓度/(mol·L-1) x x x
平衡浓度/(mol·L-1) a-x x x
【注意】
由于弱电解质的电离程度比较小,平衡时弱电解质的浓度为(a-x) mol·L-1,一 般近似为a mol·L-1。
2. 电离平衡常数的应用
(1)根据电离平衡常数可以判断弱酸酸性(或弱碱碱性)的相对强弱,相同条件 下,电离平衡常数越大,酸性(或碱性)越强。
(2)根据电离平衡常数可以判断盐与酸(或碱)反应是否发生,相同条件下相对强 的酸(或碱)可以制相对弱的酸(或碱)。
(3)根据浓度商(Q)与电离平衡常数(K)的相对大小判断电离平衡的移动
方向。
B. 曲线b表示δ(HClO)的变化
C. 次氯酸的电离常数Ka约为10-7.5
C
4.2×10-7
(2)已知室温时,0.1 mol·L-1某一元酸HA在水中有0.1%发生电离,此酸的电离常 数约为 。
1×10-7
3. (2025·四川眉山高二阶段)化学中,酸的电离平衡常数(Ka)是评估酸性强弱的 重要依据。已知部分酸的电离平衡常数如表所示(25 ℃):
酸 CH3COOH H2CO3 HClO B(OH)3
电离 平衡 常数 Ka=1.75×10-5 Ka1=4.5×10-7
Ka2=4.7×10-11 Ka=4.0×10-8 Ka=5.7×10-10
回答下列问题:
(1)T ℃下,CH3COOH的电离平衡常数为1.0×10-5,则T (填 “>”“<”或“=”)25。估算T ℃下,0.1 mol/L CH3COOH溶液的c(H+) = mol/L;保持温度不变,将该溶液加水稀释至0.01 mol/L,下列物理量 增大的是 (填字母)。
c.c(H+) d.电离度α
<
1×10-3
ad
CO2
三、强酸与弱酸的比较
1. 相同体积、相同物质的量浓度的一元强酸(如盐酸)与一元弱酸(如醋酸) 的比较
比较
项目
酸 c(H+) 酸性 中和碱的能力 与足量活泼金 属反应产生H2 的总量 与同一金属反 应时的起始反 应速率
一元强酸
一元弱酸
大
强
相同
相同
大
小
弱
小
2. 相同体积、相同c(H+)的一元强酸(如盐酸)与一元弱酸(如醋酸)的比较
比较
项目
酸 c(H+) 酸性 中和碱的能力 与足量活泼金 属反应产生H2 的总量 与同一金属反 应时的起始反 应速率
一元强酸
一元弱酸
相同
相同
小
少
相同
大
多
C
A. ①②③ B. ②③④
C. ②③⑤ D. ③④⑤
解析:①0.1 mol/L MOH溶液可以使酚酞溶液变红,只能说明溶液显碱性,但不能说 明MOH为弱碱,故①不符合题意;②常温下,0.1 mol/L MOH溶液中氢氧根离子浓度 小于0.1 mol/L,说明MOH在溶液中不能完全电离,属于弱碱,故②符合题意;③常 温下,0.1 mol/L MOH溶液的导电能力比0.1 mol/L NaOH溶液弱,说明MOH在溶液中 不能完全电离,属于弱碱,故③符合题意;④0.1 mol/L MOH溶液与等体积0.1 mol/L 盐酸恰好完全反应,只能说明MOH是一元碱,但不能说明MOH为弱碱,故④不符合 题意;⑤常温下,向V L pH=11的MOH溶液中加水稀释至溶液体积为10V L,测得稀 释后溶液pH>10,说明MOH在溶液中存在电离平衡,不能完全电离,属于弱碱,故 ⑤符合题意;综上,②③⑤符合题意,故选C。
题后归纳
判断弱电解质的三个角度
角度1:弱电解质的定义,即弱电解质不能完全电离。如0.1 mol·L-1的 CH3COOH溶液的pH>1。
角度2:弱电解质溶液中存在电离平衡,条件改变,平衡移动。如pH=1的 CH3COOH溶液加水稀释10倍后,1<pH<2。
角度3:弱电解质形成的盐类能水解。如判断CH3COOH为弱酸可利用下面 两个实验:
(1)配制某浓度的醋酸钠溶液,向其中加入几滴酚酞溶液,溶液变为浅红色。
(2)用玻璃棒蘸取一定浓度的醋酸钠溶液滴在pH试纸上,测其pH,pH>7。
2. 在a、b两支试管中分别装入形态相同、质量相等的锌粒(锌足量),然后向两支 试管中分别加入相同物质的量浓度、相同体积的稀盐酸和稀醋酸。填写下列空白:
(1)a、b两支试管中的现象:
相同点是 ,
不同点是 ,
原因是 。
都产生无色气泡,锌粒逐渐溶解
a中起始反应速率较大
HCl是强酸,CH3COOH是弱酸,盐酸中c(H+)较大
>
=
反应开始时,盐酸中c(H+)较大,但二者最终能电离出的H+的总物质的量
相等
=
<
开始时c
(H+)相同,反应速率相同,由于n(HCl)<n(CH3COOH),由于Zn足量,则
生成n(H2):HCl<CH3COOH
课时作业(十六) 电离平衡常数
[对点训练]
题组一 电离常数的含义
A. 电离平衡常数(K)越小,表示弱电解质电离能力越弱
B. 电离平衡常数(K)与温度无关
C. 相同温度下,不同浓度的同一弱电解质,其电离平衡常数(K)不同
D. 多元弱酸各步电离平衡常数相互关系为Ka1<Ka2<Ka3
A
1
2
3
4
5
6
7
8
9
10
11
12
A. 25 ℃下,向该溶液中加入一定量的盐酸时,K=8×10-5
B. 25 ℃下,向该溶液中加入一定量的盐酸时,K=8×10-4
C. 标准状况下,CH3COOH溶液中K=1.75×10-5
D. 升高到一定温度,可能K=7.2×10-5
D
解析:K为醋酸的电离常数,只与温度有关,与离子浓度无关,温度不变,平衡常数 不变,A、B均不符合题意;由于醋酸电离过程吸热,升高温度,K增大,降低温 度,K减小,所以标准状况下(0 ℃),K应小于1.75×10-5,C不符合题意;升高 温度,电离常数增大,故升高到一定温度K可能是7.2×10-5,D符合题意。
1
2
3
4
5
6
7
8
9
10
11
12
题组二 电离常数的应用及计算
弱酸 醋酸 次氯酸 碳酸
电离平
衡常数 Ka=1.75×0-5 Ka=4.0×10-8 Ka1=4.5×10-7
Ka2=4.7×10-11
A. 三种酸的酸性由强到弱的顺序是CH3COOH>H2CO3>HClO
B. 少量的CO2与NaClO溶液反应生成HClO与Na2CO3
D. 向NaClO溶液中滴加醋酸,可生成HClO,使杀菌、消毒能力增强
B
1
2
3
4
5
6
7
8
9
10
11
12
1
2
3
4
5
6
7
8
9
10
11
12
4. (2025·四川遂宁高二期中)已知25 ℃时,下列四种弱酸的电离常数:
弱酸 CH3COOH HClO HCN H2CO3
电离常数 1.75×10-5 4.0×10-8 6.2×10-10 Ka1=4.5×10-7
Ka2=4.7×10-11
D
B. 多元弱酸的酸性强弱主要由第一步电离决定
D. 向分别盛有0.1 mol·L-1 CH3COOH和HCN溶液的试管1、2中分别滴加等浓度的 NaHCO3溶液,试管1、2中现象相同
1
2
3
4
5
6
7
8
9
10
11
12
1
2
3
4
5
6
7
8
9
10
11
12
1
2
3
4
5
6
7
8
9
10
11
12
(2)常温下,0.1 mol·L-1的H2A溶液中H2A、HA-、A2-在三者中所占的物质的量分 数(分布分数)随pH变化的关系如图所示。
H2A的电离方程式为 ,H2A的二级电离常数 Ka2= 。已知25 ℃时HF的Ka=10-3.45,将少量H2A的溶液加入足量NaF溶液 中,发生反应的离子方程式为 。
10-4.2
1
2
3
4
5
6
7
8
9
10
11
12
1
2
3
4
5
6
7
8
9
10
11
12
题组三 强酸和弱酸的比较
A. 300 s内平均反应速率:v(HCl)<v(CH3COOH)
B. 醋酸的平均反应速率呈现“快—慢”的趋势
C. 反应结束后锥形瓶中:c(MgCl2)=c[(CH3COO)2Mg]
D. 反应到100 s时锥形瓶中:c(HCl)=c(CH3COOH)
C
1
2
3
4
5
6
7
8
9
10
11
12
1
2
3
4
5
6
7
8
9
10
11
12
A. ①④⑥⑦ B. ③⑥⑦
C. ②④⑥ D. ④⑤⑥⑦
B
1
2
3
4
5
6
7
8
9
10
11
12
解析:HA与水以任意比例互溶,说明HA的溶解度大,而不能证明HA的电离程度, 所以不能证明HA为弱酸,故①不符合题意;HA溶液能导电,说明HA在水溶液中能 电离出阴、阳离子,为电解质,而不能证明HA的电离程度,所以不能证明HA为弱 酸,故②不符合题意;HA溶液中存在HA分子,说明HA部分电离,能证明HA为弱电 解质,故③符合题意;测得HA的pH比盐酸pH大,但是不知道二者的浓度,所以不能 确定HA是否完全电离,则不能证明HA为弱酸,故④不符合题意;在漂白剂溶液中滴 加HA能增强漂白效果,说明HA酸性大于HClO的,但是不能确定HA是否完全电离, 则不能证明HA为弱酸,故⑤不符合题意;0.1 mol/L的HA溶液的pH=2,说明HA部 分电离,能证明HA为弱电解质,故⑥符合题意;形状、大小、质量均相同的锌粒与 相同物质的量浓度的盐酸和HA反应,HA产生氢气速率慢,说明HA中氢离子浓度 小,即HA不完全电离,能证明HA为弱电解质,故⑦符合题意;故选B。
1
2
3
4
5
6
7
8
9
10
11
12
[综合强化]
B. 已知酸性:HCOOH>CH3COOH,则HNO3在HCOOH中的pKa<9.4
C. 酸性强弱顺序为HCl>HNO3>CH3COOH
D. 接受质子的能力:CH3COOH>H2O
C
1
2
3
4
5
6
7
8
9
10
11
12
1
2
3
4
5
6
7
8
9
10
11
12
9. (2025·四川雅安高二期中)HClO4、H2SO4、HNO3和HCl都是强酸,它们的酸性在 水溶液中差别不大。以下是某温度下这四种酸在冰醋酸中的电离常数:
酸 HClO4 H2SO4 HCl HNO3
Ka 1.6×10-5 6.3×10-9 1.6×10-9 4.2×10-10
A. 在冰醋酸中这四种酸都没有完全电离
B. 在冰醋酸中HClO4是这四种酸中最强的酸
C. 水不能区分这四种酸的酸性强弱,但冰醋酸可以区分这四种酸的酸性强弱
D
1
2
3
4
5
6
7
8
9
10
11
12
解析:根据电离平衡常数可知,在冰醋酸中这四种酸都没有完全电离,故A正确;在 冰醋酸中,高氯酸的电离平衡常数最大,则高氯酸的酸性最强,故B正确;这四种酸 在水中都完全电离,在冰醋酸中电离程度不同,即水对于这四种酸的酸性强弱没有区 分能力,但冰醋酸可以区分这四种酸的酸性强弱,故C正确;在冰醋酸中硫酸是分步 电离的,故D错误。
1
2
3
4
5
6
7
8
9
10
11
12
D
A. HClO的电离常数Ka=1.0×10-7.5
C. 该氯气—氯水体系中c(H+)=c(Cl-)+c(ClO-)+c(OH-)
D. 用氯处理饮用水时,pH越小杀菌效果越好
1
2
3
4
5
6
7
8
9
10
11
12
1
2
3
4
5
6
7
8
9
10
11
12
1
2
3
4
5
6
7
8
9
10
11
12
10-1.2
10-4.2
草酸的一级电离电离出的H+抑制了草酸的二
级电离
1
2
3
4
5
6
7
8
9
10
11
12
(2)T ℃下,H2C2O4的一级电离平衡常数为10-3,则T (填“>”“<”或 “=”)25。
解析:(2)由于电离为吸热过程,所以电离平衡常数随温度升高而增大,T ℃下, H2C2O4的一级电离平衡常数为10-3<25 ℃时Ka1,则T<25。
<
103
1
2
3
4
5
6
7
8
9
10
11
12
(4)醋酸与草酸均为有机弱酸,常温下,0.1 mol·L-1 CH3COOH溶液的c(H+)= 10-3 mol·L-1,则CH3COOH的电离度= (用百分数表示)。向该溶液中加入 冰醋酸,CH3COOH的电离度 (填“增大”“减小”或“不变”,下同), 溶液中的c(H+) 。
1%
减小
增大
1
2
3
4
5
6
7
8
9
10
11
12
12. (2025·重庆市万州第二高级中学高二期中)下表是几种常见弱酸的电离平衡常数 (25 ℃),回答下列问题:
酸 CH3COOH HNO2 HCN HClO
电离平衡
常数(Ka) 1.75×10-5 5.6×10-4 6.2×10-10 4.0×10-8
(1)当温度升高时,K值 (填“增大”“减小”或“不变”)。
解析:(1)弱酸的电离为吸热过程,当温度升高时,促进电离,则K值增大。
增大
1
2
3
4
5
6
7
8
9
10
11
12
(2)上述四种酸中,酸性最弱、最强的酸分别是 、 (用化学式表 示)。
解析:(2)K值越大,电离程度越大,酸性越强,题给四种酸中,酸性最弱、最强 的酸分别是HCN、HNO2。
(3)下列能使CH3COOH溶液中CH3COOH的电离程度增大,而电离平衡常数不变的 操作是 (填字母)。
A. 升高温度
B. 加水稀释
C. 加少量的CH3COONa固体
D. 加少量冰醋酸
E. 若加入少量NaOH溶液,且溶液温度几乎不变
HCN
HNO2
BE
1
2
3
4
5
6
7
8
9
10
11
12
解析:(3)弱酸的电离为吸热过程,当温度升高时,促进电离,则K值增大,A不 符合题意;越稀越电离,加水稀释,促进电离,温度不变,K值不变,B符合题意; 加少量的CH3COONa固体,醋酸根离子浓度增大,抑制电离,温度不变,K值不变, C不符合题意;加少量冰醋酸,增大醋酸浓度,虽然平衡向右移动,但电离程度减 小,D不符合题意;加少量氢氧化钠溶液,消耗H+,平衡向右移动,电离程度增大, 温度不变,K值不变,E符合题意;答案为BE。
1
2
3
4
5
6
7
8
9
10
11
12
(4)依上表数据判断醋酸和次氯酸钠溶液能否反应,如果不能反应说出理由,如果 能发生反应请写出相应的离子方程式: 。
(5)已知草酸是一种二元弱酸,其电离常数Ka1=5.6×10-2,Ka2=1.5×10-4,写 出草酸的电离方程式: 、 。
1
2
3
4
5
6
7
8
9
10
11
12
(6)用食醋浸泡有水垢的水壶,可以清除其中的水垢,通过该事实 (填 “能”或“不能”)比较醋酸与碳酸的酸性强弱,请设计一个简单的实验验证醋酸与 碳酸的酸性强弱。实验方案: 。
解析:(6)用食醋浸泡有水垢的水壶,可以清除其中的水垢,则水垢中的碳酸钙和 醋酸发生了反应,故通过该事实能比较醋酸酸性大于碳酸的。实验中可依据强酸制备 弱酸的原理来证明酸性强弱。则要通过实验验证醋酸与碳酸的酸性强弱,方案为往石 灰石中加入醋酸,观察溶液中是否有气泡产生,若有气泡产生可证明醋酸的酸性大于 碳酸的。
能
往石灰石中加入醋酸,观察是否有气泡产生
1
2
3
4
5
6
7
8
9
10
11
12
