人教版高中化学选择性必修1第四章化学反应与电能第二节电解池第1课时电解原理课件(共59张PPT)
文档属性
| 名称 | 人教版高中化学选择性必修1第四章化学反应与电能第二节电解池第1课时电解原理课件(共59张PPT) |  | |
| 格式 | ppt | ||
| 文件大小 | 7.6MB | ||
| 资源类型 | 试卷 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2025-06-25 17:26:33 | ||
图片预览









文档简介
(共59张PPT)
第四章 化学反应与电能
第二节 电解池
第1课时 电解原理
【学习目标】 1.从宏观和微观的角度理解电解池的工作原理。2.建立对电解过程的 系统分析和认识的思维模型,理解电解的规律,会判断电解产物,会书写电解的电极 反应和总反应。3.通过对电解饱和食盐水、电镀、电解精炼铜、电冶金等原理的分 析,认识电能与化学能之间的转化。4.建立电解应用问题的分析思维模型和电解相关 计算的思维模型,加深对电解原理的理解和应用。
一、电解原理
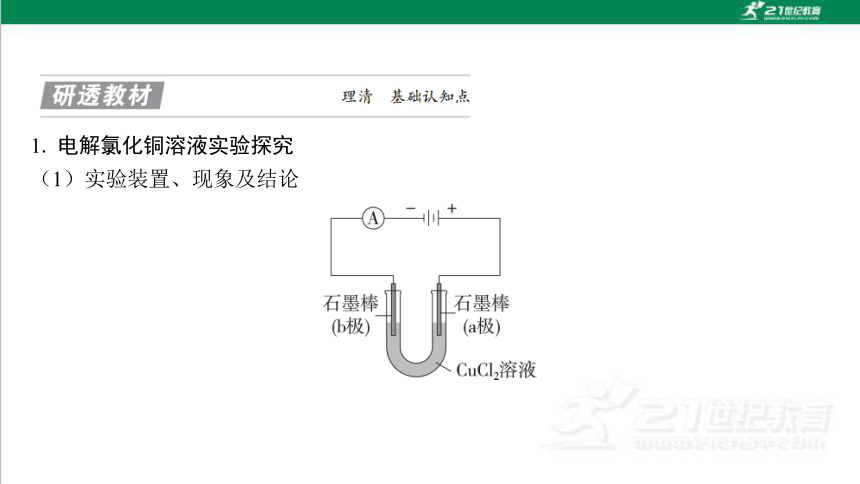
1. 电解氯化铜溶液实验探究
(1)实验装置、现象及结论
实验现象 实验结论
电流表指针发生偏转 说明电解质溶液导电,形成闭 合回路
与负极相连的b极上逐渐覆盖了一层红色物质 析出金属铜
与正极相连的a极上有刺激性气味的气体产生,该气 体能使湿润的淀粉—碘化钾试纸变蓝 产生了氯气
Cu2+、Cl-、H+、OH-
Cl-、OH -
Cu2+、H+
2. 电解和电解池
(1)电解:使电流通过电解质溶液(或熔融电解质)而在阳极、阴极引起氧化还原 反应的过程。
(2)电解池:将电能转化为化学能的装置。
(3)电解池的电极名称
阴极:与电源 相连的电极,发生 反应;
阳极:与电源 相连的电极,发生 反应。
(4)电解池的构成条件
直流电源;两个电极(阴极、阳极);电解质溶液或熔融电解质;形成闭合回路。
负极
还原
正极
氧化
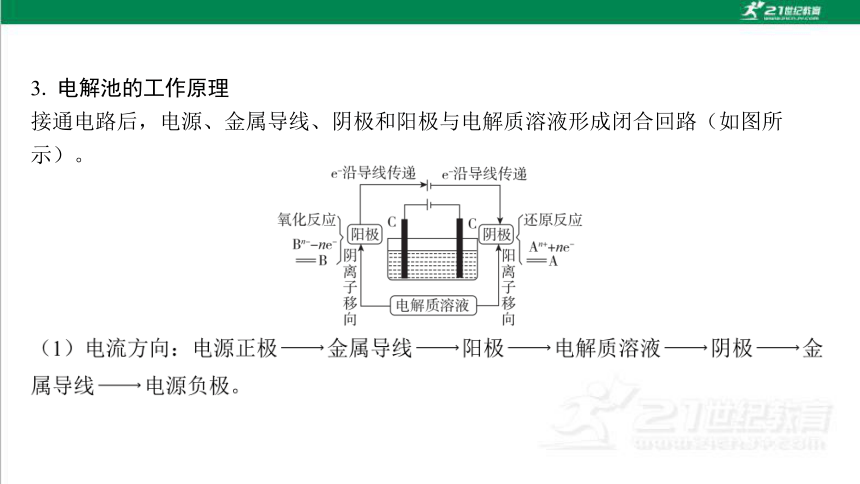
3. 电解池的工作原理
接通电路后,电源、金属导线、阴极和阳极与电解质溶液形成闭合回路(如图所 示)。
【判断】
×
×
√
×
√
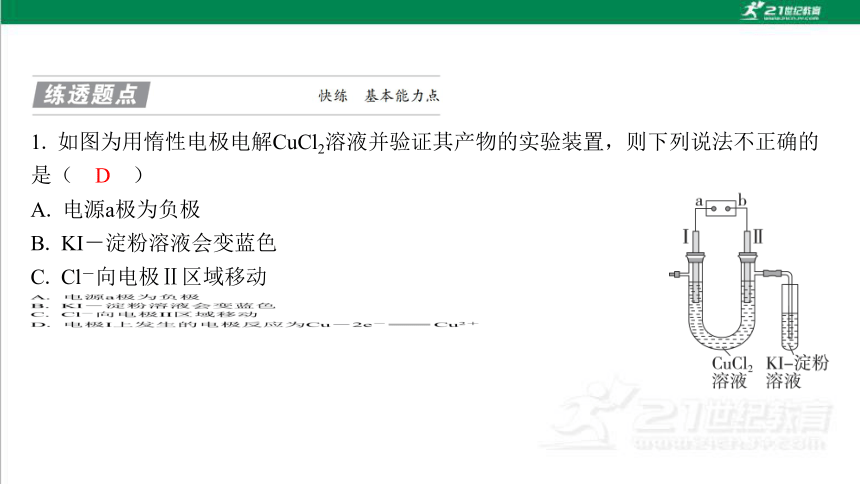
A. 电源a极为负极
B. KI-淀粉溶液会变蓝色
C. Cl-向电极Ⅱ区域移动
D
2. 如图所示装置中属于电解池的是 (填序号)。
解析:①②⑤无外接直流电源,不能构成电解池;④无电解质溶液或熔融电解质;⑦ 中蔗糖不属于电解质,不能构成电解池;⑧没有形成闭合回路,不能构成电解池。
③⑥
题后归纳
电解池阴极和阳极的判断依据
二、电解规律
金属阳
离子
S2-
I-
Cl-
H2O和O2
Fe3+
Cu2+
金属单质
H2
2. 用惰性电极电解电解质溶液的规律及方程式书写
(1)电解H2O型
电解质 H2SO4 NaOH Na2SO4
阳极
反应式
阴极
反应式
电解质 H2SO4 NaOH Na2SO4
电解
方程式
pH变化
复原加
入物质 加入
减小
增大
不变
H2O
(2)电解电解质型
电解质 HCl CuCl2
阳极反应式
阴极反应式
电解方程式
pH变化 —
复原加入物质 加入 加入
增大
HCl
CuCl2
(3)电解质和水都发生电解型
电解质 NaCl CuSO4
阳极反应式
阴极反应式
电解
方程式
pH变化
复原加入物质 加入 加入 或
H2↑+Cl2↑
2Cu+O2↑
增大
减小
HCl
CuO
CuCO3
3. 电解后电解质溶液的复原
使电解后的溶液恢复原状的方法:先让析出的产物(气体或沉淀)恰好完全反应,再 将其化合物投入电解后的溶液中即可。如:
①NaCl溶液:通 气体(不能加盐酸);
②AgNO3溶液:加 固体(不能加AgOH);
③CuCl2溶液:加 固体;
④KNO3溶液:加 ;
⑤CuSO4溶液:加 或 [不能加Cu2O、Cu(OH)2、
Cu2(OH)2CO3]。
HCl
Ag2O
CuCl2
H2O
CuO
CuCO3
【判断】
√
√
×
√
√
√
×
C
选项 X极 实验前U形
管中的溶液 通电后现象及结论
A 正极 Na2SO4溶液 U形管两端滴入酚酞后,a处附近溶液呈红色
B 正极 AgNO3溶液
C 负极 CuCl2溶液 b处有气体逸出
D 负极 NaOH溶液 溶液pH减小
A. 电解的最后阶段为电解水
B. 阳极先逸出氯气后逸出氧气
C. 阴极逸出氢气
D. 电解过程中溶液的pH不断增大,最后pH为7
解析:根据离子放电顺序可知,电解此混合溶液时,在阳极上阴离子放电的先后顺序 为Cl-、OH-,在阴极上H+放电,所以整个电解过程分三个阶段:电解HCl溶液、电 解NaCl溶液、电解H2O,最后溶液呈碱性,D错误。
D
A. 铜极为阴极,产生还原性气体
B. 原料室中OH-向石墨极迁移,K+向铜极迁移
D. 若电路上转移0.6 mol电子,理论上原料室溶液减少10.2 g
D
4. 按要求书写电极反应式和总反应方程式:
(1)用惰性电极电解MgCl2溶液
阳极反应式: ;
阴极反应式: ;
总反应离子方程式: 。
(2)以铝材为阳极,电解H2SO4溶液,铝材表面形成氧化膜
阳极反应式: ;
阴极反应式: ;
总反应方程式: 。
①写出电解时阴极的电极反应式: 。
Mn2++2H2O-2e-
(n-1)S↓+H2S↑
题后归纳
电解解题模板
判断:阴、阳极
明确阳极是惰性电极还是活泼电极
分析:电解质溶液的离子组成
找全离子(包括水电离的H+和OH-),并按阴、阳离子分组
写出:电池反应式
判断电极产物,注意溶液的酸碱性、产物的溶解性等
解答问题
解答有关离子浓度、pH、电极产物量的变化,溶液的复原等问题
确定:放电离子或物质
排出阴、阳离子在两极的放电顺序,确定优先放电的粒子
课时作业(二十八) 电解原理
[对点训练]
题组一 电解及装置(电解池)
A. 与电源正极相连的是电解池的阴极
B. 溶液中阳离子向阴极移动
C. 在电解池的阳极发生还原反应
D. 电子从电源的负极沿导线进入电解质溶液中
解析:电解池中,与外接电源负极相连的为阴极,与正极相连的为阳极,A错误;电 解池中,溶液中阳离子向阴极移动,B正确;电解池的阳极上发生氧化反应,C错 误;与外接电源负极相连的为阴极,电子从负极经导线流入阴极,从阳极经导线流入 正极,电子不进入电解质溶液,D错误。
B
1
2
3
4
5
6
7
8
9
10
11
12
C
1
2
3
4
5
6
7
8
9
10
11
12
A
选项 a极板 b极板 X电极 Z溶液
A 锌 石墨 负极 CuSO4
B 石墨 石墨 负极 NaOH
C 银 铁 正极 AgNO3
D 铜 石墨 负极 CuCl2
1
2
3
4
5
6
7
8
9
10
11
12
解析:a极质量增加,必定是金属在a极析出,a极一定是阴极。B选项Z溶液为 NaOH,无金属析出,不符合题意。又因为b极有无色无味气体生成,只能是O2,而D 选项电解CuCl2溶液,阳极析出Cl2,D选项不符合题意。在A、C选项中,根据电极名 称,X应当作电源的负极,故A正确。
1
2
3
4
5
6
7
8
9
10
11
12
A. 电解稀硫酸,实质上是电解水,故溶液pH不变
B. 电解稀氢氧化钠溶液,要消耗OH-,故溶液pH减小
C. 电解硫酸铜溶液,在阴极上和阳极上析出产物的物质的量之比为1∶2
D. 电解氯化铜溶液,在阴极上和阳极上析出产物的物质的量之比为1∶1
解析:电解稀硫酸,实质上是电解水,硫酸的浓度增大,pH减小,A项错误;电解稀 NaOH溶液,其实质是电解水,NaOH溶液的浓度增大,pH增大,B项错误;电解 CuSO4溶液,阴极产物是Cu,阳极产物是O2,依据得失电子数目相等,故生成Cu与 O2的物质的量之比为2∶1,C项错误;电解CuCl2溶液实质是电解CuCl2,阳极产物是 Cl2,阴极产物是Cu,依据得失电子数目相等,生成Cu和Cl2的物质的量之比为1∶1, D项正确。
D
1
2
3
4
5
6
7
8
9
10
11
12
A. 原混合溶液中c(K+)为0.2 mol·L-1
B. 上述电解过程中共转移0.2 mol电子
C. 电解得到的Cu的物质的量为0.05 mol
D. 电解后溶液中c(H+)为0.2 mol·L-1
A
1
2
3
4
5
6
7
8
9
10
11
12
1
2
3
4
5
6
7
8
9
10
11
12
题组三 信息型电解
A. Fe电极与电源正极相连
B. 电解结束后,阳极室溶液的pH将增大
B
1
2
3
4
5
6
7
8
9
10
11
12
1
2
3
4
5
6
7
8
9
10
11
12
A. 电解时OH-通过交换膜向Ti极移动
C. 阴极OH-放电,有O2生成
D. Ti电极和Cu电极上生成物的物质的量之比为2∶1
B
1
2
3
4
5
6
7
8
9
10
11
12
1
2
3
4
5
6
7
8
9
10
11
12
[综合强化]
B. 离子交换膜d为阴离子交换膜
C. 产物丙为硫酸,产物丁为氢氧化钠
D. a电极连接直流电源的正极作阳极
B
1
2
3
4
5
6
7
8
9
10
11
12
1
2
3
4
5
6
7
8
9
10
11
12
A. 开始时b电极上有红色物质析出,而后有气泡产生
B. a电极上的电子经溶液流向b电极再流入直流电源
C. 在PQ段,产生的H2和O2的体积之比为1∶2
D. 从开始到Q点,装置中产生的气体中有0.1 mol氧气
D
1
2
3
4
5
6
7
8
9
10
11
12
解析:根据电子的流向可知,a为电解池的阴极、b为电解池的阳极。b电极上无 红色物质析出,但一直有氧气产生,A项错误;电子仅在外电路中移动,溶液中 为阴、阳离子的定向移动,B项错误;由图和反应过程可知,OP段为电解CuSO4 溶液的过程,仅有氧气生成,PQ段为电解H2O的过程,则a电极上生成氢气,b 电极上生成氧气,且二者的体积之比为2∶1,C项错误;在电解过程中,每转移 4 mol电子,有1 mol O2生成,由图可知,从开始到Q点转移的电子为0.4 mol, 故有0.1 mol O2生成,D项正确。
1
2
3
4
5
6
7
8
9
10
11
12
A. 玻碳电极为阳极,发生氧化反应
C. 制得28 g C2H4时,产生67.2 L O2
D. 电解一段时间后,右池中溶液的pH可能不变
C
1
2
3
4
5
6
7
8
9
10
11
12
1
2
3
4
5
6
7
8
9
10
11
12
11. 如图是一套电解装置,两U形管中均盛有50.0 mL电解质溶液,a、b、c、d为Pt电 极,通电一段时间后,d电极上析出金属Ag 2.16 g,没有气体产生,同时在b、c两电 极收集到标准状况下相同体积的气体。请回答:
1
2
3
4
5
6
7
8
9
10
11
12
阳
O2↑
0.112
1
2
3
4
5
6
7
8
9
10
11
12
阴
Cu
1
2
3
4
5
6
7
8
9
10
11
12
(3)原CuCl2溶液中溶质的物质的量浓度为 mol·L-1。
0.10
1
2
3
4
5
6
7
8
9
10
11
12
12. 某小组同学利用如图装置对电解氯化铜溶液的实验进行了研究。
装置 现象
电解一段时间后,阳极石墨表面产生气体,阴极石墨上附着红色 物质,溶液由蓝色变为绿色
(1)甲认为电解过程中阳极产生的 是溶液变绿的原因,写出产生该物质的电 极反应式: 。
Cl2
1
2
3
4
5
6
7
8
9
10
11
12
(2)乙改用如图装置,在相同条件下电解CuCl2溶液,对溶液变色现象继续探究。
装置 现象
电解相同时间后,阳极石墨表面产生气泡,溶液仍为蓝色;阴极 石墨上附着红色物质,溶液由蓝色变为绿色
解析:(2)阳极生成了氯气,但阳极附近溶液仍为蓝色,说明不是生成的氯气溶于 水的缘故。
阳
极附近溶液仍为蓝色
1
2
3
4
5
6
7
8
9
10
11
12
(3)乙继续查阅资料:
ⅰ.电解CuCl2溶液时可能产生[CuCl2]-,[CuCl2]-掺杂Cu2+后呈黄色;
ⅱ.稀释含[CuCl2]-的溶液生成CuCl白色沉淀。
据此乙认为:电解过程中,产生的[CuCl2]-掺杂Cu2+后呈黄色,与CuCl2蓝色溶液混 合呈绿色。
乙进行如下实验:
a.取电解后绿色溶液2 mL,加20 mL水稀释,静置5分钟后溶液中产生白色沉淀。
b.另取少量氯化铜晶体和铜粉,向其中加2 mL浓盐酸,加热获得含[CuCl2]-的 黄色溶液。
c.冷却后向上述溶液……
d.取c中2 mL溶液,加20 mL水稀释,静置5分钟后溶液中产生白色沉淀。
①a的目的是 。
证明在上述实验条件下,电解后的绿色溶液中存在[CuCl2]-
1
2
3
4
5
6
7
8
9
10
11
12
乙据此得出结论:电解时阴极附近生成[CuCl2]-是导致溶液变绿的原因。
解析:(3)①根据信息,取电解后绿色溶液2 mL,加20 mL水稀释,静置5分钟后溶 液中产生白色沉淀,说明电解后的绿色溶液中存在[CuCl2]-,故a的目的是证明在上 述实验条件下,电解后的绿色溶液中存在[CuCl2]-。③c的步骤就是证明电解时阴极 附近生成[CuCl2]-是导致溶液变绿的原因,因此操作及现象为加入CuCl2蓝色溶液, 直至溶液颜色与电解后绿色溶液基本相同。
加入CuCl2蓝色溶液,直至溶液颜色与电解后绿色溶
液基本相同
1
2
3
4
5
6
7
8
9
10
11
12
第四章 化学反应与电能
第二节 电解池
第1课时 电解原理
【学习目标】 1.从宏观和微观的角度理解电解池的工作原理。2.建立对电解过程的 系统分析和认识的思维模型,理解电解的规律,会判断电解产物,会书写电解的电极 反应和总反应。3.通过对电解饱和食盐水、电镀、电解精炼铜、电冶金等原理的分 析,认识电能与化学能之间的转化。4.建立电解应用问题的分析思维模型和电解相关 计算的思维模型,加深对电解原理的理解和应用。
一、电解原理
1. 电解氯化铜溶液实验探究
(1)实验装置、现象及结论
实验现象 实验结论
电流表指针发生偏转 说明电解质溶液导电,形成闭 合回路
与负极相连的b极上逐渐覆盖了一层红色物质 析出金属铜
与正极相连的a极上有刺激性气味的气体产生,该气 体能使湿润的淀粉—碘化钾试纸变蓝 产生了氯气
Cu2+、Cl-、H+、OH-
Cl-、OH -
Cu2+、H+
2. 电解和电解池
(1)电解:使电流通过电解质溶液(或熔融电解质)而在阳极、阴极引起氧化还原 反应的过程。
(2)电解池:将电能转化为化学能的装置。
(3)电解池的电极名称
阴极:与电源 相连的电极,发生 反应;
阳极:与电源 相连的电极,发生 反应。
(4)电解池的构成条件
直流电源;两个电极(阴极、阳极);电解质溶液或熔融电解质;形成闭合回路。
负极
还原
正极
氧化
3. 电解池的工作原理
接通电路后,电源、金属导线、阴极和阳极与电解质溶液形成闭合回路(如图所 示)。
【判断】
×
×
√
×
√
A. 电源a极为负极
B. KI-淀粉溶液会变蓝色
C. Cl-向电极Ⅱ区域移动
D
2. 如图所示装置中属于电解池的是 (填序号)。
解析:①②⑤无外接直流电源,不能构成电解池;④无电解质溶液或熔融电解质;⑦ 中蔗糖不属于电解质,不能构成电解池;⑧没有形成闭合回路,不能构成电解池。
③⑥
题后归纳
电解池阴极和阳极的判断依据
二、电解规律
金属阳
离子
S2-
I-
Cl-
H2O和O2
Fe3+
Cu2+
金属单质
H2
2. 用惰性电极电解电解质溶液的规律及方程式书写
(1)电解H2O型
电解质 H2SO4 NaOH Na2SO4
阳极
反应式
阴极
反应式
电解质 H2SO4 NaOH Na2SO4
电解
方程式
pH变化
复原加
入物质 加入
减小
增大
不变
H2O
(2)电解电解质型
电解质 HCl CuCl2
阳极反应式
阴极反应式
电解方程式
pH变化 —
复原加入物质 加入 加入
增大
HCl
CuCl2
(3)电解质和水都发生电解型
电解质 NaCl CuSO4
阳极反应式
阴极反应式
电解
方程式
pH变化
复原加入物质 加入 加入 或
H2↑+Cl2↑
2Cu+O2↑
增大
减小
HCl
CuO
CuCO3
3. 电解后电解质溶液的复原
使电解后的溶液恢复原状的方法:先让析出的产物(气体或沉淀)恰好完全反应,再 将其化合物投入电解后的溶液中即可。如:
①NaCl溶液:通 气体(不能加盐酸);
②AgNO3溶液:加 固体(不能加AgOH);
③CuCl2溶液:加 固体;
④KNO3溶液:加 ;
⑤CuSO4溶液:加 或 [不能加Cu2O、Cu(OH)2、
Cu2(OH)2CO3]。
HCl
Ag2O
CuCl2
H2O
CuO
CuCO3
【判断】
√
√
×
√
√
√
×
C
选项 X极 实验前U形
管中的溶液 通电后现象及结论
A 正极 Na2SO4溶液 U形管两端滴入酚酞后,a处附近溶液呈红色
B 正极 AgNO3溶液
C 负极 CuCl2溶液 b处有气体逸出
D 负极 NaOH溶液 溶液pH减小
A. 电解的最后阶段为电解水
B. 阳极先逸出氯气后逸出氧气
C. 阴极逸出氢气
D. 电解过程中溶液的pH不断增大,最后pH为7
解析:根据离子放电顺序可知,电解此混合溶液时,在阳极上阴离子放电的先后顺序 为Cl-、OH-,在阴极上H+放电,所以整个电解过程分三个阶段:电解HCl溶液、电 解NaCl溶液、电解H2O,最后溶液呈碱性,D错误。
D
A. 铜极为阴极,产生还原性气体
B. 原料室中OH-向石墨极迁移,K+向铜极迁移
D. 若电路上转移0.6 mol电子,理论上原料室溶液减少10.2 g
D
4. 按要求书写电极反应式和总反应方程式:
(1)用惰性电极电解MgCl2溶液
阳极反应式: ;
阴极反应式: ;
总反应离子方程式: 。
(2)以铝材为阳极,电解H2SO4溶液,铝材表面形成氧化膜
阳极反应式: ;
阴极反应式: ;
总反应方程式: 。
①写出电解时阴极的电极反应式: 。
Mn2++2H2O-2e-
(n-1)S↓+H2S↑
题后归纳
电解解题模板
判断:阴、阳极
明确阳极是惰性电极还是活泼电极
分析:电解质溶液的离子组成
找全离子(包括水电离的H+和OH-),并按阴、阳离子分组
写出:电池反应式
判断电极产物,注意溶液的酸碱性、产物的溶解性等
解答问题
解答有关离子浓度、pH、电极产物量的变化,溶液的复原等问题
确定:放电离子或物质
排出阴、阳离子在两极的放电顺序,确定优先放电的粒子
课时作业(二十八) 电解原理
[对点训练]
题组一 电解及装置(电解池)
A. 与电源正极相连的是电解池的阴极
B. 溶液中阳离子向阴极移动
C. 在电解池的阳极发生还原反应
D. 电子从电源的负极沿导线进入电解质溶液中
解析:电解池中,与外接电源负极相连的为阴极,与正极相连的为阳极,A错误;电 解池中,溶液中阳离子向阴极移动,B正确;电解池的阳极上发生氧化反应,C错 误;与外接电源负极相连的为阴极,电子从负极经导线流入阴极,从阳极经导线流入 正极,电子不进入电解质溶液,D错误。
B
1
2
3
4
5
6
7
8
9
10
11
12
C
1
2
3
4
5
6
7
8
9
10
11
12
A
选项 a极板 b极板 X电极 Z溶液
A 锌 石墨 负极 CuSO4
B 石墨 石墨 负极 NaOH
C 银 铁 正极 AgNO3
D 铜 石墨 负极 CuCl2
1
2
3
4
5
6
7
8
9
10
11
12
解析:a极质量增加,必定是金属在a极析出,a极一定是阴极。B选项Z溶液为 NaOH,无金属析出,不符合题意。又因为b极有无色无味气体生成,只能是O2,而D 选项电解CuCl2溶液,阳极析出Cl2,D选项不符合题意。在A、C选项中,根据电极名 称,X应当作电源的负极,故A正确。
1
2
3
4
5
6
7
8
9
10
11
12
A. 电解稀硫酸,实质上是电解水,故溶液pH不变
B. 电解稀氢氧化钠溶液,要消耗OH-,故溶液pH减小
C. 电解硫酸铜溶液,在阴极上和阳极上析出产物的物质的量之比为1∶2
D. 电解氯化铜溶液,在阴极上和阳极上析出产物的物质的量之比为1∶1
解析:电解稀硫酸,实质上是电解水,硫酸的浓度增大,pH减小,A项错误;电解稀 NaOH溶液,其实质是电解水,NaOH溶液的浓度增大,pH增大,B项错误;电解 CuSO4溶液,阴极产物是Cu,阳极产物是O2,依据得失电子数目相等,故生成Cu与 O2的物质的量之比为2∶1,C项错误;电解CuCl2溶液实质是电解CuCl2,阳极产物是 Cl2,阴极产物是Cu,依据得失电子数目相等,生成Cu和Cl2的物质的量之比为1∶1, D项正确。
D
1
2
3
4
5
6
7
8
9
10
11
12
A. 原混合溶液中c(K+)为0.2 mol·L-1
B. 上述电解过程中共转移0.2 mol电子
C. 电解得到的Cu的物质的量为0.05 mol
D. 电解后溶液中c(H+)为0.2 mol·L-1
A
1
2
3
4
5
6
7
8
9
10
11
12
1
2
3
4
5
6
7
8
9
10
11
12
题组三 信息型电解
A. Fe电极与电源正极相连
B. 电解结束后,阳极室溶液的pH将增大
B
1
2
3
4
5
6
7
8
9
10
11
12
1
2
3
4
5
6
7
8
9
10
11
12
A. 电解时OH-通过交换膜向Ti极移动
C. 阴极OH-放电,有O2生成
D. Ti电极和Cu电极上生成物的物质的量之比为2∶1
B
1
2
3
4
5
6
7
8
9
10
11
12
1
2
3
4
5
6
7
8
9
10
11
12
[综合强化]
B. 离子交换膜d为阴离子交换膜
C. 产物丙为硫酸,产物丁为氢氧化钠
D. a电极连接直流电源的正极作阳极
B
1
2
3
4
5
6
7
8
9
10
11
12
1
2
3
4
5
6
7
8
9
10
11
12
A. 开始时b电极上有红色物质析出,而后有气泡产生
B. a电极上的电子经溶液流向b电极再流入直流电源
C. 在PQ段,产生的H2和O2的体积之比为1∶2
D. 从开始到Q点,装置中产生的气体中有0.1 mol氧气
D
1
2
3
4
5
6
7
8
9
10
11
12
解析:根据电子的流向可知,a为电解池的阴极、b为电解池的阳极。b电极上无 红色物质析出,但一直有氧气产生,A项错误;电子仅在外电路中移动,溶液中 为阴、阳离子的定向移动,B项错误;由图和反应过程可知,OP段为电解CuSO4 溶液的过程,仅有氧气生成,PQ段为电解H2O的过程,则a电极上生成氢气,b 电极上生成氧气,且二者的体积之比为2∶1,C项错误;在电解过程中,每转移 4 mol电子,有1 mol O2生成,由图可知,从开始到Q点转移的电子为0.4 mol, 故有0.1 mol O2生成,D项正确。
1
2
3
4
5
6
7
8
9
10
11
12
A. 玻碳电极为阳极,发生氧化反应
C. 制得28 g C2H4时,产生67.2 L O2
D. 电解一段时间后,右池中溶液的pH可能不变
C
1
2
3
4
5
6
7
8
9
10
11
12
1
2
3
4
5
6
7
8
9
10
11
12
11. 如图是一套电解装置,两U形管中均盛有50.0 mL电解质溶液,a、b、c、d为Pt电 极,通电一段时间后,d电极上析出金属Ag 2.16 g,没有气体产生,同时在b、c两电 极收集到标准状况下相同体积的气体。请回答:
1
2
3
4
5
6
7
8
9
10
11
12
阳
O2↑
0.112
1
2
3
4
5
6
7
8
9
10
11
12
阴
Cu
1
2
3
4
5
6
7
8
9
10
11
12
(3)原CuCl2溶液中溶质的物质的量浓度为 mol·L-1。
0.10
1
2
3
4
5
6
7
8
9
10
11
12
12. 某小组同学利用如图装置对电解氯化铜溶液的实验进行了研究。
装置 现象
电解一段时间后,阳极石墨表面产生气体,阴极石墨上附着红色 物质,溶液由蓝色变为绿色
(1)甲认为电解过程中阳极产生的 是溶液变绿的原因,写出产生该物质的电 极反应式: 。
Cl2
1
2
3
4
5
6
7
8
9
10
11
12
(2)乙改用如图装置,在相同条件下电解CuCl2溶液,对溶液变色现象继续探究。
装置 现象
电解相同时间后,阳极石墨表面产生气泡,溶液仍为蓝色;阴极 石墨上附着红色物质,溶液由蓝色变为绿色
解析:(2)阳极生成了氯气,但阳极附近溶液仍为蓝色,说明不是生成的氯气溶于 水的缘故。
阳
极附近溶液仍为蓝色
1
2
3
4
5
6
7
8
9
10
11
12
(3)乙继续查阅资料:
ⅰ.电解CuCl2溶液时可能产生[CuCl2]-,[CuCl2]-掺杂Cu2+后呈黄色;
ⅱ.稀释含[CuCl2]-的溶液生成CuCl白色沉淀。
据此乙认为:电解过程中,产生的[CuCl2]-掺杂Cu2+后呈黄色,与CuCl2蓝色溶液混 合呈绿色。
乙进行如下实验:
a.取电解后绿色溶液2 mL,加20 mL水稀释,静置5分钟后溶液中产生白色沉淀。
b.另取少量氯化铜晶体和铜粉,向其中加2 mL浓盐酸,加热获得含[CuCl2]-的 黄色溶液。
c.冷却后向上述溶液……
d.取c中2 mL溶液,加20 mL水稀释,静置5分钟后溶液中产生白色沉淀。
①a的目的是 。
证明在上述实验条件下,电解后的绿色溶液中存在[CuCl2]-
1
2
3
4
5
6
7
8
9
10
11
12
乙据此得出结论:电解时阴极附近生成[CuCl2]-是导致溶液变绿的原因。
解析:(3)①根据信息,取电解后绿色溶液2 mL,加20 mL水稀释,静置5分钟后溶 液中产生白色沉淀,说明电解后的绿色溶液中存在[CuCl2]-,故a的目的是证明在上 述实验条件下,电解后的绿色溶液中存在[CuCl2]-。③c的步骤就是证明电解时阴极 附近生成[CuCl2]-是导致溶液变绿的原因,因此操作及现象为加入CuCl2蓝色溶液, 直至溶液颜色与电解后绿色溶液基本相同。
加入CuCl2蓝色溶液,直至溶液颜色与电解后绿色溶
液基本相同
1
2
3
4
5
6
7
8
9
10
11
12
