人教版高中化学选择性必修1第四章化学反应与电能第二节电解池第3课时电化学原理的综合应用课件(共71张PPT)
文档属性
| 名称 | 人教版高中化学选择性必修1第四章化学反应与电能第二节电解池第3课时电化学原理的综合应用课件(共71张PPT) |

|
|
| 格式 | ppt | ||
| 文件大小 | 14.1MB | ||
| 资源类型 | 试卷 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2025-06-25 00:00:00 | ||
图片预览







文档简介
(共71张PPT)
第四章 化学反应与电能
第二节 电解池
第3课时 电化学原理的综合应用
一、多池串联装置
1. 常见串联装置图
(1)外接电源与电解池的串联(如图)
A、B为两个串联电解池,相同时间内,各电极得失电子数相等。
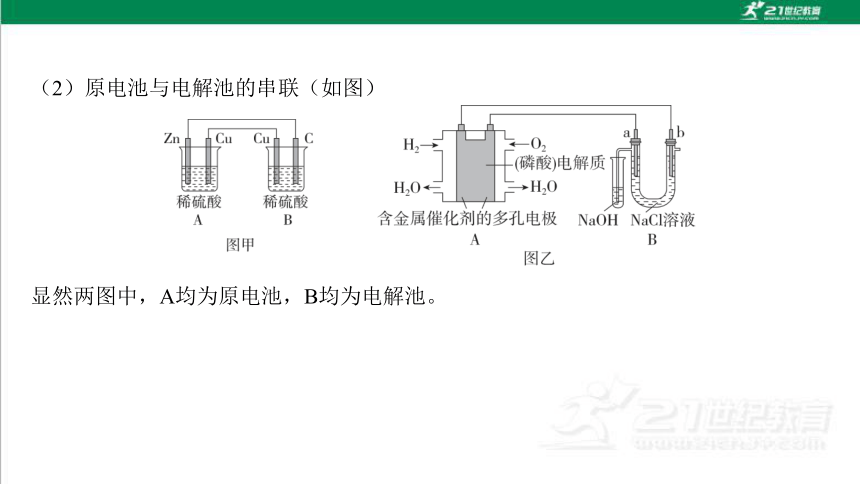
(2)原电池与电解池的串联(如图)
显然两图中,A均为原电池,B均为电解池。
2. 多池串联装置中电池类型的判断
(1)直接判断
非常直观明显的装置,如有燃料电池、铅酸蓄电池等在电路中时,则其他装置 为电解池。
如图:A为原电池,B为电解池。
(2)根据电池中的电极材料和电解质溶液判断
原电池一般是两个活动性不同的金属电极或一个金属电极和一个碳棒电极;而电解池 则一般都是两个惰性电极,如两个铂电极或两个碳棒电极。原电池中的电极材料和电 解质溶液之间能发生自发的氧化还原反应,电解池的电极材料一般不能和电解质溶液 发生自发的氧化还原反应。如图:A为电解池,B为原电池。
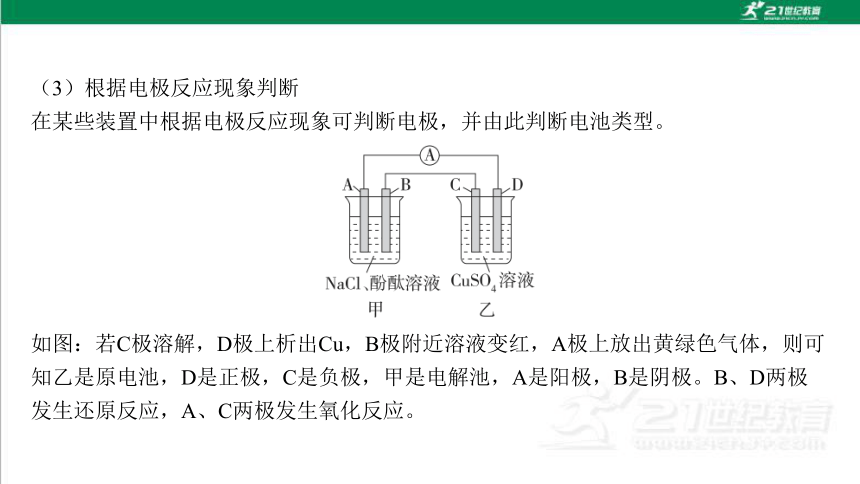
(3)根据电极反应现象判断
在某些装置中根据电极反应现象可判断电极,并由此判断电池类型。
如图:若C极溶解,D极上析出Cu,B极附近溶液变红,A极上放出黄绿色气体,则可 知乙是原电池,D是正极,C是负极,甲是电解池,A是阳极,B是阴极。B、D两极 发生还原反应,A、C两极发生氧化反应。
A. 该装置工作时,Ag电极上有气体生成
C. 甲池和乙池中溶液的pH均减小
D. 当甲池中消耗3.2 g N2H4时,乙池中理论上最
多产生6.4 g固体
C
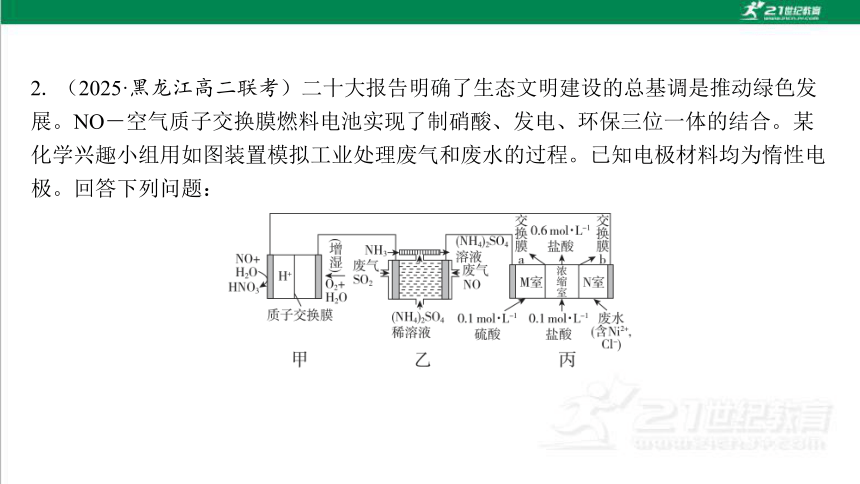
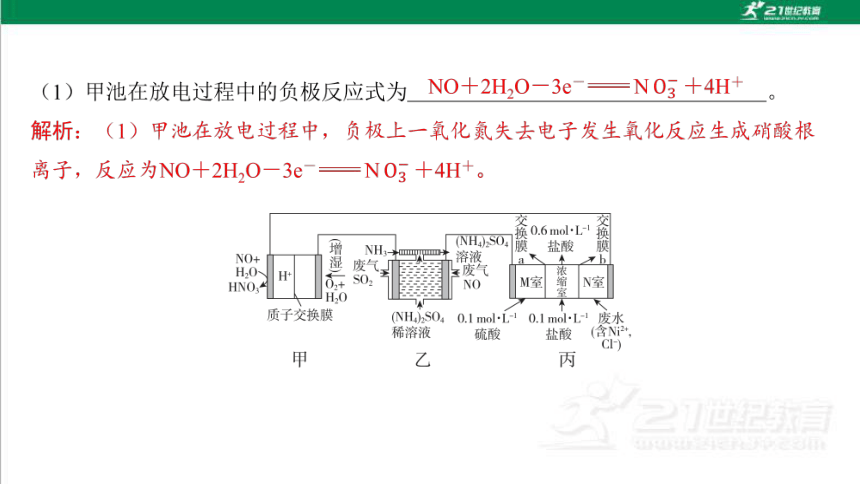
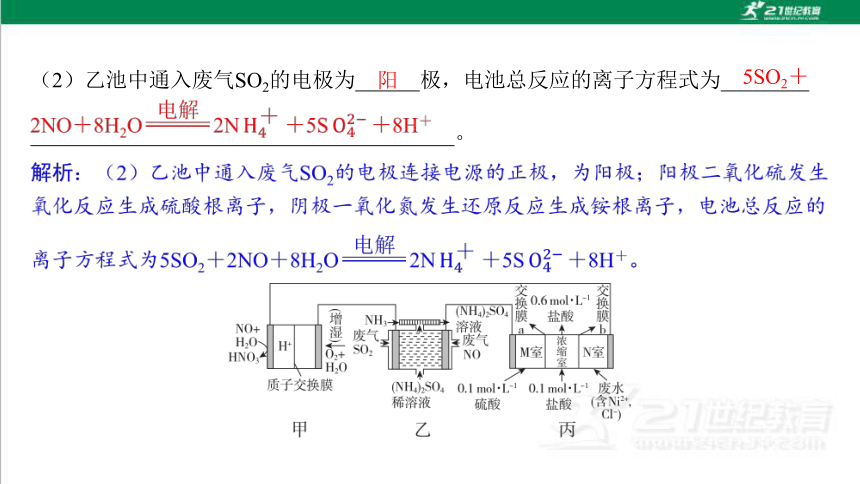
2. (2025·黑龙江高二联考)二十大报告明确了生态文明建设的总基调是推动绿色发 展。NO-空气质子交换膜燃料电池实现了制硝酸、发电、环保三位一体的结合。某 化学兴趣小组用如图装置模拟工业处理废气和废水的过程。已知电极材料均为惰性电 极。回答下列问题:
阳
5SO2+
(3)b为 (填“阳”或“阴”)离子交换膜。当浓缩室得到4 L浓度为0.6 mol·L-1的盐酸时,M室中的溶液的质量变化为 (溶液体积变化忽略不 计)。
阴
减小18 g
(4)若在标准状况下,甲池有5.6 L O2参加反应,则乙池中处理废气(SO2和NO) 的总体积为 L。
15.68
题后归纳
“串联”类装置的解题流程
二、离子交换膜的作用
1. 离子交换膜类型
(1)交换膜类型及特点
交换膜类型 阳膜 阴膜 双极膜 特定的交换膜
允许通过的 离子及移动 方向 阳离子移 向原电池 的正极 (电解池 的阴极) 阴离子移向 原电池的负 极(电解池 的阳极) 中间层中的H2O解离出H +和OH-,H+移向原电 池的正极(电解池的阴 极),OH-移向原电池 的负极(电解池的阳 极) 只允许特定的离 子或分子通过, 如质子交换膜只 允许H+通过,氯 离子交换膜只允 许Cl-通过
通性 无论是原电池还是电解池中,阳离子均移向得电子的一极,阴离子均 移向失电子的一极
(2)离子交换膜的功能:选择性透过离子,平衡电荷,形成闭合回路。
(3)离子交换膜的作用及意义
①隔离某些物质,防止发生反应,常用于物质制备。
②限制某些离子的移动,常用于物质制备及纯化。
③双极膜:由一张阳膜和一张阴膜复合制成的阴、阳复合膜。该双极膜的特点是在直 流电的作用下,阴、阳膜复合层间的H2O解离成H+和OH-并分别通过阳膜和阴膜, 作为H+和OH-的离子源。
2. 含膜电解池装置分析
(1)两室电解池:
例如,工业上利用如图两室电解装置制备烧碱:
阴极室中的电极反应:
阴极区H+放电,破坏了水的电离平衡,使OH-的浓度增大,阳极区Cl-放电,使溶液 中的c(Cl-)减小,为保持电荷守恒,阳极室中的Na+通过阳离子交换膜与阴极室 中生成的OH-结合,得到浓的NaOH溶液。利用这种方法制备物质,纯度较高,基本 没有杂质。
(2)多室电解池
例如,“四室电渗析法”制备H3PO2(次磷酸),其工作原理如图所示:
3. 离子交换膜类型的判断方法
(1)首先写出阴、阳两极上的电极反应。
(2)依据电极反应确定该电极附近哪种离子剩余。
(3)根据电极附近溶液呈电中性,从而判断出离子移动的方向。
(4)根据离子移动的方向,确定离子交换膜的类型。
A. 电极A是电源的负极
B. OH-穿过b膜进入右室溶液
D. 当催化电极生成64 g甲醇时,左侧电极室质量增加108 g
D
B. 膜a为阴离子交换膜,膜b为阳离子交换膜
C. 产品室生成的物质为NaOH
D. 当阴极产生11.2 L气体时,理论上可除去模拟海
水中5.85 g NaCl
A
三、电化学综合计算
原电池和电解池的计算包括:两极产物的定量计算、溶液的计算、相对原子质量的计 算和阿伏加德罗常数测定的计算、根据电荷守恒量求产物的量。电化学的反应本质是 氧化还原反应,各电极上转移电子的物质的量相等,无论是单一电池还是串联电解 池,均可抓住电子守恒计算。
1. 解题关键
(1)电极名称要区分清楚;
(2)电极产物要判断准确;
(3)各产物间量的关系遵循得失电子守恒。
2. 计算方法
(1)根据总反应式计算
先写出电极反应式,再写出总反应式,最后根据总反应式列出比例式计算。
(2)根据电子守恒计算
①用于串联电路中阴极和阳极产物、正极和负极产物、相同电量等类型的计算,其依 据是电路中转移的电子数相等即各电极上得(失)电子数目相等。
②用于混合溶液中电解的分阶段计算。
D
A. 电解液不能选用Li2SO4或者LiCl的水溶液
B. 电池放电时Li+从b极脱嵌,而充电时,Li+从a极脱嵌
D. 该电池工作时,每转移1 mol e-,两极质量变化之差为7 g
该电池以3.2 A恒定电流工作14分钟,消耗H2体积为0.49 L,故可测得该电池将化学 能转化为电能的转化率为 。[已知:该条件下H2的摩尔体积为24.5 L/mol;电 荷量q(C)=电流I(A)×时间(s);NA=6.0×1023 mol-1;e=
1.60×10-19 C。]
O2+4e-
70%
3. 在如图所示的装置中,若通直流电5 min时,铜电极的质量增加2.16 g。试回答下 列问题。
(1)电源中X为直流电源的 极。
解析:(1)三个装置是串联的电解池。电解AgNO3溶液时,Ag+在阴极发生还原反 应生成Ag,所以质量增加的铜电极是阴极,由此推知X是电源负极。
负
(2)pH变化:A (填“增大”“减小”或“不变”,下同),B , C 。
解析:(2)电解KCl溶液生成KOH,溶液pH增大;电解CuSO4、K2SO4溶液生成 H2SO4,溶液pH减小;电解AgNO3溶液,银为阳极,不断溶解,Ag+在阴极不断析 出,AgNO3溶液浓度基本不变,pH不变。
增大
减小
不变
(3)通电5 min时,B中共收集224 mL(标准状况下)气体,溶液体积为200 mL,则 通电前CuSO4溶液的物质的量浓度为 (设电解前后溶液体积无变 化)。
0.025 mol·L-1
(4)常温下,若A中KCl足量且溶液的体积也是200 mL,电解后,溶液的pH 为 (设电解前后溶液体积无变化)。
13
课时作业(三十) 电化学原理的综合应用
[对点训练]
题组一 多池串联装置
已知:VB2在反应中生成V2O5和B2O3。
C
A. c电极为阴极,发生氧化反应
B. 装置工作时,a电极附近溶液的pH逐渐减小
D. 当外电路中通过0.04 mol电子时,B装置中b电极理论上可收集到336 mL气体(标 准状况下)
1
2
3
4
5
6
7
8
9
10
11
1
2
3
4
5
6
7
8
9
10
11
A. a侧选择阴离子交换膜能量利用率高
B. 电流流向为Cu片 阳极(Fe)
阴极(Fe) Zn片 Cu片
D. 电解过程b侧溶液pH升高,每生成0.1 mol NaCl,电路中转移0.2 mol电子
D
1
2
3
4
5
6
7
8
9
10
11
1
2
3
4
5
6
7
8
9
10
11
题组二 离子交换膜电化学装置
A. 放电时:CuSe为正极反应物,其中Se得电子
B. 无论放电或充电,均应选用阳离子交换膜
C. 无论放电或充电,电路中每转移2 mol电子就有2 mol离子通 过离子交换膜
D. 由该装置不能推测出还原性:Zn>Cu+
D
1
2
3
4
5
6
7
8
9
10
11
1
2
3
4
5
6
7
8
9
10
11
4. (2025·河北高二期中)利用双极膜电解Na2SO4制备NaOH,捕集烟气中CO2,制备 NaHCO3。电解原理如图所示:
已知:双极膜为复合膜,可在直流电的作用下,将膜间的H2O解离,提供H+和OH-。
B. Ⅰ为阴离子交换膜,Ⅱ为阳离子交换膜
C. 电路中转移2 mol电子时共产生2 mol NaOH
A
1
2
3
4
5
6
7
8
9
10
11
1
2
3
4
5
6
7
8
9
10
11
[综合强化]
C. 为了增强污水的导电能力,可向污水中加入适量食盐
D. 若左池石墨电极产生44.8 L气体,则消耗0.5 mol甲烷
D
1
2
3
4
5
6
7
8
9
10
11
A. a>b
B. 放电时,R区域的电解质浓度逐渐增大
C. M区电解质为NaOH,放电时Na+通过
x膜移向R区
D
1
2
3
4
5
6
7
8
9
10
11
1
2
3
4
5
6
7
8
9
10
11
A. M极电势低于N极电势
B. 电解合成过程中,K+通过阳离子
交换膜向左移动
D. 理论上产生0.02 mol O2时,外电路流过的电量为3 860 C
D
1
2
3
4
5
6
7
8
9
10
11
1
2
3
4
5
6
7
8
9
10
11
B. 为提高溶液导电性,电极b区溶液中可加入少量氯化钠
C. 当电极a区生成3.0 g尿素时,电极b区质量减少7.2 g
D. 每1 mol CO2转化为尿素就有18 mol H+由b极区迁移到a极区
C
1
2
3
4
5
6
7
8
9
10
11
1
2
3
4
5
6
7
8
9
10
11
1
2
3
4
5
6
7
8
9
10
11
A. 电极电势:电极b>电极a
B. 电解过程中,阳极室中KOH的物质的
量保持不变
D. 当阳极产生32 g O2时,“卯榫”结构双极
膜处有36 g H2O被解离
D
1
2
3
4
5
6
7
8
9
10
11
1
2
3
4
5
6
7
8
9
10
11
Fe-
1
2
3
4
5
6
7
8
9
10
11
1
2
3
4
5
6
7
8
9
10
11
(2)一段时间后,若X极质量减小1.12 g,Y极收集到2.24 L气体,则在X极收集到 的气体为 mL(均已折算为标准状况时的气体体积)。
448
1
2
3
4
5
6
7
8
9
10
11
(3)装置丙中,若外电路中有0.1 mol电子转移,隔膜右侧溶液质量 (填 “增加”或“减少”)了 g。
减少
8
1
2
3
4
5
6
7
8
9
10
11
不变
2CoCl2+
1
2
3
4
5
6
7
8
9
10
11
1
2
3
4
5
6
7
8
9
10
11
11. (2025·沧州高二阶段)电动势是由电池中存在离子浓度差而产生的,该电池称为 离子浓差电池(两侧离子浓度趋于相等)。某小组设计离子浓差电池,如图甲所示。 以离子浓差电池为电源利用废料LiMn2O4制备二氧化锰、难溶性Li2CO3,如图乙所 示。滤布的作用是阻挡固体颗粒,但离子可自由通过。
1
2
3
4
5
6
7
8
9
10
11
(1)图甲中离子交换膜R是 (填“阳离子”“阴离子”或“质子”)交 换膜。
阴离子
回答下列问题:
1
2
3
4
5
6
7
8
9
10
11
(2)图甲中b极与图乙中 (填“A”或“B”)极连接。
解析:(2)电极A上LiMn2O4得到电子发生还原反应生成锰离子,为阴极,图甲中b 极与图乙中A极连接;
A
1
2
3
4
5
6
7
8
9
10
11
4H2O
1
2
3
4
5
6
7
8
9
10
11
(4)电解一段时间后溶液中Mn2+浓度 (填“增大”“减小”或“不 变”),判断依据是 。
增大
反应生成了锰离子,溶液中锰离子浓度增大
1
2
3
4
5
6
7
8
9
10
11
Li2CO3↓+H2O+CO2↑
1
2
3
4
5
6
7
8
9
10
11
(6)已知图甲中交换膜两侧溶液都是200 mL,忽略体积变化。利用图甲作电源,理 论上制备MnO2质量为 g。
34.8
1
2
3
4
5
6
7
8
9
10
11
第四章 化学反应与电能
第二节 电解池
第3课时 电化学原理的综合应用
一、多池串联装置
1. 常见串联装置图
(1)外接电源与电解池的串联(如图)
A、B为两个串联电解池,相同时间内,各电极得失电子数相等。
(2)原电池与电解池的串联(如图)
显然两图中,A均为原电池,B均为电解池。
2. 多池串联装置中电池类型的判断
(1)直接判断
非常直观明显的装置,如有燃料电池、铅酸蓄电池等在电路中时,则其他装置 为电解池。
如图:A为原电池,B为电解池。
(2)根据电池中的电极材料和电解质溶液判断
原电池一般是两个活动性不同的金属电极或一个金属电极和一个碳棒电极;而电解池 则一般都是两个惰性电极,如两个铂电极或两个碳棒电极。原电池中的电极材料和电 解质溶液之间能发生自发的氧化还原反应,电解池的电极材料一般不能和电解质溶液 发生自发的氧化还原反应。如图:A为电解池,B为原电池。
(3)根据电极反应现象判断
在某些装置中根据电极反应现象可判断电极,并由此判断电池类型。
如图:若C极溶解,D极上析出Cu,B极附近溶液变红,A极上放出黄绿色气体,则可 知乙是原电池,D是正极,C是负极,甲是电解池,A是阳极,B是阴极。B、D两极 发生还原反应,A、C两极发生氧化反应。
A. 该装置工作时,Ag电极上有气体生成
C. 甲池和乙池中溶液的pH均减小
D. 当甲池中消耗3.2 g N2H4时,乙池中理论上最
多产生6.4 g固体
C
2. (2025·黑龙江高二联考)二十大报告明确了生态文明建设的总基调是推动绿色发 展。NO-空气质子交换膜燃料电池实现了制硝酸、发电、环保三位一体的结合。某 化学兴趣小组用如图装置模拟工业处理废气和废水的过程。已知电极材料均为惰性电 极。回答下列问题:
阳
5SO2+
(3)b为 (填“阳”或“阴”)离子交换膜。当浓缩室得到4 L浓度为0.6 mol·L-1的盐酸时,M室中的溶液的质量变化为 (溶液体积变化忽略不 计)。
阴
减小18 g
(4)若在标准状况下,甲池有5.6 L O2参加反应,则乙池中处理废气(SO2和NO) 的总体积为 L。
15.68
题后归纳
“串联”类装置的解题流程
二、离子交换膜的作用
1. 离子交换膜类型
(1)交换膜类型及特点
交换膜类型 阳膜 阴膜 双极膜 特定的交换膜
允许通过的 离子及移动 方向 阳离子移 向原电池 的正极 (电解池 的阴极) 阴离子移向 原电池的负 极(电解池 的阳极) 中间层中的H2O解离出H +和OH-,H+移向原电 池的正极(电解池的阴 极),OH-移向原电池 的负极(电解池的阳 极) 只允许特定的离 子或分子通过, 如质子交换膜只 允许H+通过,氯 离子交换膜只允 许Cl-通过
通性 无论是原电池还是电解池中,阳离子均移向得电子的一极,阴离子均 移向失电子的一极
(2)离子交换膜的功能:选择性透过离子,平衡电荷,形成闭合回路。
(3)离子交换膜的作用及意义
①隔离某些物质,防止发生反应,常用于物质制备。
②限制某些离子的移动,常用于物质制备及纯化。
③双极膜:由一张阳膜和一张阴膜复合制成的阴、阳复合膜。该双极膜的特点是在直 流电的作用下,阴、阳膜复合层间的H2O解离成H+和OH-并分别通过阳膜和阴膜, 作为H+和OH-的离子源。
2. 含膜电解池装置分析
(1)两室电解池:
例如,工业上利用如图两室电解装置制备烧碱:
阴极室中的电极反应:
阴极区H+放电,破坏了水的电离平衡,使OH-的浓度增大,阳极区Cl-放电,使溶液 中的c(Cl-)减小,为保持电荷守恒,阳极室中的Na+通过阳离子交换膜与阴极室 中生成的OH-结合,得到浓的NaOH溶液。利用这种方法制备物质,纯度较高,基本 没有杂质。
(2)多室电解池
例如,“四室电渗析法”制备H3PO2(次磷酸),其工作原理如图所示:
3. 离子交换膜类型的判断方法
(1)首先写出阴、阳两极上的电极反应。
(2)依据电极反应确定该电极附近哪种离子剩余。
(3)根据电极附近溶液呈电中性,从而判断出离子移动的方向。
(4)根据离子移动的方向,确定离子交换膜的类型。
A. 电极A是电源的负极
B. OH-穿过b膜进入右室溶液
D. 当催化电极生成64 g甲醇时,左侧电极室质量增加108 g
D
B. 膜a为阴离子交换膜,膜b为阳离子交换膜
C. 产品室生成的物质为NaOH
D. 当阴极产生11.2 L气体时,理论上可除去模拟海
水中5.85 g NaCl
A
三、电化学综合计算
原电池和电解池的计算包括:两极产物的定量计算、溶液的计算、相对原子质量的计 算和阿伏加德罗常数测定的计算、根据电荷守恒量求产物的量。电化学的反应本质是 氧化还原反应,各电极上转移电子的物质的量相等,无论是单一电池还是串联电解 池,均可抓住电子守恒计算。
1. 解题关键
(1)电极名称要区分清楚;
(2)电极产物要判断准确;
(3)各产物间量的关系遵循得失电子守恒。
2. 计算方法
(1)根据总反应式计算
先写出电极反应式,再写出总反应式,最后根据总反应式列出比例式计算。
(2)根据电子守恒计算
①用于串联电路中阴极和阳极产物、正极和负极产物、相同电量等类型的计算,其依 据是电路中转移的电子数相等即各电极上得(失)电子数目相等。
②用于混合溶液中电解的分阶段计算。
D
A. 电解液不能选用Li2SO4或者LiCl的水溶液
B. 电池放电时Li+从b极脱嵌,而充电时,Li+从a极脱嵌
D. 该电池工作时,每转移1 mol e-,两极质量变化之差为7 g
该电池以3.2 A恒定电流工作14分钟,消耗H2体积为0.49 L,故可测得该电池将化学 能转化为电能的转化率为 。[已知:该条件下H2的摩尔体积为24.5 L/mol;电 荷量q(C)=电流I(A)×时间(s);NA=6.0×1023 mol-1;e=
1.60×10-19 C。]
O2+4e-
70%
3. 在如图所示的装置中,若通直流电5 min时,铜电极的质量增加2.16 g。试回答下 列问题。
(1)电源中X为直流电源的 极。
解析:(1)三个装置是串联的电解池。电解AgNO3溶液时,Ag+在阴极发生还原反 应生成Ag,所以质量增加的铜电极是阴极,由此推知X是电源负极。
负
(2)pH变化:A (填“增大”“减小”或“不变”,下同),B , C 。
解析:(2)电解KCl溶液生成KOH,溶液pH增大;电解CuSO4、K2SO4溶液生成 H2SO4,溶液pH减小;电解AgNO3溶液,银为阳极,不断溶解,Ag+在阴极不断析 出,AgNO3溶液浓度基本不变,pH不变。
增大
减小
不变
(3)通电5 min时,B中共收集224 mL(标准状况下)气体,溶液体积为200 mL,则 通电前CuSO4溶液的物质的量浓度为 (设电解前后溶液体积无变 化)。
0.025 mol·L-1
(4)常温下,若A中KCl足量且溶液的体积也是200 mL,电解后,溶液的pH 为 (设电解前后溶液体积无变化)。
13
课时作业(三十) 电化学原理的综合应用
[对点训练]
题组一 多池串联装置
已知:VB2在反应中生成V2O5和B2O3。
C
A. c电极为阴极,发生氧化反应
B. 装置工作时,a电极附近溶液的pH逐渐减小
D. 当外电路中通过0.04 mol电子时,B装置中b电极理论上可收集到336 mL气体(标 准状况下)
1
2
3
4
5
6
7
8
9
10
11
1
2
3
4
5
6
7
8
9
10
11
A. a侧选择阴离子交换膜能量利用率高
B. 电流流向为Cu片 阳极(Fe)
阴极(Fe) Zn片 Cu片
D. 电解过程b侧溶液pH升高,每生成0.1 mol NaCl,电路中转移0.2 mol电子
D
1
2
3
4
5
6
7
8
9
10
11
1
2
3
4
5
6
7
8
9
10
11
题组二 离子交换膜电化学装置
A. 放电时:CuSe为正极反应物,其中Se得电子
B. 无论放电或充电,均应选用阳离子交换膜
C. 无论放电或充电,电路中每转移2 mol电子就有2 mol离子通 过离子交换膜
D. 由该装置不能推测出还原性:Zn>Cu+
D
1
2
3
4
5
6
7
8
9
10
11
1
2
3
4
5
6
7
8
9
10
11
4. (2025·河北高二期中)利用双极膜电解Na2SO4制备NaOH,捕集烟气中CO2,制备 NaHCO3。电解原理如图所示:
已知:双极膜为复合膜,可在直流电的作用下,将膜间的H2O解离,提供H+和OH-。
B. Ⅰ为阴离子交换膜,Ⅱ为阳离子交换膜
C. 电路中转移2 mol电子时共产生2 mol NaOH
A
1
2
3
4
5
6
7
8
9
10
11
1
2
3
4
5
6
7
8
9
10
11
[综合强化]
C. 为了增强污水的导电能力,可向污水中加入适量食盐
D. 若左池石墨电极产生44.8 L气体,则消耗0.5 mol甲烷
D
1
2
3
4
5
6
7
8
9
10
11
A. a>b
B. 放电时,R区域的电解质浓度逐渐增大
C. M区电解质为NaOH,放电时Na+通过
x膜移向R区
D
1
2
3
4
5
6
7
8
9
10
11
1
2
3
4
5
6
7
8
9
10
11
A. M极电势低于N极电势
B. 电解合成过程中,K+通过阳离子
交换膜向左移动
D. 理论上产生0.02 mol O2时,外电路流过的电量为3 860 C
D
1
2
3
4
5
6
7
8
9
10
11
1
2
3
4
5
6
7
8
9
10
11
B. 为提高溶液导电性,电极b区溶液中可加入少量氯化钠
C. 当电极a区生成3.0 g尿素时,电极b区质量减少7.2 g
D. 每1 mol CO2转化为尿素就有18 mol H+由b极区迁移到a极区
C
1
2
3
4
5
6
7
8
9
10
11
1
2
3
4
5
6
7
8
9
10
11
1
2
3
4
5
6
7
8
9
10
11
A. 电极电势:电极b>电极a
B. 电解过程中,阳极室中KOH的物质的
量保持不变
D. 当阳极产生32 g O2时,“卯榫”结构双极
膜处有36 g H2O被解离
D
1
2
3
4
5
6
7
8
9
10
11
1
2
3
4
5
6
7
8
9
10
11
Fe-
1
2
3
4
5
6
7
8
9
10
11
1
2
3
4
5
6
7
8
9
10
11
(2)一段时间后,若X极质量减小1.12 g,Y极收集到2.24 L气体,则在X极收集到 的气体为 mL(均已折算为标准状况时的气体体积)。
448
1
2
3
4
5
6
7
8
9
10
11
(3)装置丙中,若外电路中有0.1 mol电子转移,隔膜右侧溶液质量 (填 “增加”或“减少”)了 g。
减少
8
1
2
3
4
5
6
7
8
9
10
11
不变
2CoCl2+
1
2
3
4
5
6
7
8
9
10
11
1
2
3
4
5
6
7
8
9
10
11
11. (2025·沧州高二阶段)电动势是由电池中存在离子浓度差而产生的,该电池称为 离子浓差电池(两侧离子浓度趋于相等)。某小组设计离子浓差电池,如图甲所示。 以离子浓差电池为电源利用废料LiMn2O4制备二氧化锰、难溶性Li2CO3,如图乙所 示。滤布的作用是阻挡固体颗粒,但离子可自由通过。
1
2
3
4
5
6
7
8
9
10
11
(1)图甲中离子交换膜R是 (填“阳离子”“阴离子”或“质子”)交 换膜。
阴离子
回答下列问题:
1
2
3
4
5
6
7
8
9
10
11
(2)图甲中b极与图乙中 (填“A”或“B”)极连接。
解析:(2)电极A上LiMn2O4得到电子发生还原反应生成锰离子,为阴极,图甲中b 极与图乙中A极连接;
A
1
2
3
4
5
6
7
8
9
10
11
4H2O
1
2
3
4
5
6
7
8
9
10
11
(4)电解一段时间后溶液中Mn2+浓度 (填“增大”“减小”或“不 变”),判断依据是 。
增大
反应生成了锰离子,溶液中锰离子浓度增大
1
2
3
4
5
6
7
8
9
10
11
Li2CO3↓+H2O+CO2↑
1
2
3
4
5
6
7
8
9
10
11
(6)已知图甲中交换膜两侧溶液都是200 mL,忽略体积变化。利用图甲作电源,理 论上制备MnO2质量为 g。
34.8
1
2
3
4
5
6
7
8
9
10
11
