人教版高中化学选择性必修1第四章化学反应与电能第二节电解池第2课时电解原理的应用课件(共77张PPT)
文档属性
| 名称 | 人教版高中化学选择性必修1第四章化学反应与电能第二节电解池第2课时电解原理的应用课件(共77张PPT) |  | |
| 格式 | ppt | ||
| 文件大小 | 13.6MB | ||
| 资源类型 | 试卷 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2025-06-25 18:09:42 | ||
图片预览









文档简介
(共77张PPT)
第四章 化学反应与电能
第二节 电解池
第2课时 电解原理的应用
一、电解饱和食盐水——氯碱工业
烧碱、氯气都是重要的化工原料,习惯上把电解饱和食盐水的工业生产叫做氯 碱工业。
1. 电解饱和食盐水的原理
阳极反应: (氧化反应);
阴极反应: (还原反应);
阳离子交换膜作用:①防止阴极产生的H2和阳极产生的Cl2相混合而引起爆炸;②避 免Cl2与NaOH作用生成NaClO而影响烧碱的质量。
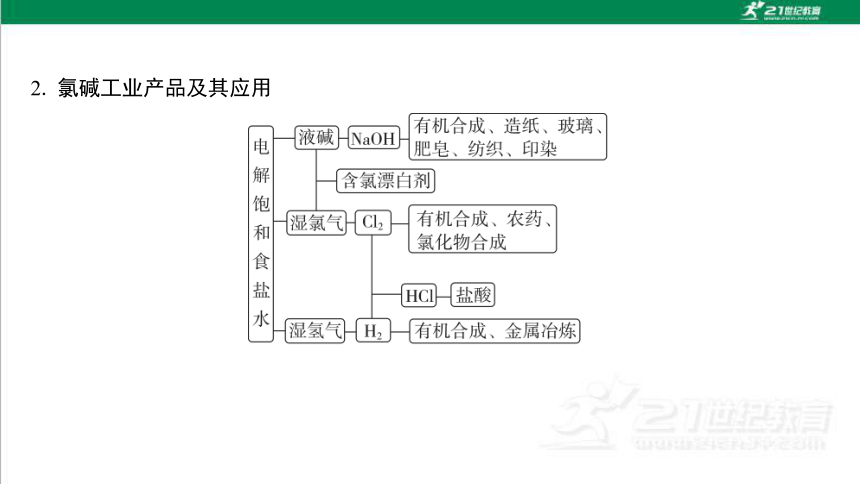
2. 氯碱工业产品及其应用
×
×
×
×
A. 电极A接电源正极,发生氧化反应
C. 应选用阳离子交换膜,在右室获得浓度较高的
NaOH溶液
D. 改进设计中通过提高电极B上反应物的氧化性
来降低电解电压,减少能耗
B
B. 离子交换膜为阴离子交换膜
C. 电解时海水中动能高的水分子可穿过PTFE膜
D. 海水为电解池补水的速率为2x mol·h-1
D
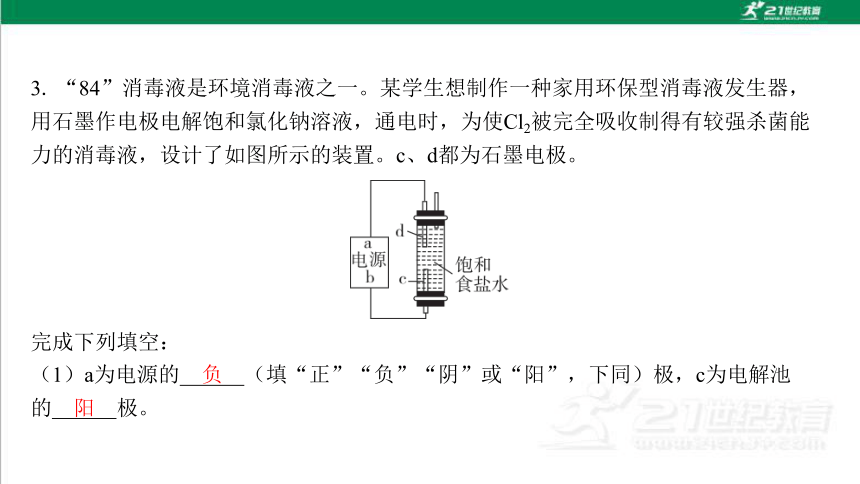
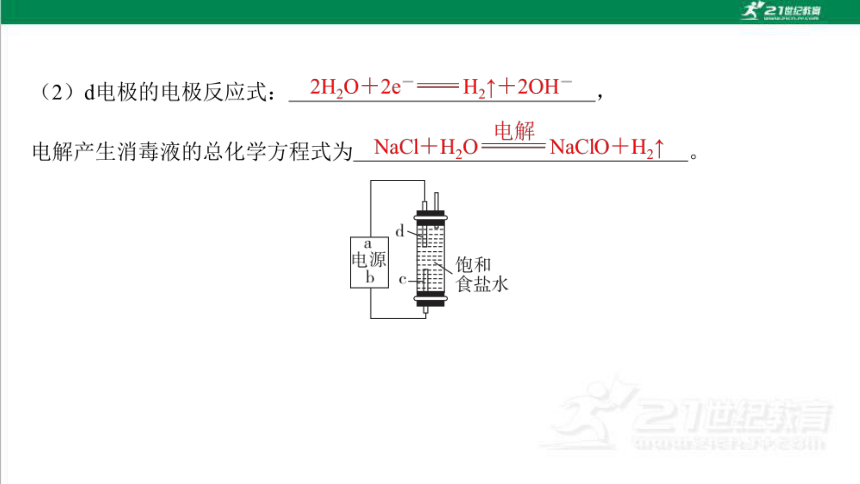
3. “84”消毒液是环境消毒液之一。某学生想制作一种家用环保型消毒液发生器, 用石墨作电极电解饱和氯化钠溶液,通电时,为使Cl2被完全吸收制得有较强杀菌能 力的消毒液,设计了如图所示的装置。c、d都为石墨电极。
完成下列填空:
(1)a为电源的 (填“正”“负”“阴”或“阳”,下同)极,c为电解池 的 极。
负
阳
二、电镀 精炼和电冶金
1. 电镀
(1)电镀是利用电解原理在某些金属表面镀上一薄层其他金属或合金的加工工艺。
(2)电镀可增强金属的抗腐蚀能力,增加表面硬度和美观。
阳极材料 镀层金属Cu
阴极材料 镀件金属Fe
电镀液 含镀层金属离子CuSO4溶液
阳极反应
阴极反应
溶液变化 电解质溶液的浓度
不变
2. 电解精炼铜
电解精炼粗铜时,以待精炼的铜作阳极,用CuSO4溶液作电解质溶液,可得含铜量为 99.95%~99.98%的电解铜。
阳极材料 粗铜(含Zn、Fe、Ni、Ag、Au等)
阴极材料 纯铜
阳极反应 、
、
、
阳极材料 粗铜(含Zn、Fe、Ni、Ag、Au等)
阴极反应
“阳极泥” Ag、Au等金属杂质失电子能力弱,会以单质形式沉积,形成“ ”
溶液变化 ①电解质溶液的Cu2+浓度
②引入了Zn2+、Fe2+、Ni2+等杂质,需定时除去
阳极泥
减小
3. 电冶金
冶炼钠 冶炼铝
电极
反应 阳极:
阴极:
总反应
2Na+Cl2↑
【思考交流】
冶炼钠
(1)电解熔融NaCl装置示意图
阴极环绕在阳极外面,两极之间用隔膜D隔开。
提示:(1)NaCl Cl2 阴 阳 阴
(2)电解时的反应
阳极: ;
阴极: ;
总反应: 。
【判断】
√
√
×
×
B. 阴极上Al被氧化
C. 在电解槽底部产生含Cu的阳极泥
D. 阳极和阴极的质量变化相等
C
解析:根据电解原理可知,电解池中阳极发生失电子的氧化反应,阴极发生得电子的 还原反应,该题中以熔融盐为电解液,含Cu、Mg和Si等的铝合金废料为阳极进行电 解,通过控制一定的条件,从而可使阳极区Mg和Al发生失电子的氧化反应,分别生 成Mg2+和Al3+,Cu和Si不参与反应,阴极上Al3+得电子生成铝单质,从而实现Al的 再生,据此分析解答。阴极应该发生Al3+得电子的还原反应,而Mg在阳极失电子生 成Mg2+,A错误;Al在阳极上被氧化生成Al3+,B错误;阳极材料中Cu和Si不参与氧 化反应,在电解槽底部可形成阳极泥,C正确;因为阳极除了铝参与电子转移,镁也 参与了电子转移,且还会形成阳极泥,而阴极只有铝离子得电子生成铝单质,根据得 失电子守恒及元素守恒可知,阳极与阴极的质量变化不相等,D错误。
氧化
不相等
Fe2+
Zn2+
Cu、Pt
3. 如图为工业电解熔融氧化铝冶炼铝的装置示意图。
(2)资料表明Al2O3的熔点为2 054 ℃,冰晶石(Na3AlF6)的熔点为1 000 ℃,用电 解Al2O3制取金属铝时会加入冰晶石,其作用是 。
作助熔剂,降低Al2O3的熔点
(3)该电解过程要在1 000 ℃以上进行,工业上冶炼铝过程中会发生阳极损耗,试分 析发生阳极损耗原因: 。
高温下,阳极产生的氧气与碳块反应生成CO、CO2
题后归纳
(1)电解精炼过程中的“两不等”:电解质溶液浓度在电解前后不相等;阴极 增加的质量和阳极减少的质量不相等。
(2)电镀过程中的“一多,一少,一不变”:“一多”指阴极上有镀层金属沉 积;“一少”指阳极上有镀层金属溶解;“一不变”指电镀液(电解质溶液)的浓度 不变。
三、 电解原理的创新应用
1. 电解原理常见的考查点
电解原理及应用是高考高频考点,该类试题往往与生产、生活及新科技等相联系,以 装置图或流程图为载体呈现,题材广、信息新,题目具有一定难度。主要考查阴、阳 极的判断、电极反应式、电解反应方程式的书写、溶液离子浓度变化及有关计算等。
2. “5点”突破电解综合应用题
(1)分清阴、阳极,与电源正极相连的为阳极,与电源负极相连的为阴极,两极反 应为“阳氧阴还”。
(2)剖析离子移向,阳离子移向阴极,阴离子移向阳极。
(3)注意放电顺序,正确判断放电的粒子或物质。
(4)注意介质,正确判断反应产物,酸性介质不出现OH-,碱性介质不出现H+;不 能想当然地认为金属作阳极,电极产物为金属阳离子。
(5)注意得失电子守恒和电荷守恒,正确书写电极反应式。
类型一 电解在物质转化和制备中应用
B. 阴极区溶液中OH-浓度逐渐升高
C. 理论上每消耗1 mol Fe2O3,阳极室溶液减少213 g
D. 理论上每消耗1 mol Fe2O3,阴极室物质最多增加138 g
C
A. 电解时电极N上产生OH-
B. 电解时电极M上发生氧化反应
C. 阴、阳离子交换膜均有两种离子通过
D
类型二 电解原理在环境治理中应用
C
A. 该芬顿系统能量转化形式为太阳能→电能→化学能
C. 光阳极每消耗1 mol H2O,体系中生成2 mol H2O2
D. H2O2在Mn(Ⅱ)/Mn(Ⅳ)的循环反应中表现出氧化性和还原性
A. 该装置工作时,可视Pb为惰性电极
C. 吸收塔中每消耗2 mol NO,有4 mol H+通过质子膜
D. 每处理1 mol NO,电解池将产生11.2 L O2
D
类型三 电解原理在废物回收利用中的应用
B. 电极a连接铅蓄电池负极,甲池中NaOH浓度逐渐增大
D. 若电路中通过0.2 mol e-,理论上铅酸蓄电池负极
增重30.3 g
D
A. 太阳能电池板经光照产生的电子流向a电极
D. 电解前除去LiCoO2中的杂质,可提高Co(OH)2的
纯度
A
课时作业(二十九) 电解原理的应用
[对点训练]
题组一 氯碱工业
A. 装置中的离子交换膜只能让阳离子通过,
不能让阴离子通过
B. 装置中出口①处的物质是氯气,出口B处的
物质是浓度较大NaOH溶液
C. 阴极区加入少量NaOH是为了增强溶液的导电性
D. 产生氢气8.96 L(标准状况)时,理论上通过交
换膜的钠离子Na+为0.4 mol
D
1
2
3
4
5
6
7
8
9
10
11
12
1
2
3
4
5
6
7
8
9
10
11
12
A. 采用阳离子交换膜,可以提高NaOH纯度
D. 电解过程中转移4 mol电子,理论上可获得4 mol NaOH
C
1
2
3
4
5
6
7
8
9
10
11
12
1
2
3
4
5
6
7
8
9
10
11
12
A. 在钥匙上镀铜时,钥匙应接电源正极
B. 电解熔融NaCl可冶炼金属Na
D. 离子交换膜电解槽电解饱和NaCl溶液可制备NaOH
A
1
2
3
4
5
6
7
8
9
10
11
12
1
2
3
4
5
6
7
8
9
10
11
12
A. a极是电源的正极,O2-在熔融盐中从右往左迁移
C. NaCl-NaF融盐的作用是降低熔化TiO2需要的温度
D. 阳极每产生4.48 L的O2,理论上能生成0.1 mol钛
D
1
2
3
4
5
6
7
8
9
10
11
12
1
2
3
4
5
6
7
8
9
10
11
12
B. 电解过程中阳极附近pH明显升高
C. 电路中流经4 mol电子,阳极收集到22.4 L气体
D. Na2PbCl4浓度下降后,在阴极区加入适量PbO,可实现电解质溶 液的再生使用
D
1
2
3
4
5
6
7
8
9
10
11
12
1
2
3
4
5
6
7
8
9
10
11
12
A. X为电源的负极
C. 电解一段时间后熔融盐中O2-的物质的量增多
D. 该条件下,每产生22.4 L H2,电路中转移2 mol 电子
B
1
2
3
4
5
6
7
8
9
10
11
12
1
2
3
4
5
6
7
8
9
10
11
12
A. 电极b接电源负极
B
1
2
3
4
5
6
7
8
9
10
11
12
1
2
3
4
5
6
7
8
9
10
11
12
[综合强化]
A. 甲池若为精炼铜的装置,A极材料是粗铜
B. 乙池中若滴入少量酚酞溶液,开始一段时间后C极附近变浅红色
C. 若甲池为电镀铜的装置,阴极增重12.8 g,乙池阳极放出气体为4.48 L
D
1
2
3
4
5
6
7
8
9
10
11
12
A. 若直流电源为铅酸蓄电池,则a极电极材料为Pb
B. Y为HCl溶液,且浓度比加入的HCl溶液浓度大
C. 若阴离子交换膜中通过6 mol阴离子,可生成
6 mol ClO2气体
D. X的溶质主要为NaCl
C
1
2
3
4
5
6
7
8
9
10
11
12
1
2
3
4
5
6
7
8
9
10
11
12
A. 电极X为直流电源的负极
B. 质子交换膜中氢离子向左移动
D. 理论上电源提供2 mol e-能生成1 mol氧气
D
1
2
3
4
5
6
7
8
9
10
11
12
1
2
3
4
5
6
7
8
9
10
11
12
11. 电解的应用比较广泛,回答下列问题:
(1)由下列物质冶炼相应金属时采用电解法的是 (填字母,下同)。
a.Fe2O3 b.NaCl
c.Cu2S d.Al2O3
解析:(1)电解法适合冶炼Na、Mg、Al等强还原性金属,在熔融状态下,分别电解 NaCl、Al2O3冶炼Na和Al。Fe和Cu的还原性较弱,用Fe2O3、Cu2S冶炼相应金属时, 采用加还原剂热还原法。
bd
1
2
3
4
5
6
7
8
9
10
11
12
(2)以CuSO4溶液为电解质溶液进行粗铜(含Al、Zn、Ag、Pt、Au等杂质)的电解 精炼,下列说法正确的是 。
a.电能全部转化为化学能
b.粗铜接电源正极,发生氧化反应
c.溶液中Cu2+向阳极移动
d.利用阳极泥可回收Ag、Pt、Au等金属
e.若阳极质量减少64 g,则转移电子数为2NA(设NA为阿伏加德罗常数的值)
bdf
1
2
3
4
5
6
7
8
9
10
11
12
1
2
3
4
5
6
7
8
9
10
11
12
a
NO2↑+H2O
1
2
3
4
5
6
7
8
9
10
11
12
1
2
3
4
5
6
7
8
9
10
11
12
1
2
3
4
5
6
7
8
9
10
11
12
LiOH
B
1
2
3
4
5
6
7
8
9
10
11
12
1
2
3
4
5
6
7
8
9
10
11
12
负
H2
1
2
3
4
5
6
7
8
9
10
11
12
12. (2025·天津高二阶段练习)氨是一种重要的化工原料,电化学合成氨在工业上起 着相当重要的作用。
(1)电解法合成氨反应装置如图所示。
①b极为 极,a极的电极反应式为 。
阳
1
2
3
4
5
6
7
8
9
10
11
12
②电解装置中通过质子交换膜的粒子移动方向为 。
A. 从左到右 B. 从右到左
B
③若b极产生的O2在一定条件下的体积为336 L,a极中通入相同条件下N2的总体积为 672 L,则N2的转化率为 %(保留两位有效数字)。
33
1
2
3
4
5
6
7
8
9
10
11
12
1
2
3
4
5
6
7
8
9
10
11
12
(2)科学家在以悬浮的纳米Fe2O3作催化剂,H2O和N2为原料直接常压电化学合成氨 方面取得了突破性进展。其工作原理如图所示。
Fe2O3+
②蒙乃尔筛网处发生的电极反应为 。
1
2
3
4
5
6
7
8
9
10
11
12
1
2
3
4
5
6
7
8
9
10
11
12
(3)电解硝酸工业的尾气NO可制备NH4NO3,其工作原理如图所示:
①阴极的电极反应式为 。
②将电解生成的HNO3全部转化为NH4NO3,则通入的NH3与实际参加反应的NO的物 质的量之比至少为 。
1∶4
1
2
3
4
5
6
7
8
9
10
11
12
1
2
3
4
5
6
7
8
9
10
11
12
第四章 化学反应与电能
第二节 电解池
第2课时 电解原理的应用
一、电解饱和食盐水——氯碱工业
烧碱、氯气都是重要的化工原料,习惯上把电解饱和食盐水的工业生产叫做氯 碱工业。
1. 电解饱和食盐水的原理
阳极反应: (氧化反应);
阴极反应: (还原反应);
阳离子交换膜作用:①防止阴极产生的H2和阳极产生的Cl2相混合而引起爆炸;②避 免Cl2与NaOH作用生成NaClO而影响烧碱的质量。
2. 氯碱工业产品及其应用
×
×
×
×
A. 电极A接电源正极,发生氧化反应
C. 应选用阳离子交换膜,在右室获得浓度较高的
NaOH溶液
D. 改进设计中通过提高电极B上反应物的氧化性
来降低电解电压,减少能耗
B
B. 离子交换膜为阴离子交换膜
C. 电解时海水中动能高的水分子可穿过PTFE膜
D. 海水为电解池补水的速率为2x mol·h-1
D
3. “84”消毒液是环境消毒液之一。某学生想制作一种家用环保型消毒液发生器, 用石墨作电极电解饱和氯化钠溶液,通电时,为使Cl2被完全吸收制得有较强杀菌能 力的消毒液,设计了如图所示的装置。c、d都为石墨电极。
完成下列填空:
(1)a为电源的 (填“正”“负”“阴”或“阳”,下同)极,c为电解池 的 极。
负
阳
二、电镀 精炼和电冶金
1. 电镀
(1)电镀是利用电解原理在某些金属表面镀上一薄层其他金属或合金的加工工艺。
(2)电镀可增强金属的抗腐蚀能力,增加表面硬度和美观。
阳极材料 镀层金属Cu
阴极材料 镀件金属Fe
电镀液 含镀层金属离子CuSO4溶液
阳极反应
阴极反应
溶液变化 电解质溶液的浓度
不变
2. 电解精炼铜
电解精炼粗铜时,以待精炼的铜作阳极,用CuSO4溶液作电解质溶液,可得含铜量为 99.95%~99.98%的电解铜。
阳极材料 粗铜(含Zn、Fe、Ni、Ag、Au等)
阴极材料 纯铜
阳极反应 、
、
、
阳极材料 粗铜(含Zn、Fe、Ni、Ag、Au等)
阴极反应
“阳极泥” Ag、Au等金属杂质失电子能力弱,会以单质形式沉积,形成“ ”
溶液变化 ①电解质溶液的Cu2+浓度
②引入了Zn2+、Fe2+、Ni2+等杂质,需定时除去
阳极泥
减小
3. 电冶金
冶炼钠 冶炼铝
电极
反应 阳极:
阴极:
总反应
2Na+Cl2↑
【思考交流】
冶炼钠
(1)电解熔融NaCl装置示意图
阴极环绕在阳极外面,两极之间用隔膜D隔开。
提示:(1)NaCl Cl2 阴 阳 阴
(2)电解时的反应
阳极: ;
阴极: ;
总反应: 。
【判断】
√
√
×
×
B. 阴极上Al被氧化
C. 在电解槽底部产生含Cu的阳极泥
D. 阳极和阴极的质量变化相等
C
解析:根据电解原理可知,电解池中阳极发生失电子的氧化反应,阴极发生得电子的 还原反应,该题中以熔融盐为电解液,含Cu、Mg和Si等的铝合金废料为阳极进行电 解,通过控制一定的条件,从而可使阳极区Mg和Al发生失电子的氧化反应,分别生 成Mg2+和Al3+,Cu和Si不参与反应,阴极上Al3+得电子生成铝单质,从而实现Al的 再生,据此分析解答。阴极应该发生Al3+得电子的还原反应,而Mg在阳极失电子生 成Mg2+,A错误;Al在阳极上被氧化生成Al3+,B错误;阳极材料中Cu和Si不参与氧 化反应,在电解槽底部可形成阳极泥,C正确;因为阳极除了铝参与电子转移,镁也 参与了电子转移,且还会形成阳极泥,而阴极只有铝离子得电子生成铝单质,根据得 失电子守恒及元素守恒可知,阳极与阴极的质量变化不相等,D错误。
氧化
不相等
Fe2+
Zn2+
Cu、Pt
3. 如图为工业电解熔融氧化铝冶炼铝的装置示意图。
(2)资料表明Al2O3的熔点为2 054 ℃,冰晶石(Na3AlF6)的熔点为1 000 ℃,用电 解Al2O3制取金属铝时会加入冰晶石,其作用是 。
作助熔剂,降低Al2O3的熔点
(3)该电解过程要在1 000 ℃以上进行,工业上冶炼铝过程中会发生阳极损耗,试分 析发生阳极损耗原因: 。
高温下,阳极产生的氧气与碳块反应生成CO、CO2
题后归纳
(1)电解精炼过程中的“两不等”:电解质溶液浓度在电解前后不相等;阴极 增加的质量和阳极减少的质量不相等。
(2)电镀过程中的“一多,一少,一不变”:“一多”指阴极上有镀层金属沉 积;“一少”指阳极上有镀层金属溶解;“一不变”指电镀液(电解质溶液)的浓度 不变。
三、 电解原理的创新应用
1. 电解原理常见的考查点
电解原理及应用是高考高频考点,该类试题往往与生产、生活及新科技等相联系,以 装置图或流程图为载体呈现,题材广、信息新,题目具有一定难度。主要考查阴、阳 极的判断、电极反应式、电解反应方程式的书写、溶液离子浓度变化及有关计算等。
2. “5点”突破电解综合应用题
(1)分清阴、阳极,与电源正极相连的为阳极,与电源负极相连的为阴极,两极反 应为“阳氧阴还”。
(2)剖析离子移向,阳离子移向阴极,阴离子移向阳极。
(3)注意放电顺序,正确判断放电的粒子或物质。
(4)注意介质,正确判断反应产物,酸性介质不出现OH-,碱性介质不出现H+;不 能想当然地认为金属作阳极,电极产物为金属阳离子。
(5)注意得失电子守恒和电荷守恒,正确书写电极反应式。
类型一 电解在物质转化和制备中应用
B. 阴极区溶液中OH-浓度逐渐升高
C. 理论上每消耗1 mol Fe2O3,阳极室溶液减少213 g
D. 理论上每消耗1 mol Fe2O3,阴极室物质最多增加138 g
C
A. 电解时电极N上产生OH-
B. 电解时电极M上发生氧化反应
C. 阴、阳离子交换膜均有两种离子通过
D
类型二 电解原理在环境治理中应用
C
A. 该芬顿系统能量转化形式为太阳能→电能→化学能
C. 光阳极每消耗1 mol H2O,体系中生成2 mol H2O2
D. H2O2在Mn(Ⅱ)/Mn(Ⅳ)的循环反应中表现出氧化性和还原性
A. 该装置工作时,可视Pb为惰性电极
C. 吸收塔中每消耗2 mol NO,有4 mol H+通过质子膜
D. 每处理1 mol NO,电解池将产生11.2 L O2
D
类型三 电解原理在废物回收利用中的应用
B. 电极a连接铅蓄电池负极,甲池中NaOH浓度逐渐增大
D. 若电路中通过0.2 mol e-,理论上铅酸蓄电池负极
增重30.3 g
D
A. 太阳能电池板经光照产生的电子流向a电极
D. 电解前除去LiCoO2中的杂质,可提高Co(OH)2的
纯度
A
课时作业(二十九) 电解原理的应用
[对点训练]
题组一 氯碱工业
A. 装置中的离子交换膜只能让阳离子通过,
不能让阴离子通过
B. 装置中出口①处的物质是氯气,出口B处的
物质是浓度较大NaOH溶液
C. 阴极区加入少量NaOH是为了增强溶液的导电性
D. 产生氢气8.96 L(标准状况)时,理论上通过交
换膜的钠离子Na+为0.4 mol
D
1
2
3
4
5
6
7
8
9
10
11
12
1
2
3
4
5
6
7
8
9
10
11
12
A. 采用阳离子交换膜,可以提高NaOH纯度
D. 电解过程中转移4 mol电子,理论上可获得4 mol NaOH
C
1
2
3
4
5
6
7
8
9
10
11
12
1
2
3
4
5
6
7
8
9
10
11
12
A. 在钥匙上镀铜时,钥匙应接电源正极
B. 电解熔融NaCl可冶炼金属Na
D. 离子交换膜电解槽电解饱和NaCl溶液可制备NaOH
A
1
2
3
4
5
6
7
8
9
10
11
12
1
2
3
4
5
6
7
8
9
10
11
12
A. a极是电源的正极,O2-在熔融盐中从右往左迁移
C. NaCl-NaF融盐的作用是降低熔化TiO2需要的温度
D. 阳极每产生4.48 L的O2,理论上能生成0.1 mol钛
D
1
2
3
4
5
6
7
8
9
10
11
12
1
2
3
4
5
6
7
8
9
10
11
12
B. 电解过程中阳极附近pH明显升高
C. 电路中流经4 mol电子,阳极收集到22.4 L气体
D. Na2PbCl4浓度下降后,在阴极区加入适量PbO,可实现电解质溶 液的再生使用
D
1
2
3
4
5
6
7
8
9
10
11
12
1
2
3
4
5
6
7
8
9
10
11
12
A. X为电源的负极
C. 电解一段时间后熔融盐中O2-的物质的量增多
D. 该条件下,每产生22.4 L H2,电路中转移2 mol 电子
B
1
2
3
4
5
6
7
8
9
10
11
12
1
2
3
4
5
6
7
8
9
10
11
12
A. 电极b接电源负极
B
1
2
3
4
5
6
7
8
9
10
11
12
1
2
3
4
5
6
7
8
9
10
11
12
[综合强化]
A. 甲池若为精炼铜的装置,A极材料是粗铜
B. 乙池中若滴入少量酚酞溶液,开始一段时间后C极附近变浅红色
C. 若甲池为电镀铜的装置,阴极增重12.8 g,乙池阳极放出气体为4.48 L
D
1
2
3
4
5
6
7
8
9
10
11
12
A. 若直流电源为铅酸蓄电池,则a极电极材料为Pb
B. Y为HCl溶液,且浓度比加入的HCl溶液浓度大
C. 若阴离子交换膜中通过6 mol阴离子,可生成
6 mol ClO2气体
D. X的溶质主要为NaCl
C
1
2
3
4
5
6
7
8
9
10
11
12
1
2
3
4
5
6
7
8
9
10
11
12
A. 电极X为直流电源的负极
B. 质子交换膜中氢离子向左移动
D. 理论上电源提供2 mol e-能生成1 mol氧气
D
1
2
3
4
5
6
7
8
9
10
11
12
1
2
3
4
5
6
7
8
9
10
11
12
11. 电解的应用比较广泛,回答下列问题:
(1)由下列物质冶炼相应金属时采用电解法的是 (填字母,下同)。
a.Fe2O3 b.NaCl
c.Cu2S d.Al2O3
解析:(1)电解法适合冶炼Na、Mg、Al等强还原性金属,在熔融状态下,分别电解 NaCl、Al2O3冶炼Na和Al。Fe和Cu的还原性较弱,用Fe2O3、Cu2S冶炼相应金属时, 采用加还原剂热还原法。
bd
1
2
3
4
5
6
7
8
9
10
11
12
(2)以CuSO4溶液为电解质溶液进行粗铜(含Al、Zn、Ag、Pt、Au等杂质)的电解 精炼,下列说法正确的是 。
a.电能全部转化为化学能
b.粗铜接电源正极,发生氧化反应
c.溶液中Cu2+向阳极移动
d.利用阳极泥可回收Ag、Pt、Au等金属
e.若阳极质量减少64 g,则转移电子数为2NA(设NA为阿伏加德罗常数的值)
bdf
1
2
3
4
5
6
7
8
9
10
11
12
1
2
3
4
5
6
7
8
9
10
11
12
a
NO2↑+H2O
1
2
3
4
5
6
7
8
9
10
11
12
1
2
3
4
5
6
7
8
9
10
11
12
1
2
3
4
5
6
7
8
9
10
11
12
LiOH
B
1
2
3
4
5
6
7
8
9
10
11
12
1
2
3
4
5
6
7
8
9
10
11
12
负
H2
1
2
3
4
5
6
7
8
9
10
11
12
12. (2025·天津高二阶段练习)氨是一种重要的化工原料,电化学合成氨在工业上起 着相当重要的作用。
(1)电解法合成氨反应装置如图所示。
①b极为 极,a极的电极反应式为 。
阳
1
2
3
4
5
6
7
8
9
10
11
12
②电解装置中通过质子交换膜的粒子移动方向为 。
A. 从左到右 B. 从右到左
B
③若b极产生的O2在一定条件下的体积为336 L,a极中通入相同条件下N2的总体积为 672 L,则N2的转化率为 %(保留两位有效数字)。
33
1
2
3
4
5
6
7
8
9
10
11
12
1
2
3
4
5
6
7
8
9
10
11
12
(2)科学家在以悬浮的纳米Fe2O3作催化剂,H2O和N2为原料直接常压电化学合成氨 方面取得了突破性进展。其工作原理如图所示。
Fe2O3+
②蒙乃尔筛网处发生的电极反应为 。
1
2
3
4
5
6
7
8
9
10
11
12
1
2
3
4
5
6
7
8
9
10
11
12
(3)电解硝酸工业的尾气NO可制备NH4NO3,其工作原理如图所示:
①阴极的电极反应式为 。
②将电解生成的HNO3全部转化为NH4NO3,则通入的NH3与实际参加反应的NO的物 质的量之比至少为 。
1∶4
1
2
3
4
5
6
7
8
9
10
11
12
1
2
3
4
5
6
7
8
9
10
11
12
