人教版高中化学选择性必修1第一章化学反应的热效应第二节反应热的计算第2课时反应热的计算ΔH的大小比较课件(共68张PPT)
文档属性
| 名称 | 人教版高中化学选择性必修1第一章化学反应的热效应第二节反应热的计算第2课时反应热的计算ΔH的大小比较课件(共68张PPT) |

|
|
| 格式 | ppt | ||
| 文件大小 | 9.7MB | ||
| 资源类型 | 试卷 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2025-06-25 18:11:49 | ||
图片预览











文档简介
(共68张PPT)
第一章 化学反应的热效应
第二节 反应热的计算
第2课时 反应热的计算 ΔH的大小比较
一、反应热的计算
4. 根据图像计算
ΔH=(a-b) kJ·mol-1
=-c kJ·mol-1
ΔH=(a-b) kJ·mol-1
=+c kJ·mol-1
5. 根据盖斯定律计算
将两个或两个以上的热化学方程式包括其ΔH相加或相减,得到一个新的热化学方程 式及其ΔH。
类型一 热化学方程式计算
A. 1∶2 B. 1∶3
C. 2∶1 D. 2∶3
D
2. (2025·湖北高二联考)下列氢气(H2)、一氧化碳(CO)、甲烷(CH4)燃烧的 热化学方程式分别为:
ΔH=-285.8 kJ·mol-1
ΔH=-283 kJ·mol-1
A. H2(g) B. CO(g)
C. CH4(g) D. 无法比较
B
类型二 键能与ΔH计算
3. (2025·云南师大附中高二阶段)常温常压下,断裂1 mol(理想)气体分子化学键 所吸收的能量或形成1 mol(理想)气体分子化学键所放出的能量称为键能,下表是 一些键能数据(kJ·mol-1):
化学键 键能 化学键 键能 化学键 键能
C—H 414 C—F 489 H—F 565
H—H 436 H—N 391 F—F 158
A
A. -1 928 kJ·mol-1 B. +1 928 kJ·mol-1
C. -1 728 kJ·mol-1 D. -868 kJ·mol-1
解析:ΔH=反应物的键能总和-生成物的键能总和,则ΔH=(414×4+158×4) kJ·mol-1-(489×4+565×4) kJ·mol-1=-1 928 kJ·mol-1,答案选A。
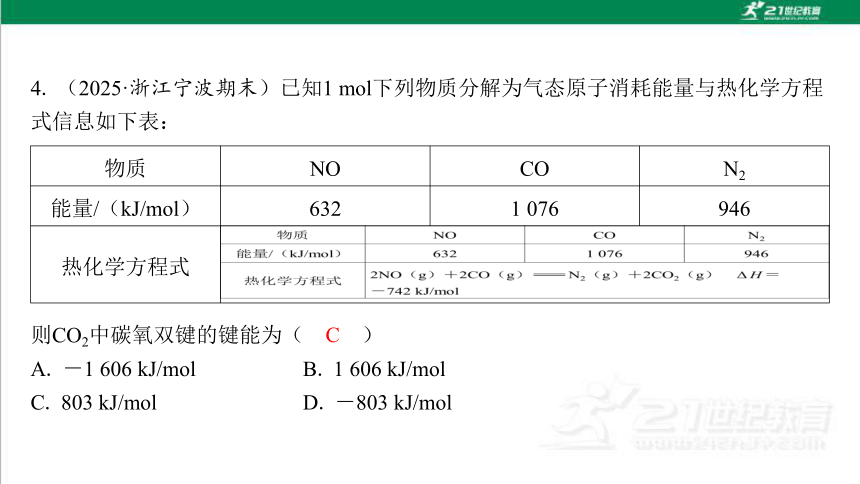
4. (2025·浙江宁波期末)已知1 mol下列物质分解为气态原子消耗能量与热化学方程 式信息如下表:
物质 NO CO N2
能量/(kJ/mol) 632 1 076 946
热化学方程式
A. -1 606 kJ/mol B. 1 606 kJ/mol
C. 803 kJ/mol D. -803 kJ/mol
C
解析:1 mol物质分解为气态原子消耗能量即该物质的键能,设CO2的碳氧双键键能 为x kJ/mol,由ΔH=反应物的总键能-生成物的总键能=(2×632+2×1 076) kJ/mol-(946+2×2x) kJ/mol=-742 kJ/mol,解得x=803,故选C。
化学键 C—H C=C C—C H—H
键能/(kJ·mol-1) 414 615 347 435
则该反应的反应热为 。
解析:ΔH=E(C—C)+6E(C—H)-E(C C)-4E(C—H)-E(H—H) =(347+6×414-615-4×414-435) kJ·mol-1=+125 kJ·mol-1。
+125 kJ·mol-1
类型三 反应进程图计算
A. 拆开H2(g)和O2(g)中的化学键成为H、O原子,需要吸收1 368 kJ能量
B. 2 mol H2(g)生成2 mol H2O(g),共放出1 852 kJ能量
C. H2的燃烧热ΔH=-a kJ·mol-1
D
C. ΔH=ΔH1+ΔH2
D. 氯原子能改变该分解反应的ΔH
C
类型四 盖斯定律计算ΔH
8. (2025·安庆高二阶段)用H2O2和H2SO4的混合溶液可溶出废旧印刷电路板上的 铜。已知:
ΔH1=+64.39 kJ·mol-1
ΔH2=-196.46 kJ·mol-1
ΔH3=-285.84 kJ·mol-1
A. -417.91 kJ·mol-1
B. -319.68 kJ·mol-1
C. +546.69 kJ·mol-1
D. -448.46 kJ·mol-1
B
9. (2025·八省联考陕西、山西、宁夏、青海)1,3-丁二烯(C4H6,简称丁二烯) 是生产橡胶的一种重要原料,其制备方法不断创新。1-丁烯(C4H8)催化脱氢法是 工业生产丁二烯的方法之一。25 ℃时,相关物质的燃烧热数据如下表:
物质 C4H8(g) C4H6(g) H2(g)
燃烧热ΔH/(kJ·mol-1) a -2 542 -286
-2 718
二、ΔH的大小比较
1. 看符号比较ΔH
ΔH的大小比较时包含“+”“-”的比较。
吸热反应ΔH>0,放热反应ΔH<0,则吸热反应的ΔH>放热反应的ΔH。
2. 看化学计量数比较ΔH
同一化学反应:ΔH与化学计量数成正比。
ΔH1=-a kJ·mol-1
ΔH2=-b kJ·mol-1
可判断:b=2a,所以ΔH1 ΔH2。
>
3. 看物质的聚集状态比较ΔH
(1)同一反应,生成物的聚集状态不同
由物质的能量(E)的大小知热量:Q1 Q2,反应为放热反应,所以 ΔH1 ΔH2。
<
>
(2)同一反应,反应物的聚集状态不同
由物质的能量(E)的大小知热量:Q1 Q2,反应为放热反应,则 ΔH1 ΔH2。
>
<
4. 看反应之间的联系比较ΔH
可判断:C(s) CO2(g),
C(s) CO(g) CO2(g);
ΔH2+ΔH3=ΔH1,又因为ΔH3<0,所以ΔH2 ΔH1。
>
5. 看可逆反应比较ΔH
6. 看中和反应的酸碱比较ΔH
生成1 mol H2O时,强酸和强碱的稀溶液的中和反应的反应热ΔH=-57.3 kJ·mol-1; 弱酸、弱碱电离时吸热,反应时放出的总热量小于57.3 kJ;浓硫酸稀释时放热,反应 时放出的总热量大于57.3 kJ。
>
A. ① B. ①③
C. ②③ D. ①②③
C
解析:①中C的燃烧反应为放热反应,故ΔH<0,且C的完全燃烧放出的热量较多, 因此ΔH前者小于后者,①不符合题意;②中C3H8的燃烧反应为放热反应,故ΔH< 0,后者反应系数为前者的两倍,故后者放热多,因此ΔH前者大于后者,②符合题 意;③中前者为分解反应,ΔH>0,后者为酸碱中和反应,ΔH<0,前者大于后 者,③符合题意。
C
A. ΔH1>0,ΔH3<0
B. ΔH2>0,ΔH4>0
C. ΔH1=ΔH2+ΔH3
D. ΔH3=ΔH4+ΔH5
D
课时作业(四) 反应热的计算
ΔH的大小比较
[对点训练]
题组一 热化学方程式计算
1. (2025·山西忻州高二期末)用CH4催化还原NOx可以消除氮氧化物的污染, 例如:
ΔH1=-574 kJ·mol-1
B
A. -2 097.6 kJ·mol-1 B. -1 160 kJ·mol-1
C. -1 394.4 kJ·mol-1 D. -925.6 kJ·mol-1
1
2
3
4
5
6
7
8
9
10
11
12
1
2
3
4
5
6
7
8
9
10
11
12
C
1
2
3
4
5
6
7
8
9
10
11
12
1
2
3
4
5
6
7
8
9
10
11
12
题组二 键能与ΔH计算
3. 通常人们把气态分子中1 mol化学键解离成气态原子所吸收的能量看成该化学键的 键能。键能可以用于估算化学反应的反应热(ΔH),化学反应的ΔH等于反应中断 裂旧化学键吸收的能量之和与反应中形成新化学键释放的能量之和的差。
化学键 H—H Cl—Cl H—Cl
生成1 mol化学键时放出的能量 436 kJ 243 kJ 431 kJ
C
1
2
3
4
5
6
7
8
9
10
11
12
1
2
3
4
5
6
7
8
9
10
11
12
A
1
2
3
4
5
6
7
8
9
10
11
12
1
2
3
4
5
6
7
8
9
10
11
12
5. (2025·马鞍山第二中学期中)以石墨代表煤中碳素,能量变化关系如图所示:
A. 267 kJ·mol-1 B. 817 kJ·mol-1
C. 1 066 kJ·mol-1 D. 1 258 kJ·mol-1
C
1
2
3
4
5
6
7
8
9
10
11
12
1
2
3
4
5
6
7
8
9
10
11
12
题组三 盖斯定律计算及ΔH大小比较
A. +28.7 B. +88.8
C. -88.8 D. -117.5
A
1
2
3
4
5
6
7
8
9
10
11
12
1
2
3
4
5
6
7
8
9
10
11
12
C
A. ①②③ B. ①③④
C. ②③④ D. ①②③④
1
2
3
4
5
6
7
8
9
10
11
12
1
2
3
4
5
6
7
8
9
10
11
12
[综合强化]
8. (2025·晋中高二检测)根据碘与氢气反应的热化学方程式:(其中I2在下列反应 中为固体或气体)
ΔH=-9.48 kJ·mol-1;
ΔH=+26.48 kJ·mol-1。
A. 反应(ⅰ)中的I2为固态,反应(ⅱ)中的I2为气态
B. 1 mol固态碘与1 mol气态碘所含的能量相差35.96 kJ
C. 反应(ⅰ)的生成物比反应(ⅱ)的生成物稳定
D. 254 g I2(g)中通入2 g H2(g),反应放热9.48 kJ
B
1
2
3
4
5
6
7
8
9
10
11
12
9. 已知溴跟氢气反应的热化学方程式如下(Q1、Q2、Q3均为正值):
ΔH1=-Q1 kJ·mol-1
ΔH2=-Q2 kJ·mol-1
ΔH3=-Q3 kJ·mol-1
A
A. Q1>Q2>Q3
B. Q1与Q3的相对大小无法判断
C. 溴蒸气转化为液态溴ΔH=(Q2-Q3) kJ·mol-1
D. H2(g)和Br2(g)反应生成HBr(g)时放出Q2 kJ热量
1
2
3
4
5
6
7
8
9
10
11
12
1
2
3
4
5
6
7
8
9
10
11
12
10. (2025·株洲高二检测)已知NaHCO3溶液与盐酸反应生成CO2吸热,Na2CO3溶液 与盐酸反应生成CO2放热。
B
A. ΔH1<0,ΔH2>0
B. ΔH2+ΔH3>0
C. ΔH1+ΔH2+ΔH3>0
D. ΔH1<ΔH4
1
2
3
4
5
6
7
8
9
10
11
12
1
2
3
4
5
6
7
8
9
10
11
12
11. (2025·甘肃酒泉期中)2030年前实现碳达峰的承诺,体现了中国的大国风范。天 然气的综合利用是各国科学家研究的重要课题。
(1)天然气的主要成分为甲烷,甲烷的结构式是 ,甲烷燃烧反应过程 中的能量变化,符合下图中的 (填字母)。
a
1
2
3
4
5
6
7
8
9
10
11
12
解析:(1)甲烷的分子式为CH4,碳原子和四个氢原子形成四个共价键,则甲烷的结构式为 ;甲烷燃烧放热,反应物的总能量大于生成物的总能量,故反应过程中的能量变化符合a。
1
2
3
4
5
6
7
8
9
10
11
12
-890
0.8
1
2
3
4
5
6
7
8
9
10
11
12
1
2
3
4
5
6
7
8
9
10
11
12
已知:部分化学键键能数据如下表(1 mol CO中含有1 mol C≡O键)。
化学键 C—H H—H C≡O
键能/(kJ·mol-1) 413 745 436 1 011
则ΔH1= kJ·mol-1,ΔH3= kJ·mol-1。
+248
+206.5
解析:(3)ΔH1=反应物的总键能-生成物的总键能=4×413 kJ·mol-1+2×745 kJ·mol-1-2×436 kJ·mol-1-2×1 011 kJ·mol-1=+248 kJ·mol-1;根据盖斯定律,ΔH3=ΔH1-ΔH2=(248-41.5)kJ·mol-1=+206.5 kJ·mol-1。
1
2
3
4
5
6
7
8
9
10
11
12
(4)用CH4催化还原NOx可以消除氮氧化物的污染。例如:
ΔH=-574 kJ·mol-1
ΔH=-1 160 kJ·mol-1
若标准状况下用1.12 L CH4还原NO2至N2,整个过程中转移电子总数为 (阿伏加德罗常数的值用NA表示),放出的热量为 kJ。
0.4NA
43.35
1
2
3
4
5
6
7
8
9
10
11
12
1
2
3
4
5
6
7
8
9
10
11
12
12. (2025·陕西榆林市五校联考高二期中)研究化学反应过程与能量变化的关系具有 重要意义。回答下列问题:
86.98 kJ/mol
图1
1
2
3
4
5
6
7
8
9
10
11
12
1
2
3
4
5
6
7
8
9
10
11
12
难以控制反应使产物只有CO
1
2
3
4
5
6
7
8
9
10
11
12
(3)H2(g)与F2(g)发生反应生成HF(g)过程中的能量变化如图2所示,仿照图 1,在图3中画出该反应的能量—反应历程曲线图(标出该反应的焓变)。
图见解析
图2
图3
1
2
3
4
5
6
7
8
9
10
11
12
解析:(3)图2中氢气和氟气断键所吸收的总能量为(154+436) kJ/mol=590 kJ/mol,2 mol H和2 mol F形成2 mol HF所释放的能量为(2×565) kJ/mol=1 130 kJ/mol,焓变ΔH=反应物的总键能-生成物的总键能,即ΔH=(590-1 130) kJ/mol=-540 kJ/mol,其反应历程可表示为 。
1
2
3
4
5
6
7
8
9
10
11
12
图4
S
1
2
3
4
5
6
7
8
9
10
11
12
1
2
3
4
5
6
7
8
9
10
11
12
解析:(5)从键能角度:ΔH=反应物的总键能-生成物的总键能,设断开1 mol硫 硫键需要x kJ/mol,即ΔH=(8x+8c-2×8b) kJ/mol=-8a kJ/mol,解得x= (2b-a-c) kJ/mol,同理生成1 mol硫硫键释放能量为(2b-a-c) kJ/mol。
(2b-a-c) kJ/mol
1
2
3
4
5
6
7
8
9
10
11
12
第一章 化学反应的热效应
第二节 反应热的计算
第2课时 反应热的计算 ΔH的大小比较
一、反应热的计算
4. 根据图像计算
ΔH=(a-b) kJ·mol-1
=-c kJ·mol-1
ΔH=(a-b) kJ·mol-1
=+c kJ·mol-1
5. 根据盖斯定律计算
将两个或两个以上的热化学方程式包括其ΔH相加或相减,得到一个新的热化学方程 式及其ΔH。
类型一 热化学方程式计算
A. 1∶2 B. 1∶3
C. 2∶1 D. 2∶3
D
2. (2025·湖北高二联考)下列氢气(H2)、一氧化碳(CO)、甲烷(CH4)燃烧的 热化学方程式分别为:
ΔH=-285.8 kJ·mol-1
ΔH=-283 kJ·mol-1
A. H2(g) B. CO(g)
C. CH4(g) D. 无法比较
B
类型二 键能与ΔH计算
3. (2025·云南师大附中高二阶段)常温常压下,断裂1 mol(理想)气体分子化学键 所吸收的能量或形成1 mol(理想)气体分子化学键所放出的能量称为键能,下表是 一些键能数据(kJ·mol-1):
化学键 键能 化学键 键能 化学键 键能
C—H 414 C—F 489 H—F 565
H—H 436 H—N 391 F—F 158
A
A. -1 928 kJ·mol-1 B. +1 928 kJ·mol-1
C. -1 728 kJ·mol-1 D. -868 kJ·mol-1
解析:ΔH=反应物的键能总和-生成物的键能总和,则ΔH=(414×4+158×4) kJ·mol-1-(489×4+565×4) kJ·mol-1=-1 928 kJ·mol-1,答案选A。
4. (2025·浙江宁波期末)已知1 mol下列物质分解为气态原子消耗能量与热化学方程 式信息如下表:
物质 NO CO N2
能量/(kJ/mol) 632 1 076 946
热化学方程式
A. -1 606 kJ/mol B. 1 606 kJ/mol
C. 803 kJ/mol D. -803 kJ/mol
C
解析:1 mol物质分解为气态原子消耗能量即该物质的键能,设CO2的碳氧双键键能 为x kJ/mol,由ΔH=反应物的总键能-生成物的总键能=(2×632+2×1 076) kJ/mol-(946+2×2x) kJ/mol=-742 kJ/mol,解得x=803,故选C。
化学键 C—H C=C C—C H—H
键能/(kJ·mol-1) 414 615 347 435
则该反应的反应热为 。
解析:ΔH=E(C—C)+6E(C—H)-E(C C)-4E(C—H)-E(H—H) =(347+6×414-615-4×414-435) kJ·mol-1=+125 kJ·mol-1。
+125 kJ·mol-1
类型三 反应进程图计算
A. 拆开H2(g)和O2(g)中的化学键成为H、O原子,需要吸收1 368 kJ能量
B. 2 mol H2(g)生成2 mol H2O(g),共放出1 852 kJ能量
C. H2的燃烧热ΔH=-a kJ·mol-1
D
C. ΔH=ΔH1+ΔH2
D. 氯原子能改变该分解反应的ΔH
C
类型四 盖斯定律计算ΔH
8. (2025·安庆高二阶段)用H2O2和H2SO4的混合溶液可溶出废旧印刷电路板上的 铜。已知:
ΔH1=+64.39 kJ·mol-1
ΔH2=-196.46 kJ·mol-1
ΔH3=-285.84 kJ·mol-1
A. -417.91 kJ·mol-1
B. -319.68 kJ·mol-1
C. +546.69 kJ·mol-1
D. -448.46 kJ·mol-1
B
9. (2025·八省联考陕西、山西、宁夏、青海)1,3-丁二烯(C4H6,简称丁二烯) 是生产橡胶的一种重要原料,其制备方法不断创新。1-丁烯(C4H8)催化脱氢法是 工业生产丁二烯的方法之一。25 ℃时,相关物质的燃烧热数据如下表:
物质 C4H8(g) C4H6(g) H2(g)
燃烧热ΔH/(kJ·mol-1) a -2 542 -286
-2 718
二、ΔH的大小比较
1. 看符号比较ΔH
ΔH的大小比较时包含“+”“-”的比较。
吸热反应ΔH>0,放热反应ΔH<0,则吸热反应的ΔH>放热反应的ΔH。
2. 看化学计量数比较ΔH
同一化学反应:ΔH与化学计量数成正比。
ΔH1=-a kJ·mol-1
ΔH2=-b kJ·mol-1
可判断:b=2a,所以ΔH1 ΔH2。
>
3. 看物质的聚集状态比较ΔH
(1)同一反应,生成物的聚集状态不同
由物质的能量(E)的大小知热量:Q1 Q2,反应为放热反应,所以 ΔH1 ΔH2。
<
>
(2)同一反应,反应物的聚集状态不同
由物质的能量(E)的大小知热量:Q1 Q2,反应为放热反应,则 ΔH1 ΔH2。
>
<
4. 看反应之间的联系比较ΔH
可判断:C(s) CO2(g),
C(s) CO(g) CO2(g);
ΔH2+ΔH3=ΔH1,又因为ΔH3<0,所以ΔH2 ΔH1。
>
5. 看可逆反应比较ΔH
6. 看中和反应的酸碱比较ΔH
生成1 mol H2O时,强酸和强碱的稀溶液的中和反应的反应热ΔH=-57.3 kJ·mol-1; 弱酸、弱碱电离时吸热,反应时放出的总热量小于57.3 kJ;浓硫酸稀释时放热,反应 时放出的总热量大于57.3 kJ。
>
A. ① B. ①③
C. ②③ D. ①②③
C
解析:①中C的燃烧反应为放热反应,故ΔH<0,且C的完全燃烧放出的热量较多, 因此ΔH前者小于后者,①不符合题意;②中C3H8的燃烧反应为放热反应,故ΔH< 0,后者反应系数为前者的两倍,故后者放热多,因此ΔH前者大于后者,②符合题 意;③中前者为分解反应,ΔH>0,后者为酸碱中和反应,ΔH<0,前者大于后 者,③符合题意。
C
A. ΔH1>0,ΔH3<0
B. ΔH2>0,ΔH4>0
C. ΔH1=ΔH2+ΔH3
D. ΔH3=ΔH4+ΔH5
D
课时作业(四) 反应热的计算
ΔH的大小比较
[对点训练]
题组一 热化学方程式计算
1. (2025·山西忻州高二期末)用CH4催化还原NOx可以消除氮氧化物的污染, 例如:
ΔH1=-574 kJ·mol-1
B
A. -2 097.6 kJ·mol-1 B. -1 160 kJ·mol-1
C. -1 394.4 kJ·mol-1 D. -925.6 kJ·mol-1
1
2
3
4
5
6
7
8
9
10
11
12
1
2
3
4
5
6
7
8
9
10
11
12
C
1
2
3
4
5
6
7
8
9
10
11
12
1
2
3
4
5
6
7
8
9
10
11
12
题组二 键能与ΔH计算
3. 通常人们把气态分子中1 mol化学键解离成气态原子所吸收的能量看成该化学键的 键能。键能可以用于估算化学反应的反应热(ΔH),化学反应的ΔH等于反应中断 裂旧化学键吸收的能量之和与反应中形成新化学键释放的能量之和的差。
化学键 H—H Cl—Cl H—Cl
生成1 mol化学键时放出的能量 436 kJ 243 kJ 431 kJ
C
1
2
3
4
5
6
7
8
9
10
11
12
1
2
3
4
5
6
7
8
9
10
11
12
A
1
2
3
4
5
6
7
8
9
10
11
12
1
2
3
4
5
6
7
8
9
10
11
12
5. (2025·马鞍山第二中学期中)以石墨代表煤中碳素,能量变化关系如图所示:
A. 267 kJ·mol-1 B. 817 kJ·mol-1
C. 1 066 kJ·mol-1 D. 1 258 kJ·mol-1
C
1
2
3
4
5
6
7
8
9
10
11
12
1
2
3
4
5
6
7
8
9
10
11
12
题组三 盖斯定律计算及ΔH大小比较
A. +28.7 B. +88.8
C. -88.8 D. -117.5
A
1
2
3
4
5
6
7
8
9
10
11
12
1
2
3
4
5
6
7
8
9
10
11
12
C
A. ①②③ B. ①③④
C. ②③④ D. ①②③④
1
2
3
4
5
6
7
8
9
10
11
12
1
2
3
4
5
6
7
8
9
10
11
12
[综合强化]
8. (2025·晋中高二检测)根据碘与氢气反应的热化学方程式:(其中I2在下列反应 中为固体或气体)
ΔH=-9.48 kJ·mol-1;
ΔH=+26.48 kJ·mol-1。
A. 反应(ⅰ)中的I2为固态,反应(ⅱ)中的I2为气态
B. 1 mol固态碘与1 mol气态碘所含的能量相差35.96 kJ
C. 反应(ⅰ)的生成物比反应(ⅱ)的生成物稳定
D. 254 g I2(g)中通入2 g H2(g),反应放热9.48 kJ
B
1
2
3
4
5
6
7
8
9
10
11
12
9. 已知溴跟氢气反应的热化学方程式如下(Q1、Q2、Q3均为正值):
ΔH1=-Q1 kJ·mol-1
ΔH2=-Q2 kJ·mol-1
ΔH3=-Q3 kJ·mol-1
A
A. Q1>Q2>Q3
B. Q1与Q3的相对大小无法判断
C. 溴蒸气转化为液态溴ΔH=(Q2-Q3) kJ·mol-1
D. H2(g)和Br2(g)反应生成HBr(g)时放出Q2 kJ热量
1
2
3
4
5
6
7
8
9
10
11
12
1
2
3
4
5
6
7
8
9
10
11
12
10. (2025·株洲高二检测)已知NaHCO3溶液与盐酸反应生成CO2吸热,Na2CO3溶液 与盐酸反应生成CO2放热。
B
A. ΔH1<0,ΔH2>0
B. ΔH2+ΔH3>0
C. ΔH1+ΔH2+ΔH3>0
D. ΔH1<ΔH4
1
2
3
4
5
6
7
8
9
10
11
12
1
2
3
4
5
6
7
8
9
10
11
12
11. (2025·甘肃酒泉期中)2030年前实现碳达峰的承诺,体现了中国的大国风范。天 然气的综合利用是各国科学家研究的重要课题。
(1)天然气的主要成分为甲烷,甲烷的结构式是 ,甲烷燃烧反应过程 中的能量变化,符合下图中的 (填字母)。
a
1
2
3
4
5
6
7
8
9
10
11
12
解析:(1)甲烷的分子式为CH4,碳原子和四个氢原子形成四个共价键,则甲烷的结构式为 ;甲烷燃烧放热,反应物的总能量大于生成物的总能量,故反应过程中的能量变化符合a。
1
2
3
4
5
6
7
8
9
10
11
12
-890
0.8
1
2
3
4
5
6
7
8
9
10
11
12
1
2
3
4
5
6
7
8
9
10
11
12
已知:部分化学键键能数据如下表(1 mol CO中含有1 mol C≡O键)。
化学键 C—H H—H C≡O
键能/(kJ·mol-1) 413 745 436 1 011
则ΔH1= kJ·mol-1,ΔH3= kJ·mol-1。
+248
+206.5
解析:(3)ΔH1=反应物的总键能-生成物的总键能=4×413 kJ·mol-1+2×745 kJ·mol-1-2×436 kJ·mol-1-2×1 011 kJ·mol-1=+248 kJ·mol-1;根据盖斯定律,ΔH3=ΔH1-ΔH2=(248-41.5)kJ·mol-1=+206.5 kJ·mol-1。
1
2
3
4
5
6
7
8
9
10
11
12
(4)用CH4催化还原NOx可以消除氮氧化物的污染。例如:
ΔH=-574 kJ·mol-1
ΔH=-1 160 kJ·mol-1
若标准状况下用1.12 L CH4还原NO2至N2,整个过程中转移电子总数为 (阿伏加德罗常数的值用NA表示),放出的热量为 kJ。
0.4NA
43.35
1
2
3
4
5
6
7
8
9
10
11
12
1
2
3
4
5
6
7
8
9
10
11
12
12. (2025·陕西榆林市五校联考高二期中)研究化学反应过程与能量变化的关系具有 重要意义。回答下列问题:
86.98 kJ/mol
图1
1
2
3
4
5
6
7
8
9
10
11
12
1
2
3
4
5
6
7
8
9
10
11
12
难以控制反应使产物只有CO
1
2
3
4
5
6
7
8
9
10
11
12
(3)H2(g)与F2(g)发生反应生成HF(g)过程中的能量变化如图2所示,仿照图 1,在图3中画出该反应的能量—反应历程曲线图(标出该反应的焓变)。
图见解析
图2
图3
1
2
3
4
5
6
7
8
9
10
11
12
解析:(3)图2中氢气和氟气断键所吸收的总能量为(154+436) kJ/mol=590 kJ/mol,2 mol H和2 mol F形成2 mol HF所释放的能量为(2×565) kJ/mol=1 130 kJ/mol,焓变ΔH=反应物的总键能-生成物的总键能,即ΔH=(590-1 130) kJ/mol=-540 kJ/mol,其反应历程可表示为 。
1
2
3
4
5
6
7
8
9
10
11
12
图4
S
1
2
3
4
5
6
7
8
9
10
11
12
1
2
3
4
5
6
7
8
9
10
11
12
解析:(5)从键能角度:ΔH=反应物的总键能-生成物的总键能,设断开1 mol硫 硫键需要x kJ/mol,即ΔH=(8x+8c-2×8b) kJ/mol=-8a kJ/mol,解得x= (2b-a-c) kJ/mol,同理生成1 mol硫硫键释放能量为(2b-a-c) kJ/mol。
(2b-a-c) kJ/mol
1
2
3
4
5
6
7
8
9
10
11
12
