皮蛋中的化学密码 化学反应后溶液中溶质成分的探究 课件(共31张PPT)
文档属性
| 名称 | 皮蛋中的化学密码 化学反应后溶液中溶质成分的探究 课件(共31张PPT) |

|
|
| 格式 | pptx | ||
| 文件大小 | 70.4MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 通用版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2025-06-26 17:43:10 | ||
图片预览





文档简介
(共31张PPT)
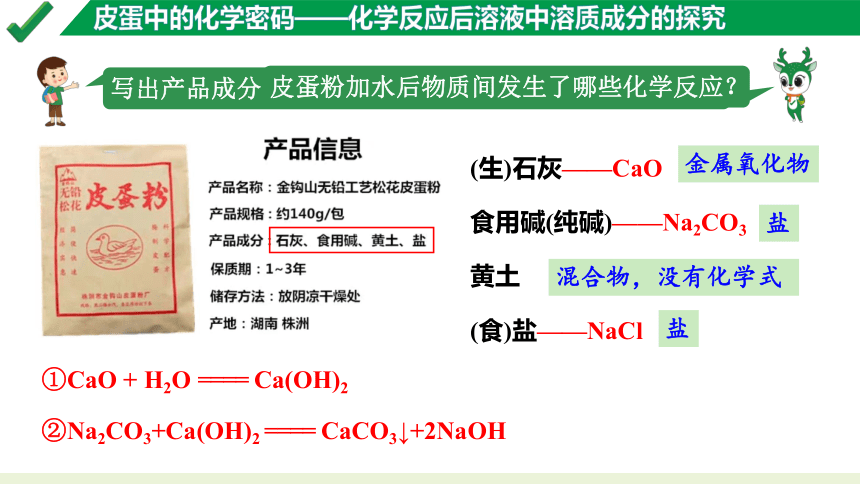
家庭自制皮蛋工艺因制作简单且安全已成为大多数皮蛋爱好者的选择。
皮蛋粉中含有哪些成分?它是如何将鹌鹑蛋转变为皮蛋的?
皮蛋中的化学密码
——化学反应后溶液中溶质成分的探究
写出产品成分的化学式。并说说它们分别属于哪类物质。
(生)石灰——CaO
食用碱(纯碱)——Na2CO3
黄土
(食)盐——NaCl
皮蛋粉加水后物质间发生了哪些化学反应?
金属氧化物
盐
盐
①CaO + H2O ==== Ca(OH)2
②Na2CO3+Ca(OH)2 ==== CaCO3↓+2NaOH
混合物,没有化学式
加水混合后,制成料泥的成分是什么?请作出合理的猜想。
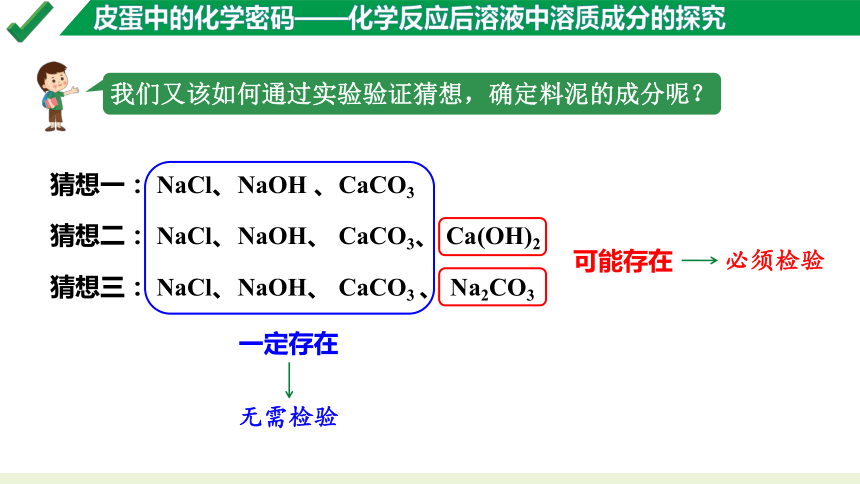
猜想一: NaCl、NaOH 、CaCO3
猜想二: NaCl、NaOH、 CaCO3、 Ca(OH)2
猜想三: NaCl、NaOH、 CaCO3 、 Na2CO3
猜想四: NaCl、NaOH、 CaCO3 、 Na2CO3、 Ca(OH)2
根据已有知识,分析这些猜想是否合理。
Ca2+和 不能大量共存
两者会反应,生成CaCO3沉淀
微观
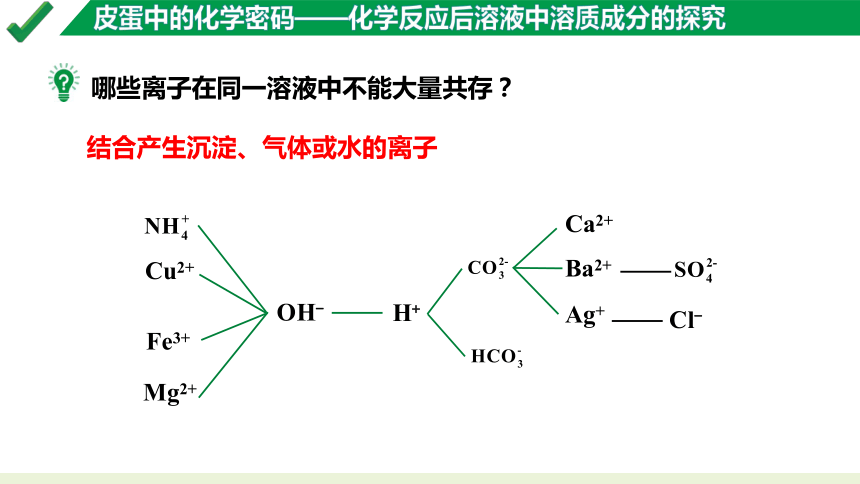
哪些离子在同一溶液中不能大量共存?
结合产生沉淀、气体或水的离子
OH-
H+
Ca2+
Ba2+
Ag+
Cl-
Cu2+
Fe3+
Mg2+
归纳总结
请归纳:猜想化学反应后溶液中物质组成的方法。
A + B → C + D
恰好完全反应:有C和D
A过量:有C、D和A
B过量:有C、D和B
不与其它成分发生化学反应的物质也一定存在。
猜想一: NaCl、NaOH 、CaCO3
猜想二: NaCl、NaOH、 CaCO3、 Ca(OH)2
猜想三: NaCl、NaOH、 CaCO3 、 Na2CO3
我们又该如何通过实验验证猜想,确定料泥的成分呢?
无需检验
一定存在
可能存在
必须检验
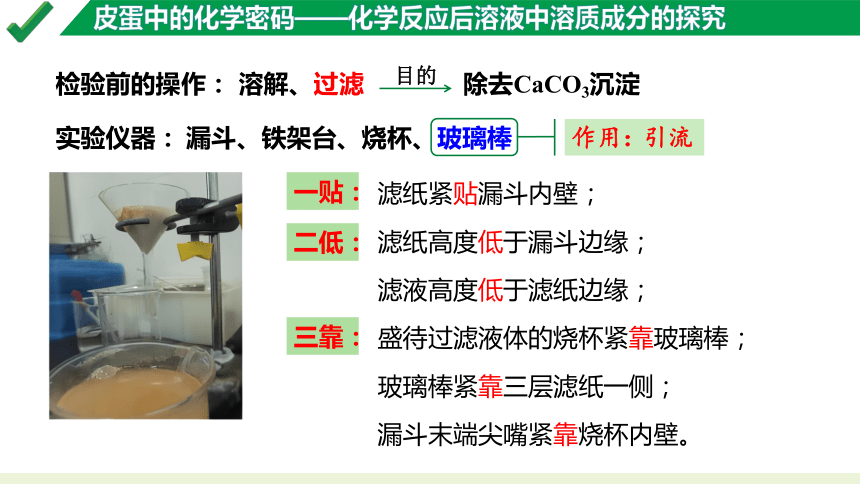
检验前的操作:
溶解、过滤
除去CaCO3沉淀
目的
实验仪器:
滤纸紧贴漏斗内壁;
滤纸高度低于漏斗边缘;
滤液高度低于滤纸边缘;
盛待过滤液体的烧杯紧靠玻璃棒;
玻璃棒紧靠三层滤纸一侧;
漏斗末端尖嘴紧靠烧杯内壁。
一贴:
三靠:
二低:
漏斗、铁架台、烧杯、玻璃棒
作用:
引流
在过滤实验中,有些同学得到的液体仍然是浑浊的,请分析一下可能的原因。
滤纸破损
漏斗内液面高于滤纸边缘
仪器不干净
找到原因,改正
再次过滤
直至滤液澄清
滤液中一定存在:
可能存在:
Ca(OH)2或者Na2CO3
NaCl、NaOH
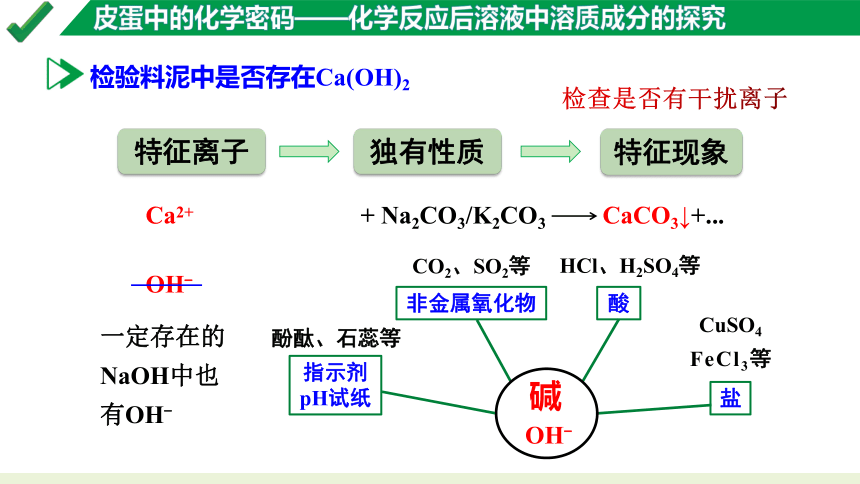
检验料泥中是否存在Ca(OH)2
特征现象
特征离子
独有性质
检查是否有干扰离子
Ca2+
OH-
+ Na2CO3/K2CO3 CaCO3↓+...
盐
CuSO4
酸
HCl、H2SO4等
CO2、SO2等
酚酞、石蕊等
FeCl3等
指示剂pH试纸
非金属氧化物
OH-
碱
一定存在的NaOH中也有OH-
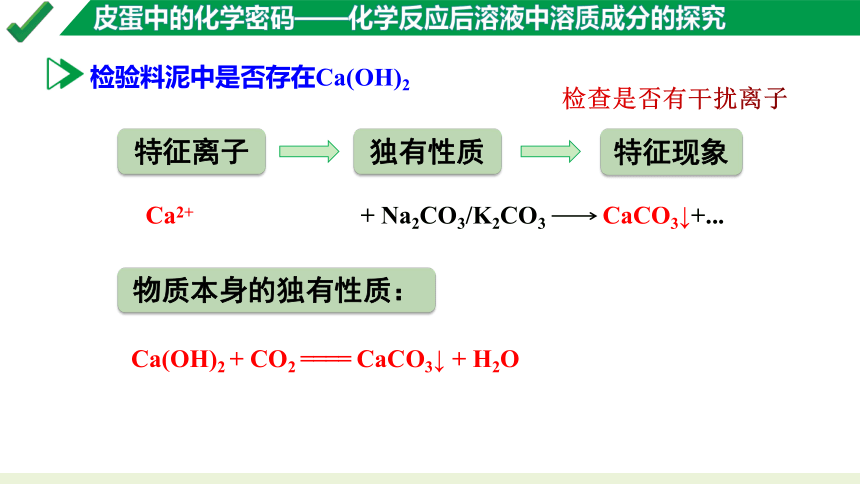
检验料泥中是否存在Ca(OH)2
特征现象
特征离子
独有性质
检查是否有干扰离子
Ca2+
+ Na2CO3/K2CO3 CaCO3↓+...
物质本身的独有性质:
Ca(OH)2 + CO2 ==== CaCO3↓ + H2O
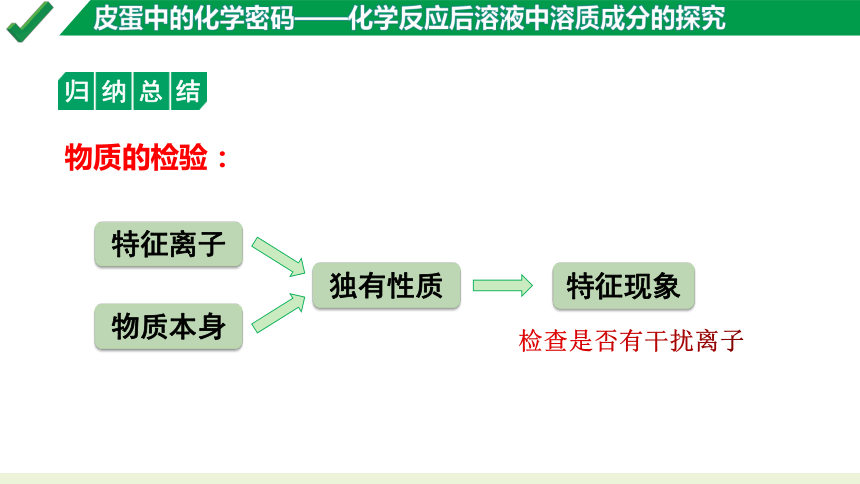
归纳总结
物质的检验:
特征离子
物质本身
特征现象
检查是否有干扰离子
独有性质
实验操作 实验现象 实验结论
实验一
实验二 有白色沉淀生成
取少量滤液于试管中,向其中滴加Na2CO3或K2CO3溶液
取少量滤液于试管中,向其中通入CO2气体
检验料泥中是否存在Ca(OH)2
有白色沉淀生成
料泥中存在Ca(OH)2
实验反思:请对上述实验进行评价。
不宜采用通入CO2气体的方式,因为CO2气体需要制取,实验操作复杂,耗时长。
检验料泥中是否存在Na2CO3
检查是否有干扰离子
特征离子
物质本身
特征现象
独有性质
酸
指示剂pH试纸
HCl、H2SO4等
Ca(OH)2/Ba(OH)2
碱
盐
酚酞、石蕊等
CaCl2/BaCl2
通性
Na2CO3特性
碳酸盐
一定存在的NaOH会造成干扰
检验料泥中是否存在Na2CO3
实验操作 实验现象 实验结论
实验一 取少量滤液于试管中,向其中滴加过量稀盐酸或稀硫酸
实验二 取少量滤液于试管中,向其中滴加Ca(OH)2溶液或Ba(OH)2溶液 实验三 取少量滤液于试管中,滴加CaCl2溶液或BaCl2溶液 无明显现象
料泥中不存在Na2CO3
无明显现象
无明显现象
实验结论
皮蛋料泥中的成分为:NaCl、NaOH、CaCO3、Ca(OH)2 。
料泥中存在氢氧化钙说明在最初加入的物质中氧化钙是过量的。
实际的生产过程中,若选用传统工艺法制作皮蛋,在配制料泥时加入过量的、价格较为低廉的生石灰也是为了促进较贵的纯碱完全反应。
实验结论
皮蛋料泥中的成分为:NaCl、NaOH、CaCO3、Ca(OH)2 。
制作皮蛋剩余的料泥中残留有大量的碱性物质,若直接丢弃会导致环境污染,同时也是对资源的一种浪费。不符合绿色化学的理念。
小 组 合 作
利用酸碱盐的性质设计料泥处理方案并进行展示交流。
NaCl
NaOH
CaCO3
Ca(OH)2
方 案 1
酸碱中和法
料泥
溶解
过滤
滤渣
滤液
回收利用
CaCO3
加入稀盐酸直至溶液恰好为中性
NaCl
CaCl2
加入过量Na2CO3过滤
滤渣
滤液
回收利用
CaCO3
NaCl
Na2CO3
蒸发结晶
NaCl
Na2CO3
回收利用
回收利用
如何保证溶液恰好为中性?
1.料泥溶解后,向其中滴加几滴_________溶液,此时溶液呈红色,然后向溶液中逐滴加入稀盐酸,当溶液_____________时为中性。
红色恰好褪去
无色酚酞
2.通过安装pH传感器来测量滴定过程中料泥过滤液的pH变化。
经过实验发现,使用7.3%的稀盐酸滴定30g料泥过滤液,当加入4.56mL稀盐酸时,整个体系的pH为7,溶液显中性。
NaCl
NaOH
CaCO3
Ca(OH)2
方 案 2
化学沉淀法
料泥
溶解
过滤
滤渣
滤液
回收利用
CaCO3
加入过量硫酸铜
滤渣
滤液
回收利用
Cu(OH)2
CuSO4
Na2SO4
CaSO4
蒸发结晶
CuSO4
Na2SO4
CaSO4
回收利用
过滤
回收利用Cu
特种工业膜分离(了解)
发生了什么反应?
2NaOH+CuSO4 ==== Na2SO4+Cu(OH)2↓
Ca(OH)2+CuSO4 ==== CaSO4+Cu(OH)2↓
微溶物
小结
结合这两节课的内容,梳理总结以下不同物质类别间的反应。
酸
酸碱指示剂
金属
金属氧化物
碱
非金属氧化物
某些盐
Fe
Mg
Zn
Al
HCl
H2SO4
酚酞
石蕊
Fe2O3
CaO
Na2CO3
CaCO3
CuSO4
NaOH
Ca(OH)2
CO2
SO2
金属活动顺序表
①CaO + H2O ==== Ca(OH)2
Na2CO3+Ca(OH)2 === CaCO3↓+2NaOH
2NaOH+CO2
=== Na2CO3+H2O
NaOH+HCl ==== NaCl+H2O
回顾课本内容,补充完善下列物质间的反应关系。
H前
强换弱
②CO还原金属氧化物
H++ →
H2O+CO2↑
知识拓展
吃皮蛋有哪些好处?
吃皮蛋能够提供丰富的蛋内质、脂肪、碳水化合物和矿物质。皮蛋是由鸭蛋制作而成,和新鲜鸭蛋一样含有丰富的蛋白质,且经过腌制,蛋白质经分解后更有利于人体消化,其蛋白质和脂肪的含量并不逊色于新鲜鸭蛋。此外,皮蛋还能提供丰富的人体所需元素,如铁、锌、硒等。
吃皮蛋能够增加食欲。皮蛋有独特的风味(含氨、硫化氢),能刺激消化器官,调节食欲,易于消化吸收。
知识拓展
哪些人群不宜吃皮蛋?
儿童和孕妇不宜吃皮蛋。虽然市场上售卖的是 “无铅”皮蛋,但仍含有微量的铅,对铅敏感的人群比如处于生长发育期的儿童和孕妇均应少吃或不吃,因为过量摄入可能会损害儿童的神经系统发育、肾脏功能以及胎儿发育等。
高血压患者不宜吃皮蛋。皮蛋中钠含量是普通鸭蛋的5倍多,钠摄入过量是引起高血压的重要因素之一。因此,高血压患者不宜多吃。
体质较差的人群不宜吃皮蛋。皮蛋易被沙门氏菌污染,通过蛋孔进人内部。体质较差的人群食用后,可能会引起不适,甚至食物中毒,出现腹泻、呕吐以及发热等现象,如老人、儿童、孕妇及慢性病患者等。
小试牛刀
1.化学兴趣小组的同学们决定自己动手制作传统食品松花蛋。制作松花蛋料泥的原料主要有:食盐、生石灰、纯碱、草木灰(含K2CO3)等。将它们按一定比例混合, 加入适量水得到松花蛋料泥。那么料泥的主要成分是什么呢?同学们进行了如图所示的实验探究:
皮蛋料泥
足量水、过滤
②
适量水①
滤渣
滤液
稀盐酸
③
⑤稀盐酸
⑥ CO2
④酚酞
有气泡
溶液变红色
有白色沉淀
无明显现象
原
料
碱性
Ca(OH)2
不存在
CaCO3
(1)步骤②的操作所需的玻璃仪器有:烧杯、玻璃棒、______。
(2)步骤③的现象说明滤渣中一定含有的物质为:_______(写名称);
(3)滤液中的溶质一定含有:______________________________。(写化学式)
漏斗
碳酸钙
NaCl、Ca(OH)2、NaOH、KOH
皮蛋料泥
足量水、过滤
②
适量水①
滤渣
滤液
稀盐酸
③
⑤稀盐酸
⑥ CO2
④酚酞
有气泡
溶液变红色
有白色沉淀
无明显现象
原
料
碱性
Ca(OH)2
不存在
CaCO3
2.皮蛋风味独特,深受人们喜爱。用于制作皮蛋泥的原料皮蛋粉主要是由纯碱、生石灰和食盐组成。同学们利用如图实验验证皮蛋粉的成分,下列有关该实验的描述正确的是( )
A. ③中滴入无色酚酞溶液后无明显现象
B. ④中发生的反应为复分解反应
C. 白色固体、白色沉淀均为氢氧化钙
D. 该实验中能够确定出制作皮蛋泥的原
料成分
B
加入水,氧化钙和水反应生成氢氧化钙,氢氧化钙会与碳酸钠反应生成碳酸钙白色沉淀和氢氧化钠,经过滤得到的白色固体为碳酸钙,因此滤液中一定含有氢氧化钠,显碱性,向③中滴入无色酚酞溶液后,溶液变红,A错误;
向滤液中滴加碳酸钾溶液产生白色沉淀,说明滤液中还含有氢氧化钙,发生的反应为碳酸钾和氢氧化钙反应生成碳酸钙白色沉淀和氢氧化钾,该反应属于复分解反应,B正确;
碳酸钙
该实验能得出皮蛋泥中含有生石灰和纯碱,但不能确定氯化钠的存在,D错误。
3.探究与实践——制作松花蛋
松花蛋也叫皮蛋,是人们喜爱的食品。小明看到
妈妈用皮蛋粉制作皮蛋时产生了浓厚的兴趣,于是以
“皮蛋制作”为主题开展项目式学习。
(1)配制皮蛋粉
在妈妈的指导下,小明将“石灰”、纯碱和食盐按
照一定比例混合,制成皮蛋粉。
【提出问题】配料中所用“石灰”是生石灰还是熟石灰?
【查阅资料】相同条件下,生石灰、熟石灰与水混合后均能放出热量,但放出的热量不同。
【实验探究】常温下,将“石灰”、生石灰和熟石灰分别
加入水中,测量固体加入前后温度的变化情况。实验过
程中需要保持不变的量是_________________________。
【数据分析】根据数据比对,可知配料中的“石灰”为生
石灰。
三种固体的质量和水的体积
(2)浸鲜蛋
向配制的皮蛋粉中加入一定量的水,充分反应后过滤,所得滤液称为浸出液,将新鲜鸭蛋放入其中浸泡即可。
①取滤液少许于试管中,进行如图所示操作。测得溶液
的pH___7(填“>”、“<”或“=”)。若实验前将pH试纸润湿,
则所测得溶液的酸碱性____(填“会”“不会”)受到影响。
②向皮蛋粉中加水时,发生反应的化学方程式为________________________。
>
会
CaO + H2O ==== Ca(OH)2
③妈妈告诉小明,制作过程中一定要戴上胶皮手套。分析上述过程,小明认为浸出液中一定含有会腐蚀皮肤的物质是_______(填化学式)。
④浸出液中还含有哪些溶质?小明进行了如下探究,请完成下表(不考虑生石灰中杂质的影响)
实验操作 实验现象 实验结论
1. 取少量滤液于试管中,加入Na2CO3溶液 _______________ 浸出液中含有
氢氧化钙
2. 另取少量滤液于另一支试管中,加入足量__________________溶液 无明显现象 浸出液中不含
碳酸钠
NaOH
稀盐酸(或氯化钙等)
有白色沉淀生成
综合分析,确定皮蛋浸出液中的溶质有(写化学式)_______________________。
NaCl、NaOH、Ca(OH)2
(3)品皮蛋
制作过程中,碱液会渗入皮蛋使之略带涩味。妈妈告诉小明食用时可以蘸少量食醋去除涩味,该化学反应的微观实质是____________
__________________________________________________,此反应实质在生产生活中应用广泛,请再列举一例_____________________
______________________。
酸中的氢离子和碱中氢氧根离子结合成水分子(或H++OH- ==== H2O)
用含有氢氧化铝的药物治疗胃酸过多(合理即可)
家庭自制皮蛋工艺因制作简单且安全已成为大多数皮蛋爱好者的选择。
皮蛋粉中含有哪些成分?它是如何将鹌鹑蛋转变为皮蛋的?
皮蛋中的化学密码
——化学反应后溶液中溶质成分的探究
写出产品成分的化学式。并说说它们分别属于哪类物质。
(生)石灰——CaO
食用碱(纯碱)——Na2CO3
黄土
(食)盐——NaCl
皮蛋粉加水后物质间发生了哪些化学反应?
金属氧化物
盐
盐
①CaO + H2O ==== Ca(OH)2
②Na2CO3+Ca(OH)2 ==== CaCO3↓+2NaOH
混合物,没有化学式
加水混合后,制成料泥的成分是什么?请作出合理的猜想。
猜想一: NaCl、NaOH 、CaCO3
猜想二: NaCl、NaOH、 CaCO3、 Ca(OH)2
猜想三: NaCl、NaOH、 CaCO3 、 Na2CO3
猜想四: NaCl、NaOH、 CaCO3 、 Na2CO3、 Ca(OH)2
根据已有知识,分析这些猜想是否合理。
Ca2+和 不能大量共存
两者会反应,生成CaCO3沉淀
微观
哪些离子在同一溶液中不能大量共存?
结合产生沉淀、气体或水的离子
OH-
H+
Ca2+
Ba2+
Ag+
Cl-
Cu2+
Fe3+
Mg2+
归纳总结
请归纳:猜想化学反应后溶液中物质组成的方法。
A + B → C + D
恰好完全反应:有C和D
A过量:有C、D和A
B过量:有C、D和B
不与其它成分发生化学反应的物质也一定存在。
猜想一: NaCl、NaOH 、CaCO3
猜想二: NaCl、NaOH、 CaCO3、 Ca(OH)2
猜想三: NaCl、NaOH、 CaCO3 、 Na2CO3
我们又该如何通过实验验证猜想,确定料泥的成分呢?
无需检验
一定存在
可能存在
必须检验
检验前的操作:
溶解、过滤
除去CaCO3沉淀
目的
实验仪器:
滤纸紧贴漏斗内壁;
滤纸高度低于漏斗边缘;
滤液高度低于滤纸边缘;
盛待过滤液体的烧杯紧靠玻璃棒;
玻璃棒紧靠三层滤纸一侧;
漏斗末端尖嘴紧靠烧杯内壁。
一贴:
三靠:
二低:
漏斗、铁架台、烧杯、玻璃棒
作用:
引流
在过滤实验中,有些同学得到的液体仍然是浑浊的,请分析一下可能的原因。
滤纸破损
漏斗内液面高于滤纸边缘
仪器不干净
找到原因,改正
再次过滤
直至滤液澄清
滤液中一定存在:
可能存在:
Ca(OH)2或者Na2CO3
NaCl、NaOH
检验料泥中是否存在Ca(OH)2
特征现象
特征离子
独有性质
检查是否有干扰离子
Ca2+
OH-
+ Na2CO3/K2CO3 CaCO3↓+...
盐
CuSO4
酸
HCl、H2SO4等
CO2、SO2等
酚酞、石蕊等
FeCl3等
指示剂pH试纸
非金属氧化物
OH-
碱
一定存在的NaOH中也有OH-
检验料泥中是否存在Ca(OH)2
特征现象
特征离子
独有性质
检查是否有干扰离子
Ca2+
+ Na2CO3/K2CO3 CaCO3↓+...
物质本身的独有性质:
Ca(OH)2 + CO2 ==== CaCO3↓ + H2O
归纳总结
物质的检验:
特征离子
物质本身
特征现象
检查是否有干扰离子
独有性质
实验操作 实验现象 实验结论
实验一
实验二 有白色沉淀生成
取少量滤液于试管中,向其中滴加Na2CO3或K2CO3溶液
取少量滤液于试管中,向其中通入CO2气体
检验料泥中是否存在Ca(OH)2
有白色沉淀生成
料泥中存在Ca(OH)2
实验反思:请对上述实验进行评价。
不宜采用通入CO2气体的方式,因为CO2气体需要制取,实验操作复杂,耗时长。
检验料泥中是否存在Na2CO3
检查是否有干扰离子
特征离子
物质本身
特征现象
独有性质
酸
指示剂pH试纸
HCl、H2SO4等
Ca(OH)2/Ba(OH)2
碱
盐
酚酞、石蕊等
CaCl2/BaCl2
通性
Na2CO3特性
碳酸盐
一定存在的NaOH会造成干扰
检验料泥中是否存在Na2CO3
实验操作 实验现象 实验结论
实验一 取少量滤液于试管中,向其中滴加过量稀盐酸或稀硫酸
实验二 取少量滤液于试管中,向其中滴加Ca(OH)2溶液或Ba(OH)2溶液 实验三 取少量滤液于试管中,滴加CaCl2溶液或BaCl2溶液 无明显现象
料泥中不存在Na2CO3
无明显现象
无明显现象
实验结论
皮蛋料泥中的成分为:NaCl、NaOH、CaCO3、Ca(OH)2 。
料泥中存在氢氧化钙说明在最初加入的物质中氧化钙是过量的。
实际的生产过程中,若选用传统工艺法制作皮蛋,在配制料泥时加入过量的、价格较为低廉的生石灰也是为了促进较贵的纯碱完全反应。
实验结论
皮蛋料泥中的成分为:NaCl、NaOH、CaCO3、Ca(OH)2 。
制作皮蛋剩余的料泥中残留有大量的碱性物质,若直接丢弃会导致环境污染,同时也是对资源的一种浪费。不符合绿色化学的理念。
小 组 合 作
利用酸碱盐的性质设计料泥处理方案并进行展示交流。
NaCl
NaOH
CaCO3
Ca(OH)2
方 案 1
酸碱中和法
料泥
溶解
过滤
滤渣
滤液
回收利用
CaCO3
加入稀盐酸直至溶液恰好为中性
NaCl
CaCl2
加入过量Na2CO3过滤
滤渣
滤液
回收利用
CaCO3
NaCl
Na2CO3
蒸发结晶
NaCl
Na2CO3
回收利用
回收利用
如何保证溶液恰好为中性?
1.料泥溶解后,向其中滴加几滴_________溶液,此时溶液呈红色,然后向溶液中逐滴加入稀盐酸,当溶液_____________时为中性。
红色恰好褪去
无色酚酞
2.通过安装pH传感器来测量滴定过程中料泥过滤液的pH变化。
经过实验发现,使用7.3%的稀盐酸滴定30g料泥过滤液,当加入4.56mL稀盐酸时,整个体系的pH为7,溶液显中性。
NaCl
NaOH
CaCO3
Ca(OH)2
方 案 2
化学沉淀法
料泥
溶解
过滤
滤渣
滤液
回收利用
CaCO3
加入过量硫酸铜
滤渣
滤液
回收利用
Cu(OH)2
CuSO4
Na2SO4
CaSO4
蒸发结晶
CuSO4
Na2SO4
CaSO4
回收利用
过滤
回收利用Cu
特种工业膜分离(了解)
发生了什么反应?
2NaOH+CuSO4 ==== Na2SO4+Cu(OH)2↓
Ca(OH)2+CuSO4 ==== CaSO4+Cu(OH)2↓
微溶物
小结
结合这两节课的内容,梳理总结以下不同物质类别间的反应。
酸
酸碱指示剂
金属
金属氧化物
碱
非金属氧化物
某些盐
Fe
Mg
Zn
Al
HCl
H2SO4
酚酞
石蕊
Fe2O3
CaO
Na2CO3
CaCO3
CuSO4
NaOH
Ca(OH)2
CO2
SO2
金属活动顺序表
①CaO + H2O ==== Ca(OH)2
Na2CO3+Ca(OH)2 === CaCO3↓+2NaOH
2NaOH+CO2
=== Na2CO3+H2O
NaOH+HCl ==== NaCl+H2O
回顾课本内容,补充完善下列物质间的反应关系。
H前
强换弱
②CO还原金属氧化物
H++ →
H2O+CO2↑
知识拓展
吃皮蛋有哪些好处?
吃皮蛋能够提供丰富的蛋内质、脂肪、碳水化合物和矿物质。皮蛋是由鸭蛋制作而成,和新鲜鸭蛋一样含有丰富的蛋白质,且经过腌制,蛋白质经分解后更有利于人体消化,其蛋白质和脂肪的含量并不逊色于新鲜鸭蛋。此外,皮蛋还能提供丰富的人体所需元素,如铁、锌、硒等。
吃皮蛋能够增加食欲。皮蛋有独特的风味(含氨、硫化氢),能刺激消化器官,调节食欲,易于消化吸收。
知识拓展
哪些人群不宜吃皮蛋?
儿童和孕妇不宜吃皮蛋。虽然市场上售卖的是 “无铅”皮蛋,但仍含有微量的铅,对铅敏感的人群比如处于生长发育期的儿童和孕妇均应少吃或不吃,因为过量摄入可能会损害儿童的神经系统发育、肾脏功能以及胎儿发育等。
高血压患者不宜吃皮蛋。皮蛋中钠含量是普通鸭蛋的5倍多,钠摄入过量是引起高血压的重要因素之一。因此,高血压患者不宜多吃。
体质较差的人群不宜吃皮蛋。皮蛋易被沙门氏菌污染,通过蛋孔进人内部。体质较差的人群食用后,可能会引起不适,甚至食物中毒,出现腹泻、呕吐以及发热等现象,如老人、儿童、孕妇及慢性病患者等。
小试牛刀
1.化学兴趣小组的同学们决定自己动手制作传统食品松花蛋。制作松花蛋料泥的原料主要有:食盐、生石灰、纯碱、草木灰(含K2CO3)等。将它们按一定比例混合, 加入适量水得到松花蛋料泥。那么料泥的主要成分是什么呢?同学们进行了如图所示的实验探究:
皮蛋料泥
足量水、过滤
②
适量水①
滤渣
滤液
稀盐酸
③
⑤稀盐酸
⑥ CO2
④酚酞
有气泡
溶液变红色
有白色沉淀
无明显现象
原
料
碱性
Ca(OH)2
不存在
CaCO3
(1)步骤②的操作所需的玻璃仪器有:烧杯、玻璃棒、______。
(2)步骤③的现象说明滤渣中一定含有的物质为:_______(写名称);
(3)滤液中的溶质一定含有:______________________________。(写化学式)
漏斗
碳酸钙
NaCl、Ca(OH)2、NaOH、KOH
皮蛋料泥
足量水、过滤
②
适量水①
滤渣
滤液
稀盐酸
③
⑤稀盐酸
⑥ CO2
④酚酞
有气泡
溶液变红色
有白色沉淀
无明显现象
原
料
碱性
Ca(OH)2
不存在
CaCO3
2.皮蛋风味独特,深受人们喜爱。用于制作皮蛋泥的原料皮蛋粉主要是由纯碱、生石灰和食盐组成。同学们利用如图实验验证皮蛋粉的成分,下列有关该实验的描述正确的是( )
A. ③中滴入无色酚酞溶液后无明显现象
B. ④中发生的反应为复分解反应
C. 白色固体、白色沉淀均为氢氧化钙
D. 该实验中能够确定出制作皮蛋泥的原
料成分
B
加入水,氧化钙和水反应生成氢氧化钙,氢氧化钙会与碳酸钠反应生成碳酸钙白色沉淀和氢氧化钠,经过滤得到的白色固体为碳酸钙,因此滤液中一定含有氢氧化钠,显碱性,向③中滴入无色酚酞溶液后,溶液变红,A错误;
向滤液中滴加碳酸钾溶液产生白色沉淀,说明滤液中还含有氢氧化钙,发生的反应为碳酸钾和氢氧化钙反应生成碳酸钙白色沉淀和氢氧化钾,该反应属于复分解反应,B正确;
碳酸钙
该实验能得出皮蛋泥中含有生石灰和纯碱,但不能确定氯化钠的存在,D错误。
3.探究与实践——制作松花蛋
松花蛋也叫皮蛋,是人们喜爱的食品。小明看到
妈妈用皮蛋粉制作皮蛋时产生了浓厚的兴趣,于是以
“皮蛋制作”为主题开展项目式学习。
(1)配制皮蛋粉
在妈妈的指导下,小明将“石灰”、纯碱和食盐按
照一定比例混合,制成皮蛋粉。
【提出问题】配料中所用“石灰”是生石灰还是熟石灰?
【查阅资料】相同条件下,生石灰、熟石灰与水混合后均能放出热量,但放出的热量不同。
【实验探究】常温下,将“石灰”、生石灰和熟石灰分别
加入水中,测量固体加入前后温度的变化情况。实验过
程中需要保持不变的量是_________________________。
【数据分析】根据数据比对,可知配料中的“石灰”为生
石灰。
三种固体的质量和水的体积
(2)浸鲜蛋
向配制的皮蛋粉中加入一定量的水,充分反应后过滤,所得滤液称为浸出液,将新鲜鸭蛋放入其中浸泡即可。
①取滤液少许于试管中,进行如图所示操作。测得溶液
的pH___7(填“>”、“<”或“=”)。若实验前将pH试纸润湿,
则所测得溶液的酸碱性____(填“会”“不会”)受到影响。
②向皮蛋粉中加水时,发生反应的化学方程式为________________________。
>
会
CaO + H2O ==== Ca(OH)2
③妈妈告诉小明,制作过程中一定要戴上胶皮手套。分析上述过程,小明认为浸出液中一定含有会腐蚀皮肤的物质是_______(填化学式)。
④浸出液中还含有哪些溶质?小明进行了如下探究,请完成下表(不考虑生石灰中杂质的影响)
实验操作 实验现象 实验结论
1. 取少量滤液于试管中,加入Na2CO3溶液 _______________ 浸出液中含有
氢氧化钙
2. 另取少量滤液于另一支试管中,加入足量__________________溶液 无明显现象 浸出液中不含
碳酸钠
NaOH
稀盐酸(或氯化钙等)
有白色沉淀生成
综合分析,确定皮蛋浸出液中的溶质有(写化学式)_______________________。
NaCl、NaOH、Ca(OH)2
(3)品皮蛋
制作过程中,碱液会渗入皮蛋使之略带涩味。妈妈告诉小明食用时可以蘸少量食醋去除涩味,该化学反应的微观实质是____________
__________________________________________________,此反应实质在生产生活中应用广泛,请再列举一例_____________________
______________________。
酸中的氢离子和碱中氢氧根离子结合成水分子(或H++OH- ==== H2O)
用含有氢氧化铝的药物治疗胃酸过多(合理即可)
同课章节目录
