湖南省长沙市岳麓实验中学2024-2025学年高二下学期6月月考化学试卷(含答案)
文档属性
| 名称 | 湖南省长沙市岳麓实验中学2024-2025学年高二下学期6月月考化学试卷(含答案) |  | |
| 格式 | docx | ||
| 文件大小 | 271.6KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 通用版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2025-06-25 16:20:23 | ||
图片预览


文档简介
高二化学试卷
一、单选题
1.下列说法正确的是
A.失电子难的元素得电子一定容易
B.电离能越大的元素电负性一定越小
C.最外层电子排布为ns2的元素一定位于s区
D.不同能层的s轨道的空间取向均相同
2.中国古代书籍文字中,诸多记载都能感受到化学学科的久远与魅力。下列有关说法正确的是
A.硝石“强烧之,紫青烟起”,说明可分解
B.“丹砂烧之成水银”,发生了置换反应
C.“慈石,色轻紫,可吸连针铁”,慈石的主要成分为
D.“自元时始创其法,用浓酒和糟入甑,蒸令气上”,“法”是指蒸馏
3.下列说法正确的是
A.与互为同位素
B.碳纳米管和富勒烯互为同素异形体
C.与一定互为同系物
D.纤维素与淀粉互为同分异构体
4.下列说法正确的是
A.配制480mL0.100mol/L的CuSO4 溶液,需称取胆矾8.0g
B.在标准状况下等质量的甲烷和氧气的体积之比为1:2
C.同温同压下,相同体积的N2O、CO2气体含有相同的原子个数
D.H2 的摩尔质量等于它的相对原子质量
5.下列化学用语表述正确的是
A.醋酸的电离方程式:
B.铜-锌-稀硫酸原电池中,正极的电极反应式为
C.水解的离子方程式:
D.的电离方程式:
6.下列物质间的转化属于化学变化且能量变化符合图示变化的是
A.2Cl→Cl2 B.NaOH(s)溶解 C.水煤气燃烧 D.煅烧石灰石
7.乙烯的同系物2-丁烯存在以下转化关系:正丁烷。下列说法错误的是
A.反应①和反应②的反应类型相同
B.2-丁烯中最多有8个原子共平面
C.2-丁烯使溴水和酸性溶液褪色的原理相同
D.反应②的产物M只有一种结构
8.为探究化学平衡移动的影响因素,设计方案并进行实验,观察到相关现象。其中方案设计和结论都正确的是(已知:的氧化性与接近)
选项 影响因素 方案设计 现象 结论
A 浓度 向10.1溶液中加入11.0溶液 黄色溶液变橙色 增大反应物浓度,平衡向正反应方向移动
B 压强 向恒温恒容密闭玻璃容器中充入100气体,分解达到平衡后再充入100 气体颜色不变 对于反应前后气体总体积不变的可逆反应,改变压强平衡不移动
C 温度 将封装有和混合气体的烧瓶浸泡在热水中 气体颜色变深 升高温度,平衡向吸热反应方向移动
D 催化剂 向1乙酸乙酯中加入10.3溶液,水浴加热 上层液体逐渐减少 使用合适的催化剂可使平衡向正反应方向移动
A.A B.B C.C D.D
9.下列反应的方程式不正确的是
A.将碳酸氢钙溶液与过量的澄清石灰水混合:
B.将稀硫酸加入硫代硫酸钠溶液:
C.溶液与闪锌矿(ZnS)反应生成铜蓝(CuS):
D.向银氨溶液中滴加乙醛,水浴加热,析出光亮银镜:
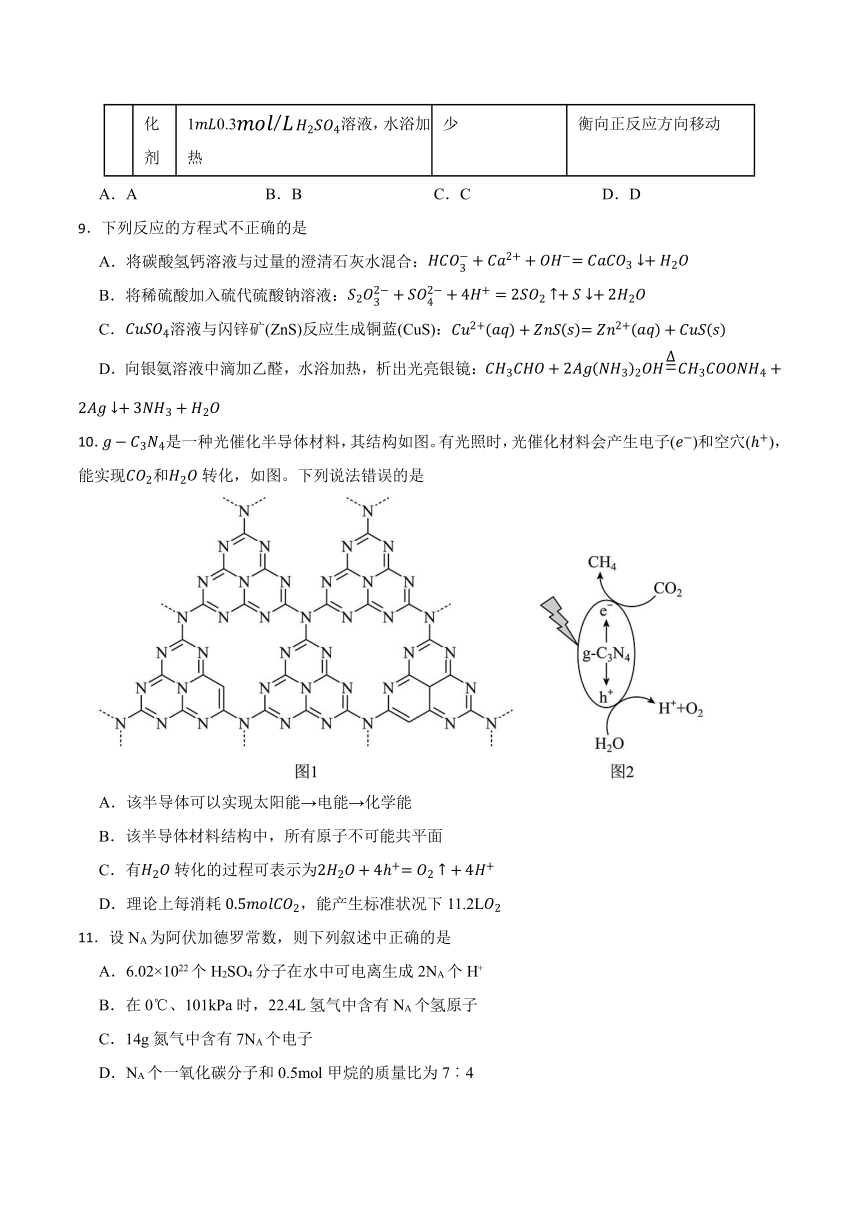
10.是一种光催化半导体材料,其结构如图。有光照时,光催化材料会产生电子()和空穴(),能实现和转化,如图。下列说法错误的是
A.该半导体可以实现太阳能→电能→化学能
B.该半导体材料结构中,所有原子不可能共平面
C.有转化的过程可表示为
D.理论上每消耗,能产生标准状况下11.2L
11.设NA为阿伏加德罗常数,则下列叙述中正确的是
A.6.02×1022个H2SO4分子在水中可电离生成2NA个H+
B.在0℃、101kPa时,22.4L氢气中含有NA个氢原子
C.14g氮气中含有7NA个电子
D.NA个一氧化碳分子和0.5mol甲烷的质量比为7︰4
12.从微观视角探析物质结构及性质是学习化学的有效方法。下列实例与解释不符的是
选项 实例 解释
A 原子光谱是不连续的线状谱线 原子的能级是量子化的
B 键角依次减小 孤电子对与成键电子对的斥力大于成键电子对之间的斥力
C 晶体中与8个配位,而晶体中与6个配位 比的半径大
D 逐个断开中的键,每步所需能量不同 各步中的键所处化学环境不同
A.A B.B C.C D.D
13.下表是部分短周期元素的原子半径及主要化合价,根据表中信息,判断以下说法正确的是
元素符号 L M Q R T
原子半径/nm 0.160 0.143 0.089 0.102 0.074
主要化合价 +2 +3 +2 +6、-2 -2
A.L2+与R2-的核外电子数相等
B.M与L形成的最高价氧化物对应水化物的碱性:L>M
C.氢化物的稳定性为H2TD.单质与等浓度的稀盐酸反应的速率为Q>L
14.一定条件下,反应的速率方程为,已知:k为速率常数只与温度有关。某温度下,该反应在不同浓度下的反应速率如下:
反应速率
0.1 0.1 2
0.1 0.4 2
0.2 0.4 2
0.4 0.1 4
0.2 0.1 c
根据表中的测定结果,下列结论错误的是
A.的值为1
B.表中c的值为1
C.反应体系的三种物质中,的浓度对反应速率影响最大
D.在反应体系中保持其他物质浓度不变,增大浓度,会使反应速率升高
二、实验探究题
15.现有以下物质:①H2SO4;②液氨;③熔融KOH;④NaCl溶液;⑤Fe(OH)3胶体;⑥铜;⑦CO2;⑧CH3COOH;⑨蔗糖。
请回答下列问题:
(1)以上物质中属于混合物的是 (填序号),以上物质中属于电解质的是 (填序号)。
(2)Fe(OH)3胶体的制备。在小烧杯中加入20 mL蒸馏水,加热至沸腾后,向沸水中滴入几滴 ,继续煮沸至溶液呈 色,停止加热。
(3)区分④和⑤的简单方法是 。
(4)写出①在水溶液中的电离方程式 。检验④中所含阳离子的方法是 。
(5)在③的水溶液中缓缓通入过量的CO2可生成酸式盐,写出反应的化学方程式:
。
16.乙烯、乙醇是重要有机化工原料。回答下列问题:
已知:
(1)石蜡油裂解产生的不饱和烃是重要的有机合成中间体。
①D为高分子化合物,上图中生成D的方程式是 。
②下列装置正确且能达到实验目的的是 (填序号)。
A.甲装置:从石油中分离石蜡油 B.乙装置:证明石蜡油分解生成乙烯
C.丙装置:完成乙醇的催化氧化 D.丁装置:制备乙酸乙酯
(2)已知:CaCl2与C2H5OH形成CaCl2·6C2H5OH.实验室制备乙酸乙酯粗产品并精制提纯,流程如下。
①制备乙酸乙酯的化学方程式为 。
②饱和Na2CO3溶液的作用是 。
③为除去有机层2中的乙醇,加入的试剂X为 。
④选择合适的仪器组装完成操作2(夹持、加热及单孔、双孔橡胶塞、导管等连接仪器略),仪器的连接顺序为d→ 。
三、综合题
17.根据物质的组成和性质,可将物质进行分类,并实现物质之间的转化。由H、O、Na、S四种元素中的一种或几种元素能形成多种物质,利用这些物质回答下列问题。
(1)常温下能导电的固体为 (任写一种化学式,下同),属于非电解质的是 ,属于强酸的是 ,属于碱的是 。
(2)是由上述四种元素组成的化合物,其在水溶液中的电离方程式为 。
(3)写出由两种单质发生化合反应生成一种淡黄色固体的化学方程式,并用双线桥表示出电子转移数目 。
18.回答下列问题:
(1)已知:Fe(s)+ O2(g)= FeO(s) ΔH= -272.0KJ·mol-1
2Al(s)+ O2(s)= Al2O3(s) ΔH=-1675.7KJ·mol-1
Al和FeO发热反应的热化学方程式是 。
(2)某可逆反应在不同条件下的反应历程分别为A、B,如图所示。
①据图判断:当反应达到平衡后,其他条件不变,升高温度,反应物的转化率 (填“增大”“减小”或“不变”);
②其中B历程表明此反应采用的条件为 (选 填序号)。
A.升高温度 B.增大反应物的浓度
C. 降低温度 D.使用催化剂
(3)1000℃时,硫酸钠与氢气发生下列反应: Na2SO4(s)+4H2(g)= Na2S(s)+ 4H2O(g)。该反应的平衡常数表达式为K= ;已知K (1000℃ ) <K (1200℃) ,若降低体系温度,混合气体的平均相对分子质量将 (填“增大”、 “减小”或“不变”)。
(4)常温下,如果取0.1mol·L-1HA溶液与0.1mol ·L-1NaOH溶液等体积混合(混合后溶液体积的变化忽略不计),测得混合液的pH=8。
①混合液中由水电离出的OH—浓度与0.1mol·L-1NaOH溶液中由水电离出的OH—浓度之比为 ;
②已知NH4A溶液为中性,又知将HA溶液加到Na2CO3溶液中有气体放出,试推断相同温度下,等物质的量浓度的下列盐溶液按pH由大到小的排列顺序为(填序号) > >
a.NH4Cl b. NH4A c. (NH4)2CO3
参考答案
1.【答案】D
2.【答案】D
3.【答案】B
4.【答案】C
5.【答案】C
6.【答案】C
7.【答案】C
8.【答案】C
9.【答案】B
10.【答案】D
11.【答案】C
12.【答案】B
13.【答案】B
14.【答案】D
15.【答案】(1)④⑤;①③⑧
(2)饱和FeCl3溶液;红褐色
(3)利用丁达尔效应
(4)H2SO4=2H++SO42-;焰色试验,火焰呈黄色
(5)CO2+KOH=KHCO3
16.【答案】(1)nCH2=CH-COOH;C
(2);溶解乙醇,吸收乙酸,降低乙酸乙酯的溶解度便于分层析出;无水CaCl2;i→b→g→e
17.【答案】(1)Na;或;;NaOH
(2)
(3)
18.【答案】(1)3FeO(s)+2Al(s)= Al2O3(s)+3 Fe(s)ΔH=—859.7kJ/mol
(2)增大;D
(3);减小
(4)107∶1;c;b;a
一、单选题
1.下列说法正确的是
A.失电子难的元素得电子一定容易
B.电离能越大的元素电负性一定越小
C.最外层电子排布为ns2的元素一定位于s区
D.不同能层的s轨道的空间取向均相同
2.中国古代书籍文字中,诸多记载都能感受到化学学科的久远与魅力。下列有关说法正确的是
A.硝石“强烧之,紫青烟起”,说明可分解
B.“丹砂烧之成水银”,发生了置换反应
C.“慈石,色轻紫,可吸连针铁”,慈石的主要成分为
D.“自元时始创其法,用浓酒和糟入甑,蒸令气上”,“法”是指蒸馏
3.下列说法正确的是
A.与互为同位素
B.碳纳米管和富勒烯互为同素异形体
C.与一定互为同系物
D.纤维素与淀粉互为同分异构体
4.下列说法正确的是
A.配制480mL0.100mol/L的CuSO4 溶液,需称取胆矾8.0g
B.在标准状况下等质量的甲烷和氧气的体积之比为1:2
C.同温同压下,相同体积的N2O、CO2气体含有相同的原子个数
D.H2 的摩尔质量等于它的相对原子质量
5.下列化学用语表述正确的是
A.醋酸的电离方程式:
B.铜-锌-稀硫酸原电池中,正极的电极反应式为
C.水解的离子方程式:
D.的电离方程式:
6.下列物质间的转化属于化学变化且能量变化符合图示变化的是
A.2Cl→Cl2 B.NaOH(s)溶解 C.水煤气燃烧 D.煅烧石灰石
7.乙烯的同系物2-丁烯存在以下转化关系:正丁烷。下列说法错误的是
A.反应①和反应②的反应类型相同
B.2-丁烯中最多有8个原子共平面
C.2-丁烯使溴水和酸性溶液褪色的原理相同
D.反应②的产物M只有一种结构
8.为探究化学平衡移动的影响因素,设计方案并进行实验,观察到相关现象。其中方案设计和结论都正确的是(已知:的氧化性与接近)
选项 影响因素 方案设计 现象 结论
A 浓度 向10.1溶液中加入11.0溶液 黄色溶液变橙色 增大反应物浓度,平衡向正反应方向移动
B 压强 向恒温恒容密闭玻璃容器中充入100气体,分解达到平衡后再充入100 气体颜色不变 对于反应前后气体总体积不变的可逆反应,改变压强平衡不移动
C 温度 将封装有和混合气体的烧瓶浸泡在热水中 气体颜色变深 升高温度,平衡向吸热反应方向移动
D 催化剂 向1乙酸乙酯中加入10.3溶液,水浴加热 上层液体逐渐减少 使用合适的催化剂可使平衡向正反应方向移动
A.A B.B C.C D.D
9.下列反应的方程式不正确的是
A.将碳酸氢钙溶液与过量的澄清石灰水混合:
B.将稀硫酸加入硫代硫酸钠溶液:
C.溶液与闪锌矿(ZnS)反应生成铜蓝(CuS):
D.向银氨溶液中滴加乙醛,水浴加热,析出光亮银镜:
10.是一种光催化半导体材料,其结构如图。有光照时,光催化材料会产生电子()和空穴(),能实现和转化,如图。下列说法错误的是
A.该半导体可以实现太阳能→电能→化学能
B.该半导体材料结构中,所有原子不可能共平面
C.有转化的过程可表示为
D.理论上每消耗,能产生标准状况下11.2L
11.设NA为阿伏加德罗常数,则下列叙述中正确的是
A.6.02×1022个H2SO4分子在水中可电离生成2NA个H+
B.在0℃、101kPa时,22.4L氢气中含有NA个氢原子
C.14g氮气中含有7NA个电子
D.NA个一氧化碳分子和0.5mol甲烷的质量比为7︰4
12.从微观视角探析物质结构及性质是学习化学的有效方法。下列实例与解释不符的是
选项 实例 解释
A 原子光谱是不连续的线状谱线 原子的能级是量子化的
B 键角依次减小 孤电子对与成键电子对的斥力大于成键电子对之间的斥力
C 晶体中与8个配位,而晶体中与6个配位 比的半径大
D 逐个断开中的键,每步所需能量不同 各步中的键所处化学环境不同
A.A B.B C.C D.D
13.下表是部分短周期元素的原子半径及主要化合价,根据表中信息,判断以下说法正确的是
元素符号 L M Q R T
原子半径/nm 0.160 0.143 0.089 0.102 0.074
主要化合价 +2 +3 +2 +6、-2 -2
A.L2+与R2-的核外电子数相等
B.M与L形成的最高价氧化物对应水化物的碱性:L>M
C.氢化物的稳定性为H2T
14.一定条件下,反应的速率方程为,已知:k为速率常数只与温度有关。某温度下,该反应在不同浓度下的反应速率如下:
反应速率
0.1 0.1 2
0.1 0.4 2
0.2 0.4 2
0.4 0.1 4
0.2 0.1 c
根据表中的测定结果,下列结论错误的是
A.的值为1
B.表中c的值为1
C.反应体系的三种物质中,的浓度对反应速率影响最大
D.在反应体系中保持其他物质浓度不变,增大浓度,会使反应速率升高
二、实验探究题
15.现有以下物质:①H2SO4;②液氨;③熔融KOH;④NaCl溶液;⑤Fe(OH)3胶体;⑥铜;⑦CO2;⑧CH3COOH;⑨蔗糖。
请回答下列问题:
(1)以上物质中属于混合物的是 (填序号),以上物质中属于电解质的是 (填序号)。
(2)Fe(OH)3胶体的制备。在小烧杯中加入20 mL蒸馏水,加热至沸腾后,向沸水中滴入几滴 ,继续煮沸至溶液呈 色,停止加热。
(3)区分④和⑤的简单方法是 。
(4)写出①在水溶液中的电离方程式 。检验④中所含阳离子的方法是 。
(5)在③的水溶液中缓缓通入过量的CO2可生成酸式盐,写出反应的化学方程式:
。
16.乙烯、乙醇是重要有机化工原料。回答下列问题:
已知:
(1)石蜡油裂解产生的不饱和烃是重要的有机合成中间体。
①D为高分子化合物,上图中生成D的方程式是 。
②下列装置正确且能达到实验目的的是 (填序号)。
A.甲装置:从石油中分离石蜡油 B.乙装置:证明石蜡油分解生成乙烯
C.丙装置:完成乙醇的催化氧化 D.丁装置:制备乙酸乙酯
(2)已知:CaCl2与C2H5OH形成CaCl2·6C2H5OH.实验室制备乙酸乙酯粗产品并精制提纯,流程如下。
①制备乙酸乙酯的化学方程式为 。
②饱和Na2CO3溶液的作用是 。
③为除去有机层2中的乙醇,加入的试剂X为 。
④选择合适的仪器组装完成操作2(夹持、加热及单孔、双孔橡胶塞、导管等连接仪器略),仪器的连接顺序为d→ 。
三、综合题
17.根据物质的组成和性质,可将物质进行分类,并实现物质之间的转化。由H、O、Na、S四种元素中的一种或几种元素能形成多种物质,利用这些物质回答下列问题。
(1)常温下能导电的固体为 (任写一种化学式,下同),属于非电解质的是 ,属于强酸的是 ,属于碱的是 。
(2)是由上述四种元素组成的化合物,其在水溶液中的电离方程式为 。
(3)写出由两种单质发生化合反应生成一种淡黄色固体的化学方程式,并用双线桥表示出电子转移数目 。
18.回答下列问题:
(1)已知:Fe(s)+ O2(g)= FeO(s) ΔH= -272.0KJ·mol-1
2Al(s)+ O2(s)= Al2O3(s) ΔH=-1675.7KJ·mol-1
Al和FeO发热反应的热化学方程式是 。
(2)某可逆反应在不同条件下的反应历程分别为A、B,如图所示。
①据图判断:当反应达到平衡后,其他条件不变,升高温度,反应物的转化率 (填“增大”“减小”或“不变”);
②其中B历程表明此反应采用的条件为 (选 填序号)。
A.升高温度 B.增大反应物的浓度
C. 降低温度 D.使用催化剂
(3)1000℃时,硫酸钠与氢气发生下列反应: Na2SO4(s)+4H2(g)= Na2S(s)+ 4H2O(g)。该反应的平衡常数表达式为K= ;已知K (1000℃ ) <K (1200℃) ,若降低体系温度,混合气体的平均相对分子质量将 (填“增大”、 “减小”或“不变”)。
(4)常温下,如果取0.1mol·L-1HA溶液与0.1mol ·L-1NaOH溶液等体积混合(混合后溶液体积的变化忽略不计),测得混合液的pH=8。
①混合液中由水电离出的OH—浓度与0.1mol·L-1NaOH溶液中由水电离出的OH—浓度之比为 ;
②已知NH4A溶液为中性,又知将HA溶液加到Na2CO3溶液中有气体放出,试推断相同温度下,等物质的量浓度的下列盐溶液按pH由大到小的排列顺序为(填序号) > >
a.NH4Cl b. NH4A c. (NH4)2CO3
参考答案
1.【答案】D
2.【答案】D
3.【答案】B
4.【答案】C
5.【答案】C
6.【答案】C
7.【答案】C
8.【答案】C
9.【答案】B
10.【答案】D
11.【答案】C
12.【答案】B
13.【答案】B
14.【答案】D
15.【答案】(1)④⑤;①③⑧
(2)饱和FeCl3溶液;红褐色
(3)利用丁达尔效应
(4)H2SO4=2H++SO42-;焰色试验,火焰呈黄色
(5)CO2+KOH=KHCO3
16.【答案】(1)nCH2=CH-COOH;C
(2);溶解乙醇,吸收乙酸,降低乙酸乙酯的溶解度便于分层析出;无水CaCl2;i→b→g→e
17.【答案】(1)Na;或;;NaOH
(2)
(3)
18.【答案】(1)3FeO(s)+2Al(s)= Al2O3(s)+3 Fe(s)ΔH=—859.7kJ/mol
(2)增大;D
(3);减小
(4)107∶1;c;b;a
同课章节目录
