2.1化学反应速率第一课时 课件 (共28张PPT) 高中化学 人教版(2019) 选择性必修1
文档属性
| 名称 | 2.1化学反应速率第一课时 课件 (共28张PPT) 高中化学 人教版(2019) 选择性必修1 |  | |
| 格式 | pptx | ||
| 文件大小 | 1.2MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2025-06-27 03:25:11 | ||
图片预览








文档简介
(共28张PPT)
化学反应 速率
延时符
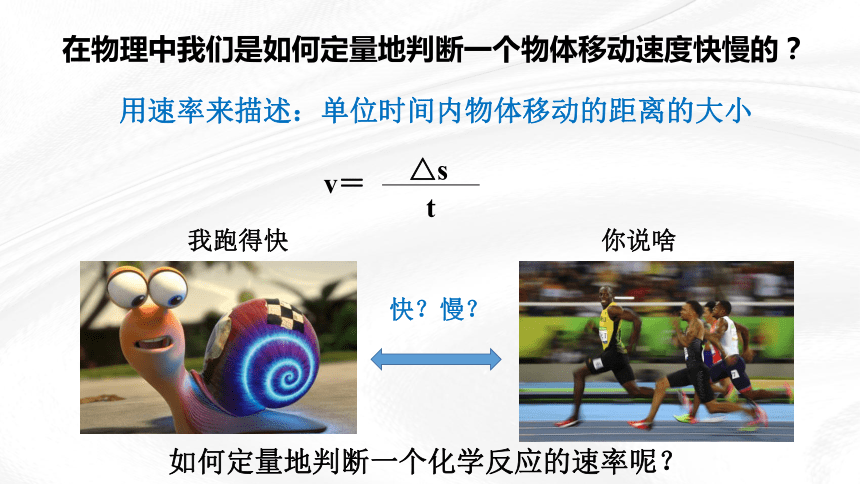
如何定量地判断一个化学反应的速率呢?
在物理中我们是如何定量地判断一个物体移动速度快慢的?
用速率来描述:单位时间内物体移动的距离的大小
v=
△s
t
我跑得快
你说啥
快?慢?
溶洞形成(几万年)
钢铁锈蚀(几月)
食物腐坏(几天)
核弹爆炸(瞬间)
这些图片中有些反应快,瞬时完成,有些需要很长时间,甚至上百万年,那我们如何衡量一个反应的快慢呢?
化学反应速率------
是用来衡量化学反应进行快慢程度
的一个物理量。
一、化学反应速率
1、含 义:
2、表示方法:
3、数学表达式:
4、单 位:
化学反应速率是用来衡量化学反应进行快慢的物理量。
通常是用单位时间内反应物浓度的减少或生成物浓度的增加来表示 。
mol/(L·s) 或 mol/(L·min)或 mol/(L·h)
=
v(m)=
△t
△c
注:固体、纯液体无浓度可言。
注:①反应速率取正值。 ②化学反应速率是平均速率。
(1)化学反应速率是标量,无正负号。
(2)化学反应速率随反应物和生成物的浓度、温度、压强等的改变而改变.因此这里指的是平均速率,而不是指瞬时速率。
(3)在同一反应中用不同物质来表示时,其数值可以不同。因此,表示化学反应的速率时,必须说明以哪种物质做标准。
(4)固体或纯液体(注意:不是溶液)的物质的量浓度可视为不变的常数,因此,一般不用固体或纯液体表示化学反应速率。
例如:2Na+2H2O===2NaOH+H2↑.则一般不用Na或H2O表示化学反应速率。
5、几点说明
(一)利用计算式
例1、在某一化学反应里,反应物A的浓度在10 s内从4.0 mol·L-1变成1.0 mol·L-1,在这10 s内A的化学反应速率为多少?
解:
V(A)=(4.0-1.0)/10=0.3mol/(L·s)
二、化学反应速率的计算
练习1 在某一化学反应中,反应物 B 的浓度在 5 s 内
从 2 mol/L 变为 0.5 mol/L,则 5 s 内 B 的化学反应速率为______ mol / (L·s) 。
练习2 某一化学反应在 2 L 的溶液中进行,生成物 B
的物质的量在 2 min 内从 1 mol 变为 4 mol,求在这 2 min 内 B 的化学反应速率为______ mol / (L·min)。
0.3
0.75
二、化学反应速率的计算
(一)利用计算式
3.A、B、C、D四种物质都是气体,反应4A+5B=4C+6D在5 L的密闭容器中进行,30 s后C的物质的量增加了0.30 mol。则30s内C的反应速率是多少?
0.002mol/(L·s)
【牛刀小试】
(二)三段法
求解有关化学反应速率的计算题的一般步骤
(1)写出有关反应的化学方程式.
(2)找出各物质的起始量、转化量、某时刻量.
(3)根据已知条件列方程计算.
【例2】2L的密闭容器中,加入1molN2和3molH2,发生 N2+3H2 2NH3 ,在2s末时,测得容器中有0.4mol的NH3 ,0.8molN2和2.4molH2 ,求该反应的化学反应速率。
起始浓度C0(mol/L)
2s末浓度Ct(mol/L)
变化浓度△C (mol/L)
0.5
1.5
0
0.2
0.2
0.3
0.1
0.4
1.2
化学反应速率之比等于方程式中它们的计量数之比
【观察思考】v(NH3), v(N2), v(H2)是否都表示此反应的速率?数值上有何规律?
观察并回答,分别用三种物质表示的反应速率之间有什么关系?
问题1
同一个反应,用不同的物质来表示反应速
率,数值是不一样的,所以应注明是由哪种物
质表示的。
同一反应中,各物质的速率之比等于他们在化学方程式中的化学计量数之比。
结论1
V(A)︰V(B)︰V(C)︰V(D)= a : b : c : d
V(A)︰V(B)︰V(C)= m : n : p
v(A)= m/n v(B)=m/P v(C)
课堂检测
1 .向2L的密闭容器(内有催化剂)充入2mol的SO2和1molO2,经2s,测得容器内有1mol的SO3,则该反应中SO2、O2、 SO3的速率可怎样表示?( SO2、O2、 SO3均为气体)
解: 2SO2(g) + O2(g) 2SO3(g)
起始量(mol/L): 1 0.5 0
变化量(mol/L): 0.5 0.25 0.5
2s末量(mol/L): 0.5 0.25 0.5
则 v(SO2)= v(SO3)= 0. 5/2= 0.25 mol/(L·s)
v(O2)= 0.125 mol/(L·s)
(三)利用速率比等于系数比
1、用不同的物质来表示反应速率。
【例4】反应4NH3 + 5O2 == 4NO + 6H2O 在5L的密闭容器中进行,30s后恢复到室温时,NO的物质的量增加了0.3mol,则此反应的平均速率可表示为:( )
A.v (O2)=0.01 mol/(L·s ) B.v (NO)=0.008 mol/(L·s)
C.v (H2O)=0.003 mol/(L·s) D.v (NH3)=0.002 mol/(L·s)
E.5v (O2)=6v(H2O) F、 v (NO)=v (NH3)
DF
2、比较反应速率的大小
【例5】反应A + 3B == 2C + 2D在四种不同情况下的反应速率分别为
①V(A) = 0.15mol·L-1·s-1 ②V(B) = 0.6mol·L-1·s-1
③V(C) = 0.4mol·L-1·s-1 ④V(D) = 0.45mol·L-1·s-1
则该反应在不同条件下速率快慢顺序是
④﹥ ②= ③﹥ ①
解法:在同一反应中,反应速率的大小不能单纯地看数值大小,应化为同一种物质的反应速率且注意要统一单位再进行比较。
3、根据各物质的浓度变化量之比写出化学方程式。
【例6】某温度下,浓度都是1mol/L的两种气体X2和Y2,在密闭容器中反应生成气体Z,经过t min后,测得物质的量浓度分别为:c(X2)=0.4mol/L , c(Y2)=0.8mol/L ,c(Z)=0.4mol/L,则该反应的反应方程式可表示为:
3X2 + Y2 === 2Z
3X2 + Y2 === 2X3Y
4、其它
【例7】某温度下,向一个容积为2L的真空密闭容器中通入1molN2和3molH2 ,3分钟后,测得容器内的压强是开始时的0.9倍,则这段时间内v(H2)= mol/(L·min)
0.1
[特别关注]
化学反应速率的考查方式
(1)已知一种物质的反应速率,求其他物质的反应速率.
(2)由化学反应速率之比书写有关化学反应方程式.
(3)通过转化为同一物质的反应速率,比较同一化学反应
方程式中不同物质表示的速率的相对大小.
例8.根据下图填空:
(1)反应物是_____;生成物是_____。
(2)2min内A、B、C三者的反应速率是多少?该反应的化学方程式是____________
B、A
C
2B+3A 3C
对于反应A+3B=2C+2D,下列数据表示不同条件的反应速率,其中反应进行得最快的是( )
v (A) =0.15mol/(L·S) B. v (B) =0.6mol/(L · S)
C. v (C) =1mol/(L · S) D. v (D) =2mol/(L · min)
标准一致,单位统一
例9:
C
[关键一点]
利用反应速率比较反应进行的快慢,应根据化学方程式中的化学计量数关系进行转化.
容易出现的问题:①用不同物质的速率比较,只比较数值大小,不考虑计量关系.②不注意反应速率单位的一致性.
D
课堂检测
1、可逆反应A(g)+ B(g) C(g)+ D(g),
在四种不同情况下的反应速率如下,其中反应进行得
最快的是( )
A. v(A) = 0.15 mol/(L·min)
B. v(B) = 0.5 mol/(L·min)
C. v(C) = 0.4 mol/(L·min)
D. v(D) = 0.01 mol/(L·s)
课堂检测
2、在2L的密闭容器中,发生下列反应:
3A(g)+ B(g)====2C(g)+D(g)。
若最初加入的A 和B 都是4mol,在前10s A 的平均反应速率为0.12mol/(L·s),则10s时,容器中B的物质的量为 。
3.2mol
3.把0.6molX气体的0.4molY气体混合于2L容器中,做使
它们发生如下反应:
3X+Y= nZ+2W。
5min末已生成0.2molW,若测知V(z)=0.01mol/(L·min),则
⑴上述反应中Z气体的计量数n的值是( )
A.1 B.2 C.3 D.4
⑵上述反应在5min末时,Y的转化率是( )
A.20% B.25% C.33% D.50%
A
B
5、反应4NH3 + 5O2 === 4NO + 6H2O 在5L的密闭容器中进行,30s后恢复到室温时,NO的物质的量增加了0.3mol,则此反应的平均速率可表示为:( )
A.v (O2)=0.01 mol/(L·s) B. v (NO)=0.048 mol/(L·min)
C. v (H2O)=0.003 mol/(L·s) D. v (NH3)=0.002 mol/(L·s )
解法:先求v (NO)=0.3/(5×30) =0.002 mol/(L·s) ,
再根据各物质的反应速率之比等于计量数之比。
D
练习题
3、已知反应:N2 +3H2 2NH3 根据下图判断
(1)A是______物质的量
浓度变化情况
(2)C是______物质的量
浓度变化情况
(3)2分钟内N2的平均
速率是:
H2
NH3
0.5mol/(L· min )
化学反应 速率
延时符
如何定量地判断一个化学反应的速率呢?
在物理中我们是如何定量地判断一个物体移动速度快慢的?
用速率来描述:单位时间内物体移动的距离的大小
v=
△s
t
我跑得快
你说啥
快?慢?
溶洞形成(几万年)
钢铁锈蚀(几月)
食物腐坏(几天)
核弹爆炸(瞬间)
这些图片中有些反应快,瞬时完成,有些需要很长时间,甚至上百万年,那我们如何衡量一个反应的快慢呢?
化学反应速率------
是用来衡量化学反应进行快慢程度
的一个物理量。
一、化学反应速率
1、含 义:
2、表示方法:
3、数学表达式:
4、单 位:
化学反应速率是用来衡量化学反应进行快慢的物理量。
通常是用单位时间内反应物浓度的减少或生成物浓度的增加来表示 。
mol/(L·s) 或 mol/(L·min)或 mol/(L·h)
=
v(m)=
△t
△c
注:固体、纯液体无浓度可言。
注:①反应速率取正值。 ②化学反应速率是平均速率。
(1)化学反应速率是标量,无正负号。
(2)化学反应速率随反应物和生成物的浓度、温度、压强等的改变而改变.因此这里指的是平均速率,而不是指瞬时速率。
(3)在同一反应中用不同物质来表示时,其数值可以不同。因此,表示化学反应的速率时,必须说明以哪种物质做标准。
(4)固体或纯液体(注意:不是溶液)的物质的量浓度可视为不变的常数,因此,一般不用固体或纯液体表示化学反应速率。
例如:2Na+2H2O===2NaOH+H2↑.则一般不用Na或H2O表示化学反应速率。
5、几点说明
(一)利用计算式
例1、在某一化学反应里,反应物A的浓度在10 s内从4.0 mol·L-1变成1.0 mol·L-1,在这10 s内A的化学反应速率为多少?
解:
V(A)=(4.0-1.0)/10=0.3mol/(L·s)
二、化学反应速率的计算
练习1 在某一化学反应中,反应物 B 的浓度在 5 s 内
从 2 mol/L 变为 0.5 mol/L,则 5 s 内 B 的化学反应速率为______ mol / (L·s) 。
练习2 某一化学反应在 2 L 的溶液中进行,生成物 B
的物质的量在 2 min 内从 1 mol 变为 4 mol,求在这 2 min 内 B 的化学反应速率为______ mol / (L·min)。
0.3
0.75
二、化学反应速率的计算
(一)利用计算式
3.A、B、C、D四种物质都是气体,反应4A+5B=4C+6D在5 L的密闭容器中进行,30 s后C的物质的量增加了0.30 mol。则30s内C的反应速率是多少?
0.002mol/(L·s)
【牛刀小试】
(二)三段法
求解有关化学反应速率的计算题的一般步骤
(1)写出有关反应的化学方程式.
(2)找出各物质的起始量、转化量、某时刻量.
(3)根据已知条件列方程计算.
【例2】2L的密闭容器中,加入1molN2和3molH2,发生 N2+3H2 2NH3 ,在2s末时,测得容器中有0.4mol的NH3 ,0.8molN2和2.4molH2 ,求该反应的化学反应速率。
起始浓度C0(mol/L)
2s末浓度Ct(mol/L)
变化浓度△C (mol/L)
0.5
1.5
0
0.2
0.2
0.3
0.1
0.4
1.2
化学反应速率之比等于方程式中它们的计量数之比
【观察思考】v(NH3), v(N2), v(H2)是否都表示此反应的速率?数值上有何规律?
观察并回答,分别用三种物质表示的反应速率之间有什么关系?
问题1
同一个反应,用不同的物质来表示反应速
率,数值是不一样的,所以应注明是由哪种物
质表示的。
同一反应中,各物质的速率之比等于他们在化学方程式中的化学计量数之比。
结论1
V(A)︰V(B)︰V(C)︰V(D)= a : b : c : d
V(A)︰V(B)︰V(C)= m : n : p
v(A)= m/n v(B)=m/P v(C)
课堂检测
1 .向2L的密闭容器(内有催化剂)充入2mol的SO2和1molO2,经2s,测得容器内有1mol的SO3,则该反应中SO2、O2、 SO3的速率可怎样表示?( SO2、O2、 SO3均为气体)
解: 2SO2(g) + O2(g) 2SO3(g)
起始量(mol/L): 1 0.5 0
变化量(mol/L): 0.5 0.25 0.5
2s末量(mol/L): 0.5 0.25 0.5
则 v(SO2)= v(SO3)= 0. 5/2= 0.25 mol/(L·s)
v(O2)= 0.125 mol/(L·s)
(三)利用速率比等于系数比
1、用不同的物质来表示反应速率。
【例4】反应4NH3 + 5O2 == 4NO + 6H2O 在5L的密闭容器中进行,30s后恢复到室温时,NO的物质的量增加了0.3mol,则此反应的平均速率可表示为:( )
A.v (O2)=0.01 mol/(L·s ) B.v (NO)=0.008 mol/(L·s)
C.v (H2O)=0.003 mol/(L·s) D.v (NH3)=0.002 mol/(L·s)
E.5v (O2)=6v(H2O) F、 v (NO)=v (NH3)
DF
2、比较反应速率的大小
【例5】反应A + 3B == 2C + 2D在四种不同情况下的反应速率分别为
①V(A) = 0.15mol·L-1·s-1 ②V(B) = 0.6mol·L-1·s-1
③V(C) = 0.4mol·L-1·s-1 ④V(D) = 0.45mol·L-1·s-1
则该反应在不同条件下速率快慢顺序是
④﹥ ②= ③﹥ ①
解法:在同一反应中,反应速率的大小不能单纯地看数值大小,应化为同一种物质的反应速率且注意要统一单位再进行比较。
3、根据各物质的浓度变化量之比写出化学方程式。
【例6】某温度下,浓度都是1mol/L的两种气体X2和Y2,在密闭容器中反应生成气体Z,经过t min后,测得物质的量浓度分别为:c(X2)=0.4mol/L , c(Y2)=0.8mol/L ,c(Z)=0.4mol/L,则该反应的反应方程式可表示为:
3X2 + Y2 === 2Z
3X2 + Y2 === 2X3Y
4、其它
【例7】某温度下,向一个容积为2L的真空密闭容器中通入1molN2和3molH2 ,3分钟后,测得容器内的压强是开始时的0.9倍,则这段时间内v(H2)= mol/(L·min)
0.1
[特别关注]
化学反应速率的考查方式
(1)已知一种物质的反应速率,求其他物质的反应速率.
(2)由化学反应速率之比书写有关化学反应方程式.
(3)通过转化为同一物质的反应速率,比较同一化学反应
方程式中不同物质表示的速率的相对大小.
例8.根据下图填空:
(1)反应物是_____;生成物是_____。
(2)2min内A、B、C三者的反应速率是多少?该反应的化学方程式是____________
B、A
C
2B+3A 3C
对于反应A+3B=2C+2D,下列数据表示不同条件的反应速率,其中反应进行得最快的是( )
v (A) =0.15mol/(L·S) B. v (B) =0.6mol/(L · S)
C. v (C) =1mol/(L · S) D. v (D) =2mol/(L · min)
标准一致,单位统一
例9:
C
[关键一点]
利用反应速率比较反应进行的快慢,应根据化学方程式中的化学计量数关系进行转化.
容易出现的问题:①用不同物质的速率比较,只比较数值大小,不考虑计量关系.②不注意反应速率单位的一致性.
D
课堂检测
1、可逆反应A(g)+ B(g) C(g)+ D(g),
在四种不同情况下的反应速率如下,其中反应进行得
最快的是( )
A. v(A) = 0.15 mol/(L·min)
B. v(B) = 0.5 mol/(L·min)
C. v(C) = 0.4 mol/(L·min)
D. v(D) = 0.01 mol/(L·s)
课堂检测
2、在2L的密闭容器中,发生下列反应:
3A(g)+ B(g)====2C(g)+D(g)。
若最初加入的A 和B 都是4mol,在前10s A 的平均反应速率为0.12mol/(L·s),则10s时,容器中B的物质的量为 。
3.2mol
3.把0.6molX气体的0.4molY气体混合于2L容器中,做使
它们发生如下反应:
3X+Y= nZ+2W。
5min末已生成0.2molW,若测知V(z)=0.01mol/(L·min),则
⑴上述反应中Z气体的计量数n的值是( )
A.1 B.2 C.3 D.4
⑵上述反应在5min末时,Y的转化率是( )
A.20% B.25% C.33% D.50%
A
B
5、反应4NH3 + 5O2 === 4NO + 6H2O 在5L的密闭容器中进行,30s后恢复到室温时,NO的物质的量增加了0.3mol,则此反应的平均速率可表示为:( )
A.v (O2)=0.01 mol/(L·s) B. v (NO)=0.048 mol/(L·min)
C. v (H2O)=0.003 mol/(L·s) D. v (NH3)=0.002 mol/(L·s )
解法:先求v (NO)=0.3/(5×30) =0.002 mol/(L·s) ,
再根据各物质的反应速率之比等于计量数之比。
D
练习题
3、已知反应:N2 +3H2 2NH3 根据下图判断
(1)A是______物质的量
浓度变化情况
(2)C是______物质的量
浓度变化情况
(3)2分钟内N2的平均
速率是:
H2
NH3
0.5mol/(L· min )
