专题3《从海水中获得的化学物质》单元检测题(含答案) 苏教版高中化学必修第一册
文档属性
| 名称 | 专题3《从海水中获得的化学物质》单元检测题(含答案) 苏教版高中化学必修第一册 |  | |
| 格式 | docx | ||
| 文件大小 | 321.2KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 苏教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2025-06-30 10:37:24 | ||
图片预览




文档简介
专题3《从海水中获得的化学物质》单元检测题
一、单选题(共13题)
1.下列有关Na2O2的叙述中,正确的是()
A.过氧化钠与二氧化碳反应是置换反应
B.过氧化钠可用于呼吸面具中作为氧气的来源
C.过氧化钠常用于自来水杀菌消毒
D.阴离子与阳离子个数比为1:1
2.化学与生活、社会发展息息相关,下列有关说法正确的是
A.硅胶、生石灰、铁粉是食品包装中常用的干燥剂
B.亚硝酸钠溶液具有防腐作用,可用其来浸泡新鲜瓜果
C.《本草经集注》中记载了区分硝石(KNO3)和朴硝(Na2SO4)的方法:“以火烧之,紫青烟起,乃真硝石也”,这是利用了“焰色反应”
D.BaCO3 是难溶于水的强电解质,在医学上用作钡餐
3.碱式碳酸镁是橡胶制品的填充剂和补强剂,其化学式为xMg(OH)2·yMgCO3·zH2O。现取4.66 g 碱式碳酸镁高温煅烧至恒重,得到2.00 g固体和0.0400 mol CO2.下列说法中正确的是
A.2.00 g固体是Mg(OH)2
B.4.66 g碱式碳酸镁高温煅烧至恒重,生成水0.800 g
C.4.66 g碱式碳酸镁加盐酸完全溶解,参加反应的HCl为0.0800 mol
D.该碱式碳酸镁的化学式为Mg(OH)2·4MgCO3·4H2O
4.某无色透明溶液,能与铝反应放出氢气,此溶液中一定大量共存的离子组是( )
A. SO、Na+、Cl-、K+ B.SO、Na+、HCO、K+
C.NO、Mg2+、Cl-、Ba2+ D.Cu2+、Cl-、Fe2+、SO
5.下列反应中属于氧化还原反应的是
A.NH3+HCl=NH4Cl B.2Fe(OH)3Fe2O3+3H2O
C.3Fe+4H2O(g)Fe3O4+4H2↑ D.CaCO3+2HCl=CaCl2+H2O+CO2↑
6.下列说法不正确的是
A.过氧化钠可在呼吸面具或潜水艇中作为氧气的来源
B.漂白粉既可作漂白棉、麻、纸张的漂白剂,又可用作游泳池等场所的消毒剂
C.碳酸氢钠可用于治疗胃酸过多
D.金属钠具有较强的还原性,可与四氯化钛溶液反应置换出钛
7.下列关于漂白粉的叙述正确的是
A.漂白粉可用NaOH制得
B.漂白粉的有效成分是和
C.漂白粉是由与消石灰制得的纯净物
D.漂白粉暴露在空气中会变质失效
8.某同学在做实验时引发了镁失火,她立即拿起二氧化碳灭火器欲把火扑灭,却被实验老师及时制止。原因是CO2可以支持镁燃烧发生以下反应:2Mg+CO22MgO+C。下列关于该反应的判断正确的是
A.镁元素化合价由0价升高到+2价,所以MgO是还原剂
B.由此反应可以判断氧化性CO2>MgO,还原性Mg>C
C.CO2作氧化剂,表现氧化性,发生氧化反应
D.镁原子失去的电子数目等于氧原子得到的电子数目
9.有关氯元素,下列叙述正确的是
A.Cl2的化学性质活泼,与H2混合后会立即发生爆炸
B.光照下,新制氯水会产生气泡,该气体是Cl2
C.若发生Cl2泄漏,应立即向高处转移
D.漂白粉比HClO稳定,可露置在空气中长期保存
10.某溶液能溶解氢氧化铝,则在其中一定可以大量存在的离子组是
A.Na+、SO、Cl- B.K+、CO、NO
C.Mg2+、SO、Br- D.NH、NO、AlO
11.各物质中含有的少量杂质以及除去这些杂质对应的方法如表所示
物质 杂质 除去杂质的方法
① 溶液 加入适量溶液并过滤
② 溶液 加入过量铁粉并过滤
③ 先通过盛有溶液的洗气瓶,再通过盛有浓硫酸的洗气瓶
④ 溶解、过滤、蒸发
其中正确的是A.①②③④ B.④ C.②③④ D.①②③
12.下列离子方程式正确的是
A.Cl2通入水中:Cl2+H2O=2H++Cl-+ClO-
B.稀H2SO4与铁粉反应:2Fe+6H+=2Fe3++3H2↑
C.钠与水反应:Na+2H2O=Na++2OH-+H2↑
D.鸡蛋壳在盐酸中溶解:CaCO3+2H+=Ca2++H2O+CO2↑
13.某混合溶液中所含离子的浓度如表,则离子可能为
所含离子
个数
A. B. C. D.
二、非选择题(共10题)
14.在含有一定量NaHCO3和Na2CO3溶质的溶液中,逐滴滴入一定浓度的稀盐酸,产生CO2的物质的量与滴入盐酸的量的关系如图,回答下列问题:
(1)0~a点发生反应的离子方程式为____
(2)NaHCO3与Na2CO3物质的量之比为____。
(3)b=____(用含a的代数式表示)。
15.按要求填写下列内容:
(1)根据下列四种元素(O、H、Ca、C 、Na)写化学式:酸_______;碱_______;盐_______。(各写一种)
下列物质①Cu ②SO2 ③NaCl溶液 ④HCl ⑤BaSO4固体⑥NH3 ⑦酒精 ⑧硫酸溶液 ⑨NaOH 固体 ⑩冰水混合物
(2)其中属于电解质的有_______;
(3)属于非电解质的有_______;
(4)能导电的有_______;
(5)③和④能否发生离子反应_______(填“能”或“不能”),原因是_____;
(6)④和⑨反应的离子方程式:_________;
16.(ⅰ)把等物质的量的Cu、Fe粉投入到一定量的FeCl3溶液中充分反应,然后取出部分溶液。
(1)若滴加一滴KSCN溶液,溶液显红色,则溶液中存在的离子有____。
(2)若滴加一滴KSCN溶液,溶液不显红色,则溶液中一定存在的离子有____,可能存在的金属粉末有____。
(ⅱ)向500mLNaOH溶液中投入10.8gAl,二者恰好完全反应,试计算:
(3)Al的物质的量___。
(4)参加反应的NaOH的物质的量和溶液中溶质的物质的量浓度____、____。
(5)在标准状况下生成H2的体积____。
17.取2.3克的钠投入500mL水中,完全反应后问:
(1)生成的气体体积在标准状态下为多少升___
(2)形成的溶液的物质的量浓度为多少___?
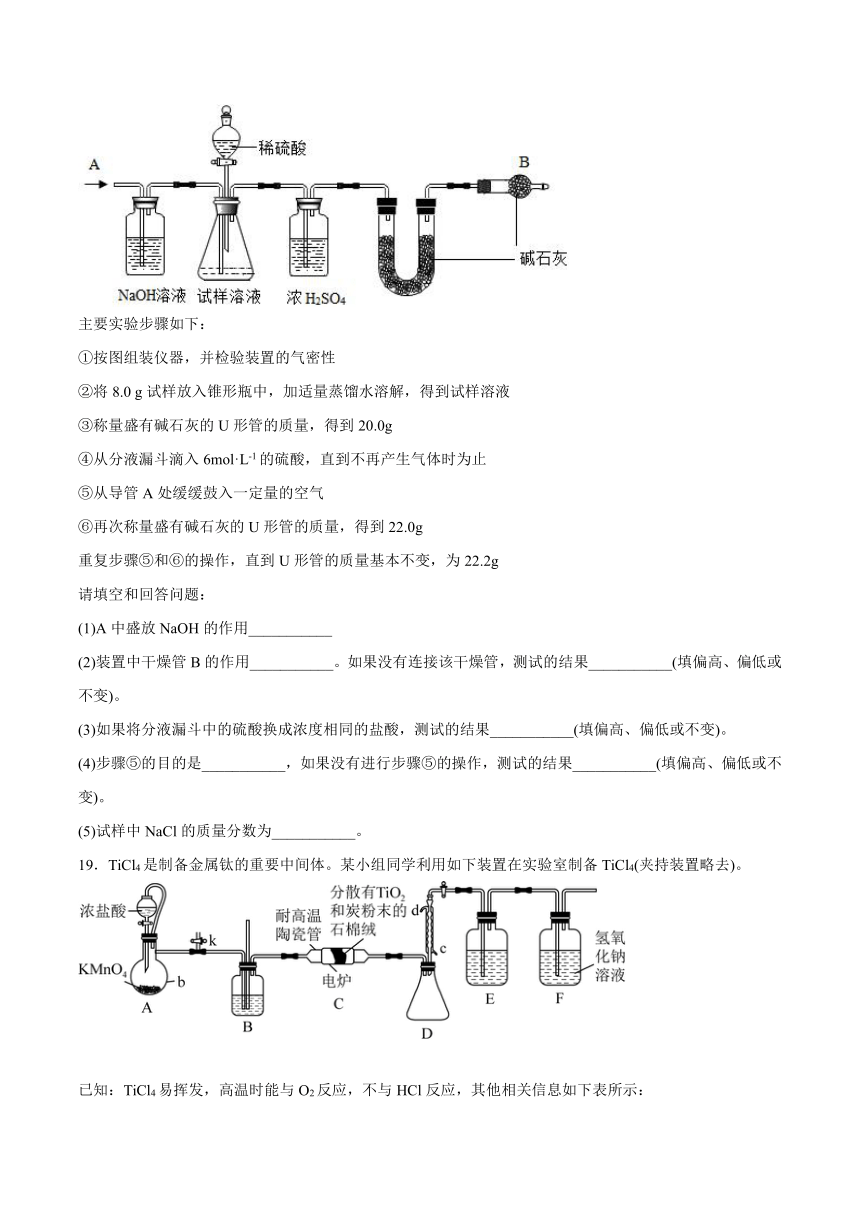
18.已知某纯碱试样中含有NaCl杂质,为测定试样中NaCl的质量分数,可用下图中的装置进行实验。
主要实验步骤如下:
①按图组装仪器,并检验装置的气密性
②将8.0 g试样放入锥形瓶中,加适量蒸馏水溶解,得到试样溶液
③称量盛有碱石灰的U形管的质量,得到20.0g
④从分液漏斗滴入6mol·L-1的硫酸,直到不再产生气体时为止
⑤从导管A处缓缓鼓入一定量的空气
⑥再次称量盛有碱石灰的U形管的质量,得到22.0g
重复步骤⑤和⑥的操作,直到U形管的质量基本不变,为22.2g
请填空和回答问题:
(1)A中盛放NaOH的作用___________
(2)装置中干燥管B的作用___________。如果没有连接该干燥管,测试的结果___________(填偏高、偏低或不变)。
(3)如果将分液漏斗中的硫酸换成浓度相同的盐酸,测试的结果___________(填偏高、偏低或不变)。
(4)步骤⑤的目的是___________,如果没有进行步骤⑤的操作,测试的结果___________(填偏高、偏低或不变)。
(5)试样中NaCl的质量分数为___________。
19.TiCl4是制备金属钛的重要中间体。某小组同学利用如下装置在实验室制备TiCl4(夹持装置略去)。
已知:TiCl4易挥发,高温时能与O2反应,不与HCl反应,其他相关信息如下表所示:
熔点/℃ 沸点/℃ 密度/(g·cm-3) 水溶性
TiCl4 -24 136.4 1.7 易水解生成白色沉淀,能溶于有机溶剂
CC14 -23 76.8 1.6 难溶于水
回答下列问题:
(1)A装置仪器b的名称是_______,E装置中的试剂是_______。
(2)装置A中发生反应的离子方程式为_______。
(3)在通入Cl2前,先打开开关k,从侧管持续通入一段时间的CO2气体的目的是_______。
(4)装置C中除生成TiCl4外,还生成一种气态不成盐氧化物,该反应的化学方程式为_______。
(5)制得的TiCl4中常含有少量CCl4,从混合液中分离出TiCl4操作的名称是_______。
(6)利用如图装置测定所得TiCl4的纯度:取wg产品加入烧瓶,向安全漏斗中加入适量蒸馏水,待TiCl4充分反应后,将烧瓶和漏斗中的液体一并转入锥形瓶中,滴加几滴0.1mol·L-1K2CrO4溶液作指示剂,用cmol·L-1AgNO3标准溶液滴定至终点,消耗标准溶液VmL。已知:常温下,Ksp(AgCl)=1.8×10-10、Ksp(Ag2CrO4)=1.1×10-12,Ag2CrO4呈砖红色,TiCl4+(2+n)H2O=TiO2·nH2O↓+4HCl。
①安全漏斗在本实验中的作用除加水外,还有_______;
②滴定终点的判断方法是_______;
③产品的纯度为_______(用含w、c和V的代数式表示)。
20.实验室有一瓶密封不严的漂白粉样品,其中肯定含有,请设计实验探究该样品中可能存在的其他物质[已知可使品红溶液褪色]。
(1)提出合理假设。
假设①:该漂白粉未变质,含有___________;
假设②:该漂白粉全部变质,含有___________;
假设③:该漂白粉部分变质,既含有,又含有。
(2)设计实验方案,进行实验。
实验步骤 预期现象和结论
实验①:取少量上述漂白粉样品于试管中,加入适量稀盐酸,观察是否有气泡产生 a.若无气泡产生,则假设___________成立 b.___________
实验②:向实验①反应后的试管中滴人1~2滴品红溶液,振荡 c.若品红溶液褪色,结合实验①中的b判断,则假设___________成立 d.若品红溶液不褪色,结合b判断,则假设___________成立
21.高中化学课本必修一中出现的部分物质间的转化关系如下图所示(部分物质已省略。已知A→B是实验室制取氯气的主要方法之一,H的焰色试验呈黄色),请完成下列填空。
(1)E和H的化学式为:E___________;H___________。
(2)检验K溶液中阳离子的试剂是___________。若K中含有F的杂质,应加入___________(填化学式)除杂。
(3)I转化为J的化学方程式为___________。
(4)K的饱和溶液滴入沸水中,可得到胶体L。胶体L区别于K的饱和溶液最本质的特征是___________(填字母序号)。
A.胶体L的分散质粒子直径为 B.胶体L比K的饱和溶液颜色深
C.胶体L是均一的分散系 D.胶体L具有丁达尔效应
(5)当前,新冠病毒变异毒株奥密克戎来势汹汹,化学消毒剂在疫情防控中起着重要作用。
①目前,很多自来水厂用氯气来杀菌、消毒。A→B的离子反应方程式为___________。
②C可以杀菌、消毒,但不稳定,难以保存,原因是___________(用化学方程式表示)。
③将B通入G溶液中可得到一种漂白液,能杀菌、消毒,该漂白液的有效成分是___________。
④为国际公认的高效安全灭菌消毒剂之一、常温下,亚氯酸钠()固体与B反应可得到和NaCl,该反应中,氧化剂与还原剂的物质的量之比为___________。
22.下列图示中,A为一种常见的单质,B、C、D、E是含有A元素的常见化合物,B为淡黄色固体。
回答下列问题:
(1)写出化学式:A_____________,D_____________。
(2)写出基本反应类型:反应①_____________,反应②_____________。
(3)反应③的化学方程式为_______________________________________。
(4)向D溶液中通入,反应的化学方程式为_______________________________________。
23.2021年3月22日是第二十九届“世界水日”。为了深人开展珍惜水、爱护水的主题活动,推进水资源的集约安全利用,某校、化学兴趣小组的同学展开对我市某饮用水源水库水组成问题的研究,他们猜想该水库水中可能含有大量Cu2+、Ca2+、Mg2+和某些阴离子,从而进行了三组实验:
①取适量该水库水于试管中,滴加过量的NaOH溶液,产生白色沉淀;
②过滤后取滤液于试管中,滴加过量的Na2CO3溶液,又有白色沉淀生成:
③另取适量该水库水于试管中,滴加足量稀硝酸后再滴加AgNO3溶液,也产生白色沉淀。
请根据已有知识和反应事实回答以下问题:
(1)该小组有关大量存在___________ (填写离子符号)的猜想是错误的。
(2)通过实验可初步确定该水库水中___________(填“含有”或“不含有”)大量Ca+、Mg2+;判断依据的离子方程式有___________。
(3)该水库水中所含阴离子可以确定有___________,理由是___________。
(4)确定实验②中滴加的Na2CO3溶液已过量的检验方法是___________。
参考答案:
1.B 2.C 3.D 4.A 5.C 6.D 7.D 8.B 9.C 10.A 11.C 12.D 13.D
14.(1)CO+H+=HCO
(2)3∶2
(3)2.5a
15.(1) H2CO3 NaOH或Ca (OH)2 Na2CO3, CaCO3,NaHCO3,Ca(HCO3)2
(2)④⑤⑨⑩
(3)②⑥⑦
(4)①③⑧⑩
(5) 不能 原因是离子间发生复分解反应的条件是产物中有气体、沉淀或水生成,而③和④混合后不能满足这一条件
(6)H++OH-=H2O
16.(1)Cu2+、Fe2+、Fe3+、Cl-
(2) Fe2+、Cl- Fe、Cu或Cu
(3)0.4mol
(4) 0.4mol 0.8mol·L 1
(5)13.44L
17. 1.12L 0.2mol/L
18. 除去空气中的二氧化碳 防止空气中的CO2和水气进入U形管中 偏低 偏低 把反应产生的CO2全部导入U形管中 偏高 33.75%
19.(1) 蒸馏烧瓶 浓硫酸
(2)2MnO+16H++10Cl-=2Mn2++5Cl2↑+8H2O
(3)排除装置中的空气,防止TiCl4和O2反应
(4)TiO2+2C+2Cl2TiCl4+2CO
(5)蒸馏
(6) 液封,吸收挥发的HCl气体 当加入最后一滴AgNO3标准溶液时,溶液恰好出现砖红色沉淀,且半分钟不消失 或
20.(1)
(2) ① 若有气泡产生,则假设②或假设③成立 ③ ②
21.(1) Fe NaCl
(2) KSCN Cl2
(3)4Fe(OH)2+O2+2H2O=4Fe(OH)3
(4)A
(5) MnO2+4H++2Cl-Mn2++2H2O+Cl2↑ 2HClO2HCl+O2↑ NaClO 1:2
22. Na 化合反应 置换反应
23.(1)Cu2+
(2) 含有 Mg2++2OH-=Mg(OH)2↓,CO+Ca2+=CaCO3↓
(3) Cl- Cl-+Ag+=AgCl↓,AgCl不溶于稀硝酸
(4)取适量实验②反应后的上层清液于试管中,滴加足量盐酸,若产生无色气泡(或滴加CaCl2溶液,若产生白色沉淀),证明Na2CO3溶液已过量。
一、单选题(共13题)
1.下列有关Na2O2的叙述中,正确的是()
A.过氧化钠与二氧化碳反应是置换反应
B.过氧化钠可用于呼吸面具中作为氧气的来源
C.过氧化钠常用于自来水杀菌消毒
D.阴离子与阳离子个数比为1:1
2.化学与生活、社会发展息息相关,下列有关说法正确的是
A.硅胶、生石灰、铁粉是食品包装中常用的干燥剂
B.亚硝酸钠溶液具有防腐作用,可用其来浸泡新鲜瓜果
C.《本草经集注》中记载了区分硝石(KNO3)和朴硝(Na2SO4)的方法:“以火烧之,紫青烟起,乃真硝石也”,这是利用了“焰色反应”
D.BaCO3 是难溶于水的强电解质,在医学上用作钡餐
3.碱式碳酸镁是橡胶制品的填充剂和补强剂,其化学式为xMg(OH)2·yMgCO3·zH2O。现取4.66 g 碱式碳酸镁高温煅烧至恒重,得到2.00 g固体和0.0400 mol CO2.下列说法中正确的是
A.2.00 g固体是Mg(OH)2
B.4.66 g碱式碳酸镁高温煅烧至恒重,生成水0.800 g
C.4.66 g碱式碳酸镁加盐酸完全溶解,参加反应的HCl为0.0800 mol
D.该碱式碳酸镁的化学式为Mg(OH)2·4MgCO3·4H2O
4.某无色透明溶液,能与铝反应放出氢气,此溶液中一定大量共存的离子组是( )
A. SO、Na+、Cl-、K+ B.SO、Na+、HCO、K+
C.NO、Mg2+、Cl-、Ba2+ D.Cu2+、Cl-、Fe2+、SO
5.下列反应中属于氧化还原反应的是
A.NH3+HCl=NH4Cl B.2Fe(OH)3Fe2O3+3H2O
C.3Fe+4H2O(g)Fe3O4+4H2↑ D.CaCO3+2HCl=CaCl2+H2O+CO2↑
6.下列说法不正确的是
A.过氧化钠可在呼吸面具或潜水艇中作为氧气的来源
B.漂白粉既可作漂白棉、麻、纸张的漂白剂,又可用作游泳池等场所的消毒剂
C.碳酸氢钠可用于治疗胃酸过多
D.金属钠具有较强的还原性,可与四氯化钛溶液反应置换出钛
7.下列关于漂白粉的叙述正确的是
A.漂白粉可用NaOH制得
B.漂白粉的有效成分是和
C.漂白粉是由与消石灰制得的纯净物
D.漂白粉暴露在空气中会变质失效
8.某同学在做实验时引发了镁失火,她立即拿起二氧化碳灭火器欲把火扑灭,却被实验老师及时制止。原因是CO2可以支持镁燃烧发生以下反应:2Mg+CO22MgO+C。下列关于该反应的判断正确的是
A.镁元素化合价由0价升高到+2价,所以MgO是还原剂
B.由此反应可以判断氧化性CO2>MgO,还原性Mg>C
C.CO2作氧化剂,表现氧化性,发生氧化反应
D.镁原子失去的电子数目等于氧原子得到的电子数目
9.有关氯元素,下列叙述正确的是
A.Cl2的化学性质活泼,与H2混合后会立即发生爆炸
B.光照下,新制氯水会产生气泡,该气体是Cl2
C.若发生Cl2泄漏,应立即向高处转移
D.漂白粉比HClO稳定,可露置在空气中长期保存
10.某溶液能溶解氢氧化铝,则在其中一定可以大量存在的离子组是
A.Na+、SO、Cl- B.K+、CO、NO
C.Mg2+、SO、Br- D.NH、NO、AlO
11.各物质中含有的少量杂质以及除去这些杂质对应的方法如表所示
物质 杂质 除去杂质的方法
① 溶液 加入适量溶液并过滤
② 溶液 加入过量铁粉并过滤
③ 先通过盛有溶液的洗气瓶,再通过盛有浓硫酸的洗气瓶
④ 溶解、过滤、蒸发
其中正确的是A.①②③④ B.④ C.②③④ D.①②③
12.下列离子方程式正确的是
A.Cl2通入水中:Cl2+H2O=2H++Cl-+ClO-
B.稀H2SO4与铁粉反应:2Fe+6H+=2Fe3++3H2↑
C.钠与水反应:Na+2H2O=Na++2OH-+H2↑
D.鸡蛋壳在盐酸中溶解:CaCO3+2H+=Ca2++H2O+CO2↑
13.某混合溶液中所含离子的浓度如表,则离子可能为
所含离子
个数
A. B. C. D.
二、非选择题(共10题)
14.在含有一定量NaHCO3和Na2CO3溶质的溶液中,逐滴滴入一定浓度的稀盐酸,产生CO2的物质的量与滴入盐酸的量的关系如图,回答下列问题:
(1)0~a点发生反应的离子方程式为____
(2)NaHCO3与Na2CO3物质的量之比为____。
(3)b=____(用含a的代数式表示)。
15.按要求填写下列内容:
(1)根据下列四种元素(O、H、Ca、C 、Na)写化学式:酸_______;碱_______;盐_______。(各写一种)
下列物质①Cu ②SO2 ③NaCl溶液 ④HCl ⑤BaSO4固体⑥NH3 ⑦酒精 ⑧硫酸溶液 ⑨NaOH 固体 ⑩冰水混合物
(2)其中属于电解质的有_______;
(3)属于非电解质的有_______;
(4)能导电的有_______;
(5)③和④能否发生离子反应_______(填“能”或“不能”),原因是_____;
(6)④和⑨反应的离子方程式:_________;
16.(ⅰ)把等物质的量的Cu、Fe粉投入到一定量的FeCl3溶液中充分反应,然后取出部分溶液。
(1)若滴加一滴KSCN溶液,溶液显红色,则溶液中存在的离子有____。
(2)若滴加一滴KSCN溶液,溶液不显红色,则溶液中一定存在的离子有____,可能存在的金属粉末有____。
(ⅱ)向500mLNaOH溶液中投入10.8gAl,二者恰好完全反应,试计算:
(3)Al的物质的量___。
(4)参加反应的NaOH的物质的量和溶液中溶质的物质的量浓度____、____。
(5)在标准状况下生成H2的体积____。
17.取2.3克的钠投入500mL水中,完全反应后问:
(1)生成的气体体积在标准状态下为多少升___
(2)形成的溶液的物质的量浓度为多少___?
18.已知某纯碱试样中含有NaCl杂质,为测定试样中NaCl的质量分数,可用下图中的装置进行实验。
主要实验步骤如下:
①按图组装仪器,并检验装置的气密性
②将8.0 g试样放入锥形瓶中,加适量蒸馏水溶解,得到试样溶液
③称量盛有碱石灰的U形管的质量,得到20.0g
④从分液漏斗滴入6mol·L-1的硫酸,直到不再产生气体时为止
⑤从导管A处缓缓鼓入一定量的空气
⑥再次称量盛有碱石灰的U形管的质量,得到22.0g
重复步骤⑤和⑥的操作,直到U形管的质量基本不变,为22.2g
请填空和回答问题:
(1)A中盛放NaOH的作用___________
(2)装置中干燥管B的作用___________。如果没有连接该干燥管,测试的结果___________(填偏高、偏低或不变)。
(3)如果将分液漏斗中的硫酸换成浓度相同的盐酸,测试的结果___________(填偏高、偏低或不变)。
(4)步骤⑤的目的是___________,如果没有进行步骤⑤的操作,测试的结果___________(填偏高、偏低或不变)。
(5)试样中NaCl的质量分数为___________。
19.TiCl4是制备金属钛的重要中间体。某小组同学利用如下装置在实验室制备TiCl4(夹持装置略去)。
已知:TiCl4易挥发,高温时能与O2反应,不与HCl反应,其他相关信息如下表所示:
熔点/℃ 沸点/℃ 密度/(g·cm-3) 水溶性
TiCl4 -24 136.4 1.7 易水解生成白色沉淀,能溶于有机溶剂
CC14 -23 76.8 1.6 难溶于水
回答下列问题:
(1)A装置仪器b的名称是_______,E装置中的试剂是_______。
(2)装置A中发生反应的离子方程式为_______。
(3)在通入Cl2前,先打开开关k,从侧管持续通入一段时间的CO2气体的目的是_______。
(4)装置C中除生成TiCl4外,还生成一种气态不成盐氧化物,该反应的化学方程式为_______。
(5)制得的TiCl4中常含有少量CCl4,从混合液中分离出TiCl4操作的名称是_______。
(6)利用如图装置测定所得TiCl4的纯度:取wg产品加入烧瓶,向安全漏斗中加入适量蒸馏水,待TiCl4充分反应后,将烧瓶和漏斗中的液体一并转入锥形瓶中,滴加几滴0.1mol·L-1K2CrO4溶液作指示剂,用cmol·L-1AgNO3标准溶液滴定至终点,消耗标准溶液VmL。已知:常温下,Ksp(AgCl)=1.8×10-10、Ksp(Ag2CrO4)=1.1×10-12,Ag2CrO4呈砖红色,TiCl4+(2+n)H2O=TiO2·nH2O↓+4HCl。
①安全漏斗在本实验中的作用除加水外,还有_______;
②滴定终点的判断方法是_______;
③产品的纯度为_______(用含w、c和V的代数式表示)。
20.实验室有一瓶密封不严的漂白粉样品,其中肯定含有,请设计实验探究该样品中可能存在的其他物质[已知可使品红溶液褪色]。
(1)提出合理假设。
假设①:该漂白粉未变质,含有___________;
假设②:该漂白粉全部变质,含有___________;
假设③:该漂白粉部分变质,既含有,又含有。
(2)设计实验方案,进行实验。
实验步骤 预期现象和结论
实验①:取少量上述漂白粉样品于试管中,加入适量稀盐酸,观察是否有气泡产生 a.若无气泡产生,则假设___________成立 b.___________
实验②:向实验①反应后的试管中滴人1~2滴品红溶液,振荡 c.若品红溶液褪色,结合实验①中的b判断,则假设___________成立 d.若品红溶液不褪色,结合b判断,则假设___________成立
21.高中化学课本必修一中出现的部分物质间的转化关系如下图所示(部分物质已省略。已知A→B是实验室制取氯气的主要方法之一,H的焰色试验呈黄色),请完成下列填空。
(1)E和H的化学式为:E___________;H___________。
(2)检验K溶液中阳离子的试剂是___________。若K中含有F的杂质,应加入___________(填化学式)除杂。
(3)I转化为J的化学方程式为___________。
(4)K的饱和溶液滴入沸水中,可得到胶体L。胶体L区别于K的饱和溶液最本质的特征是___________(填字母序号)。
A.胶体L的分散质粒子直径为 B.胶体L比K的饱和溶液颜色深
C.胶体L是均一的分散系 D.胶体L具有丁达尔效应
(5)当前,新冠病毒变异毒株奥密克戎来势汹汹,化学消毒剂在疫情防控中起着重要作用。
①目前,很多自来水厂用氯气来杀菌、消毒。A→B的离子反应方程式为___________。
②C可以杀菌、消毒,但不稳定,难以保存,原因是___________(用化学方程式表示)。
③将B通入G溶液中可得到一种漂白液,能杀菌、消毒,该漂白液的有效成分是___________。
④为国际公认的高效安全灭菌消毒剂之一、常温下,亚氯酸钠()固体与B反应可得到和NaCl,该反应中,氧化剂与还原剂的物质的量之比为___________。
22.下列图示中,A为一种常见的单质,B、C、D、E是含有A元素的常见化合物,B为淡黄色固体。
回答下列问题:
(1)写出化学式:A_____________,D_____________。
(2)写出基本反应类型:反应①_____________,反应②_____________。
(3)反应③的化学方程式为_______________________________________。
(4)向D溶液中通入,反应的化学方程式为_______________________________________。
23.2021年3月22日是第二十九届“世界水日”。为了深人开展珍惜水、爱护水的主题活动,推进水资源的集约安全利用,某校、化学兴趣小组的同学展开对我市某饮用水源水库水组成问题的研究,他们猜想该水库水中可能含有大量Cu2+、Ca2+、Mg2+和某些阴离子,从而进行了三组实验:
①取适量该水库水于试管中,滴加过量的NaOH溶液,产生白色沉淀;
②过滤后取滤液于试管中,滴加过量的Na2CO3溶液,又有白色沉淀生成:
③另取适量该水库水于试管中,滴加足量稀硝酸后再滴加AgNO3溶液,也产生白色沉淀。
请根据已有知识和反应事实回答以下问题:
(1)该小组有关大量存在___________ (填写离子符号)的猜想是错误的。
(2)通过实验可初步确定该水库水中___________(填“含有”或“不含有”)大量Ca+、Mg2+;判断依据的离子方程式有___________。
(3)该水库水中所含阴离子可以确定有___________,理由是___________。
(4)确定实验②中滴加的Na2CO3溶液已过量的检验方法是___________。
参考答案:
1.B 2.C 3.D 4.A 5.C 6.D 7.D 8.B 9.C 10.A 11.C 12.D 13.D
14.(1)CO+H+=HCO
(2)3∶2
(3)2.5a
15.(1) H2CO3 NaOH或Ca (OH)2 Na2CO3, CaCO3,NaHCO3,Ca(HCO3)2
(2)④⑤⑨⑩
(3)②⑥⑦
(4)①③⑧⑩
(5) 不能 原因是离子间发生复分解反应的条件是产物中有气体、沉淀或水生成,而③和④混合后不能满足这一条件
(6)H++OH-=H2O
16.(1)Cu2+、Fe2+、Fe3+、Cl-
(2) Fe2+、Cl- Fe、Cu或Cu
(3)0.4mol
(4) 0.4mol 0.8mol·L 1
(5)13.44L
17. 1.12L 0.2mol/L
18. 除去空气中的二氧化碳 防止空气中的CO2和水气进入U形管中 偏低 偏低 把反应产生的CO2全部导入U形管中 偏高 33.75%
19.(1) 蒸馏烧瓶 浓硫酸
(2)2MnO+16H++10Cl-=2Mn2++5Cl2↑+8H2O
(3)排除装置中的空气,防止TiCl4和O2反应
(4)TiO2+2C+2Cl2TiCl4+2CO
(5)蒸馏
(6) 液封,吸收挥发的HCl气体 当加入最后一滴AgNO3标准溶液时,溶液恰好出现砖红色沉淀,且半分钟不消失 或
20.(1)
(2) ① 若有气泡产生,则假设②或假设③成立 ③ ②
21.(1) Fe NaCl
(2) KSCN Cl2
(3)4Fe(OH)2+O2+2H2O=4Fe(OH)3
(4)A
(5) MnO2+4H++2Cl-Mn2++2H2O+Cl2↑ 2HClO2HCl+O2↑ NaClO 1:2
22. Na 化合反应 置换反应
23.(1)Cu2+
(2) 含有 Mg2++2OH-=Mg(OH)2↓,CO+Ca2+=CaCO3↓
(3) Cl- Cl-+Ag+=AgCl↓,AgCl不溶于稀硝酸
(4)取适量实验②反应后的上层清液于试管中,滴加足量盐酸,若产生无色气泡(或滴加CaCl2溶液,若产生白色沉淀),证明Na2CO3溶液已过量。
