黑龙江省东方红林业局高级中学人教版高中化学选修四导学案:4.1 原电池(无答案)
文档属性
| 名称 | 黑龙江省东方红林业局高级中学人教版高中化学选修四导学案:4.1 原电池(无答案) |  | |
| 格式 | zip | ||
| 文件大小 | 115.1KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(新课程标准) | ||
| 科目 | 化学 | ||
| 更新时间 | 2016-06-29 22:51:47 | ||
图片预览

文档简介
东方红林业局中学高中导学案
学
科
化学
年
级
高二
备课人
课
题
第四章
第一节
原电池
课时安排
一课时
审核人
徐晓梅
使用时间
2015、11、12
学
习目
标
1.理解原电池原理,能够正确书写电极反应方程式。2.理解原电池溶液中阴、阳离子的移动方向
教
学重
点难
点
重点:原电池的工作原理及形成条件难点:原电池电极方程式的书写
导
学
流
程
自主学习
【自主学习】1.原电池原理原电池是利用
反应原理将
转化为
的装置。2.原电池形成条件(1)两个活泼性不同的电极:相对活泼的金属作
,较不活泼的金属或非金属作
。(2)
溶液。(3)形成
回路。(4)能自发发生
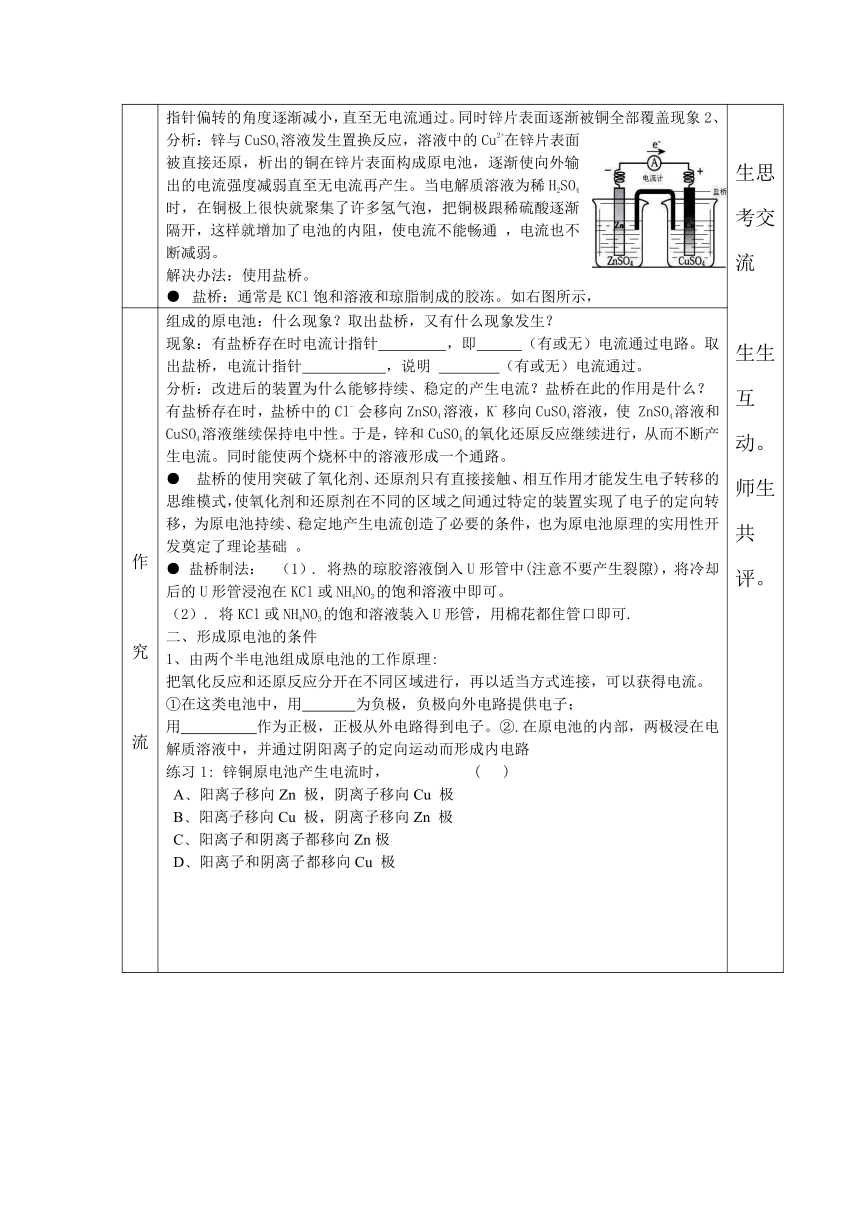
反应。2、如右图所示,组成的原电池:(1)当电解质溶液为稀H2SO4时:
Z
( http: / / www.21cnjy.com )n电极是____(填“正”或
“负”)极,其电极反应为_______________,该反应是______(填“氧化”或“还原”,下同)反应;
Cu电极是______极,其电极反应为______________
,该反应是
反应。「探究」:上图当电解质溶液为CuSO4溶液
( http: / / www.21cnjy.com )时:现象1:电流计的指针发生偏移,并指示电子是由锌片流向铜片,在铜片表面有红色的铜析出结论:发生了原电池反应,锌为原电池的负极,铜为正极。现象2:随着时间的延续,电流计指针偏转的角度逐渐减小,电流计
生自主完成
指针偏转的角度逐渐减小,直至无电流通过。同
( http: / / www.21cnjy.com )时锌片表面逐渐被铜全部覆盖现象2、
分析:锌与CuSO4溶液发生置换反应,溶液中的Cu2+在锌片表面被直接还原,析出的铜在锌片表面构成原电池,逐渐使向外输出的电流强度减弱直至无电流再产生。当电解质溶液为稀H2SO4时,在铜极上很快就聚集了许多氢气泡,把铜极跟稀硫酸逐渐隔开,这样就增加了电池的内阻,使电流不能畅通
,电流也不断减弱。解决办法:使用盐桥。盐桥:通常是KCl饱和溶液和琼脂制成的胶冻。如右图所示,
生思考交流生生互动。师生共评。
合作探究交流
组成的原电池:什么现象?取出盐桥,又有什么现象发生?现象:有盐桥存在时电流计指
( http: / / www.21cnjy.com )针
,即
(有或无)电流通过电路。取出盐桥,电流计指针
,说明
(有或无)电流通过。分析:改进后的装置为什么能够持续、稳定的产生电流?盐桥在此的作用是什么?有盐桥存在时,盐桥中的Cl-
会移向ZnSO4溶液,K+
移向CuSO4溶液,使
ZnSO4溶液和CuSO4溶液继续保持电中性。于是,锌和CuSO4的氧化还原反应继续进行,从而不断产生电流。同时能使两个烧杯中的溶液形成一个通路。●
盐桥的使用突破了氧化剂、还原剂只有直接接触、相互作用才能发生电子转移的思维模式,使氧化剂和还原剂在不同的区域之间通过特定的装置实现了电子的定向转移,为原电池持续、稳定地产生电流创造了必要的条件,也为原电池原理的实用性开发奠定了理论基础
。●
盐桥制法:
(1).
将热的琼胶溶液倒入U形管中(注意不要产生裂隙),将冷却后的U形管浸泡在KCl或NH4NO3的饱和溶液中即可。(2).
将KCl或NH4NO3的饱和溶液装入U形管,用棉花都住管口即可.二、形成原电池的条件1、由两个半电池组成原电池的工作原理:把氧化反应和还原反应分开在不同区域进行,再以适当方式连接,可以获得电流。①在这类电池中,用
为负极,负极向外电路提供电子;用
作为正极,正极从外电路得到电子。②.在原电池的内部,两极浸在电解质溶液中,并通过阴阳离子的定向运动而形成内电路练习1:
锌铜原电池产生电流时,
(
)
A、阳离子移向Zn
极,阴离子移向Cu
极
B、阳离子移向Cu
极,阴离子移向Zn
极C、阳离子和阴离子都移向Zn极
D、阳离子和阴离子都移向Cu
极
巩固
2、探究组成原电池的条件:
判断下列哪几个装置能形成原电池?
( http: / / www.21cnjy.com )练习②一个电池反应的离子方程式是
Zn+Cu2+=Zn2+
+Cu,
该反应的的原电池正确组合是
(
)ABCD正
极ZnCuCuFe负
极CuZnZnZn电解质溶液CuCl2H2SO4CuSO4HCl
【基础达标】1.关于原电池的叙述中正确的是( )A.构成原电池的两极必须是两种不同金属B.原电池是将化学能转化为电能的装置C.原电池工作时总是负极溶解,正极上有物质析出D.原电池的正极是还原剂,总是溶液中的阳离子在此被还原2.下列反应可用于设计原电池的是( )A.H2SO4+2NaOH===Na2SO4+2H2OB.2FeCl3+Fe===3FeCl2C.Mg3N2+6H2O===3Mg(OH)2↓+2NH3↑D.NaCl+AgNO3===NaNO3+AgCl↓3.有关原电池的下列说法中正确的是( )A.在外电路中电子由正极流向负极B.在原电池中,只有金属锌作为负极C.原电池工作时,阳离子向正极方向移动D.原电池工作时,阳离子向负极方向移动4.以Mg片和Al片为电极并用导线连接,同时插入NaOH溶液中,下列说法正确的是( )A.Mg片作负极,电极反应:Mg-2e-===Mg2+B.Al片作负极,电极反应:Al+4OH--3e-===AlO+2H2OC.电子从Mg电极沿导线流向Al电极D.Al片上有气泡产生作业:1.如图所示的装置,在铁圈和银圈的焊接处,用一根棉线将其悬吊在盛水的烧杯中,使之平衡。小心地向烧杯中央滴入CuSO4溶液,片刻后可观察到的现象是( )A.铁圈和银圈左右摇摆不定
B.保持平衡状况C.铁圈向下倾斜
D.银圈向下倾斜2.在如图所示的装置中,a的金属活泼性比氢要强,b为碳棒,关于此装置的各种叙述不正确的是( )A.碳棒上有气体放出,溶液pH变大B.a是正极,b是负极C.导线中有电子流动,电子从a极流向b极D.a极上发生了氧化反应3.下列四组原电池,其中放电后,电解质溶液质量增加,且在正极有单质生成的是( )A.Cu、Ag、AgNO3溶液B.Zn、Cu、稀H2SO4C.Fe、Zn、ZnSO4溶液D.
Fe、C、Fe2(SO4)3溶液
【疑点反馈】:(通过本课学习、作业后你还有哪些没有搞懂的知识,请记录下来
Zn
Cu
×
学
科
化学
年
级
高二
备课人
课
题
第四章
第一节
原电池
课时安排
一课时
审核人
徐晓梅
使用时间
2015、11、12
学
习目
标
1.理解原电池原理,能够正确书写电极反应方程式。2.理解原电池溶液中阴、阳离子的移动方向
教
学重
点难
点
重点:原电池的工作原理及形成条件难点:原电池电极方程式的书写
导
学
流
程
自主学习
【自主学习】1.原电池原理原电池是利用
反应原理将
转化为
的装置。2.原电池形成条件(1)两个活泼性不同的电极:相对活泼的金属作
,较不活泼的金属或非金属作
。(2)
溶液。(3)形成
回路。(4)能自发发生
反应。2、如右图所示,组成的原电池:(1)当电解质溶液为稀H2SO4时:
Z
( http: / / www.21cnjy.com )n电极是____(填“正”或
“负”)极,其电极反应为_______________,该反应是______(填“氧化”或“还原”,下同)反应;
Cu电极是______极,其电极反应为______________
,该反应是
反应。「探究」:上图当电解质溶液为CuSO4溶液
( http: / / www.21cnjy.com )时:现象1:电流计的指针发生偏移,并指示电子是由锌片流向铜片,在铜片表面有红色的铜析出结论:发生了原电池反应,锌为原电池的负极,铜为正极。现象2:随着时间的延续,电流计指针偏转的角度逐渐减小,电流计
生自主完成
指针偏转的角度逐渐减小,直至无电流通过。同
( http: / / www.21cnjy.com )时锌片表面逐渐被铜全部覆盖现象2、
分析:锌与CuSO4溶液发生置换反应,溶液中的Cu2+在锌片表面被直接还原,析出的铜在锌片表面构成原电池,逐渐使向外输出的电流强度减弱直至无电流再产生。当电解质溶液为稀H2SO4时,在铜极上很快就聚集了许多氢气泡,把铜极跟稀硫酸逐渐隔开,这样就增加了电池的内阻,使电流不能畅通
,电流也不断减弱。解决办法:使用盐桥。盐桥:通常是KCl饱和溶液和琼脂制成的胶冻。如右图所示,
生思考交流生生互动。师生共评。
合作探究交流
组成的原电池:什么现象?取出盐桥,又有什么现象发生?现象:有盐桥存在时电流计指
( http: / / www.21cnjy.com )针
,即
(有或无)电流通过电路。取出盐桥,电流计指针
,说明
(有或无)电流通过。分析:改进后的装置为什么能够持续、稳定的产生电流?盐桥在此的作用是什么?有盐桥存在时,盐桥中的Cl-
会移向ZnSO4溶液,K+
移向CuSO4溶液,使
ZnSO4溶液和CuSO4溶液继续保持电中性。于是,锌和CuSO4的氧化还原反应继续进行,从而不断产生电流。同时能使两个烧杯中的溶液形成一个通路。●
盐桥的使用突破了氧化剂、还原剂只有直接接触、相互作用才能发生电子转移的思维模式,使氧化剂和还原剂在不同的区域之间通过特定的装置实现了电子的定向转移,为原电池持续、稳定地产生电流创造了必要的条件,也为原电池原理的实用性开发奠定了理论基础
。●
盐桥制法:
(1).
将热的琼胶溶液倒入U形管中(注意不要产生裂隙),将冷却后的U形管浸泡在KCl或NH4NO3的饱和溶液中即可。(2).
将KCl或NH4NO3的饱和溶液装入U形管,用棉花都住管口即可.二、形成原电池的条件1、由两个半电池组成原电池的工作原理:把氧化反应和还原反应分开在不同区域进行,再以适当方式连接,可以获得电流。①在这类电池中,用
为负极,负极向外电路提供电子;用
作为正极,正极从外电路得到电子。②.在原电池的内部,两极浸在电解质溶液中,并通过阴阳离子的定向运动而形成内电路练习1:
锌铜原电池产生电流时,
(
)
A、阳离子移向Zn
极,阴离子移向Cu
极
B、阳离子移向Cu
极,阴离子移向Zn
极C、阳离子和阴离子都移向Zn极
D、阳离子和阴离子都移向Cu
极
巩固
2、探究组成原电池的条件:
判断下列哪几个装置能形成原电池?
( http: / / www.21cnjy.com )练习②一个电池反应的离子方程式是
Zn+Cu2+=Zn2+
+Cu,
该反应的的原电池正确组合是
(
)ABCD正
极ZnCuCuFe负
极CuZnZnZn电解质溶液CuCl2H2SO4CuSO4HCl
【基础达标】1.关于原电池的叙述中正确的是( )A.构成原电池的两极必须是两种不同金属B.原电池是将化学能转化为电能的装置C.原电池工作时总是负极溶解,正极上有物质析出D.原电池的正极是还原剂,总是溶液中的阳离子在此被还原2.下列反应可用于设计原电池的是( )A.H2SO4+2NaOH===Na2SO4+2H2OB.2FeCl3+Fe===3FeCl2C.Mg3N2+6H2O===3Mg(OH)2↓+2NH3↑D.NaCl+AgNO3===NaNO3+AgCl↓3.有关原电池的下列说法中正确的是( )A.在外电路中电子由正极流向负极B.在原电池中,只有金属锌作为负极C.原电池工作时,阳离子向正极方向移动D.原电池工作时,阳离子向负极方向移动4.以Mg片和Al片为电极并用导线连接,同时插入NaOH溶液中,下列说法正确的是( )A.Mg片作负极,电极反应:Mg-2e-===Mg2+B.Al片作负极,电极反应:Al+4OH--3e-===AlO+2H2OC.电子从Mg电极沿导线流向Al电极D.Al片上有气泡产生作业:1.如图所示的装置,在铁圈和银圈的焊接处,用一根棉线将其悬吊在盛水的烧杯中,使之平衡。小心地向烧杯中央滴入CuSO4溶液,片刻后可观察到的现象是( )A.铁圈和银圈左右摇摆不定
B.保持平衡状况C.铁圈向下倾斜
D.银圈向下倾斜2.在如图所示的装置中,a的金属活泼性比氢要强,b为碳棒,关于此装置的各种叙述不正确的是( )A.碳棒上有气体放出,溶液pH变大B.a是正极,b是负极C.导线中有电子流动,电子从a极流向b极D.a极上发生了氧化反应3.下列四组原电池,其中放电后,电解质溶液质量增加,且在正极有单质生成的是( )A.Cu、Ag、AgNO3溶液B.Zn、Cu、稀H2SO4C.Fe、Zn、ZnSO4溶液D.
Fe、C、Fe2(SO4)3溶液
【疑点反馈】:(通过本课学习、作业后你还有哪些没有搞懂的知识,请记录下来
Zn
Cu
×
