2025年内蒙古锡林郭勒盟三县联考九年级下学期中考第四次模拟考试化学试卷(含答案)
文档属性
| 名称 | 2025年内蒙古锡林郭勒盟三县联考九年级下学期中考第四次模拟考试化学试卷(含答案) |  | |
| 格式 | docx | ||
| 文件大小 | 521.2KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 通用版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2025-06-28 19:26:57 | ||
图片预览



文档简介
保密★启用前
2024-2025学年度锡林郭勒盟三县联考
九年级化学第四次模拟考试卷
考试分数:40分;考试时间:40分钟
注意事项:
1.答题前填写好自己的姓名、班级、考号等信息
2.请将答案正确填写在答题卡上
第I卷(选择题)
一、选择题(本题共6小题,每题2分,共12分)
1.下列图像能正确反映对应的实验操作的是( )
A.向一定量的浓盐酸中加水
B.高温条件下,向一定量的氧化铁中通入一氧化碳
C.向一定量的碳酸钠和氢氧化钠的混合溶液中逐滴加入稀盐酸
D.向相同质量、相同溶质质量分数的稀硫酸中分别加入锌粉和铁粉至过量
2.汽车尾气催化处理装置可将尾气中的有毒气体进行转化,发生主要反应的微观示意图如图。有关说法正确的是( )
A.该反应为置换反应 B.反应前后,原子和分子数目均不变
C.反应前后元素的化合价均改变 D.反应产物均不属于空气污染物
3.化学实验是获取知识及解决化学问题的最重要的手段,分析下列实验得出的结论,其中合理的是( )
A.蜡烛由低到高熄灭,说明通常状况下CO2不能燃烧不支持燃烧,密度小于空气
B.甲试管中铁钉生锈,乙试管中铁钉不生锈,说明只需与水接触铁钉就会生锈
C.丁实验只能说明一氧化碳具有还原性
D.甲实验既能探究空气中氧气含量,又能说明氮气不易溶于水也不支持燃烧
4.科学家利用光催化技术实现了绿色制取H2O2,反应的微观示意图如图所示。下列说法正确的是
反应后氧原子个数减少
1molH2O2含6.02×1023个氧分子
乙的化学式为H2O
参加反应的甲、乙分子个数比为2:3
5.化学与生产、生活和社会发展密切相关。下列有关说法正确的是( )
A.铝制品比铁制品耐腐蚀,是因为金属铝比金属铁活泼
B.洗洁精和汽油都可以除油污,是因为它们都有乳化作用
C.氮气可用于填充食品包装袋,是因为氮气的化学性质不活泼
D.氢氧化钠、氢氧化钙化学性质相似,是因为其溶液中都含有金属离子
6.将一定质量的水煤气(CO和的混合物)在氧气中充分燃烧,燃烧产物依次通过足量的浓硫酸和NaOH溶液,浓硫酸增重0.9g,NaOH溶液增重2.2g。该水煤气中CO和的质量比为( )
A.7:1 B.14:1 C.28:1 D.56:1
第II卷(非选择题)
二、实验题(共1小题,共5分)
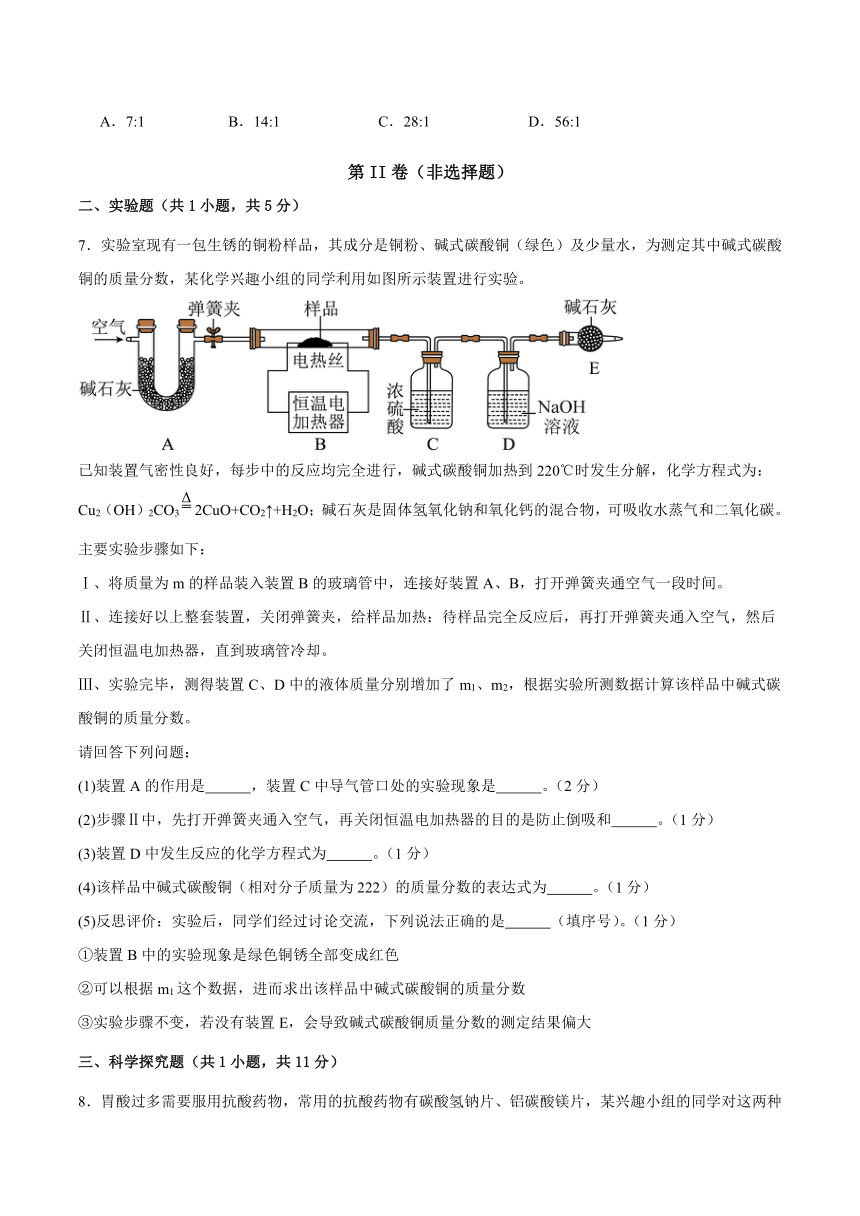
7.实验室现有一包生锈的铜粉样品,其成分是铜粉、碱式碳酸铜(绿色)及少量水,为测定其中碱式碳酸铜的质量分数,某化学兴趣小组的同学利用如图所示装置进行实验。
已知装置气密性良好,每步中的反应均完全进行,碱式碳酸铜加热到220℃时发生分解,化学方程式为:Cu2(OH)2CO32CuO+CO2↑+H2O;碱石灰是固体氢氧化钠和氧化钙的混合物,可吸收水蒸气和二氧化碳。
主要实验步骤如下:
Ⅰ、将质量为m的样品装入装置B的玻璃管中,连接好装置A、B,打开弹簧夹通空气一段时间。
Ⅱ、连接好以上整套装置,关闭弹簧夹,给样品加热:待样品完全反应后,再打开弹簧夹通入空气,然后关闭恒温电加热器,直到玻璃管冷却。
Ⅲ、实验完毕,测得装置C、D中的液体质量分别增加了m1、m2,根据实验所测数据计算该样品中碱式碳酸铜的质量分数。
请回答下列问题:
(1)装置A的作用是 ,装置C中导气管口处的实验现象是 。(2分)
(2)步骤Ⅱ中,先打开弹簧夹通入空气,再关闭恒温电加热器的目的是防止倒吸和 。(1分)
(3)装置D中发生反应的化学方程式为 。(1分)
(4)该样品中碱式碳酸铜(相对分子质量为222)的质量分数的表达式为 。(1分)
(5)反思评价:实验后,同学们经过讨论交流,下列说法正确的是 (填序号)。(1分)
①装置B中的实验现象是绿色铜锈全部变成红色
②可以根据m1这个数据,进而求出该样品中碱式碳酸铜的质量分数
③实验步骤不变,若没有装置E,会导致碱式碳酸铜质量分数的测定结果偏大
三、科学探究题(共1小题,共11分)
8.胃酸过多需要服用抗酸药物,常用的抗酸药物有碳酸氢钠片、铝碳酸镁片,某兴趣小组的同学对这两种药物进行了探究。
【查阅资料】铝碳酸镁片的有效成分的化学式为Al2Mg6(OH)16CO3 4H2O,几乎不溶于水。
活动一:定性探究抗酸药物与“胃酸”的反应。
(1)胃液的pH (填“>”、“<”或“=”)7,抗酸药中的离子可以与其中的氢离子发生反应,从而降低胃液酸性。铝碳酸镁片中含有铝离子、镁离子、氢氧根离子和碳酸根离子,其中起抗酸作用的微观粒子是 (填粒子符号)。(2分)
(2)小海取一定量碳酸氢钠片与4mL稀盐酸(模拟胃酸)反应(药片中的其他成分不溶于水也不参加反应),请写出该反应的化学方程式 。(2分)
他们对反应后溶液中溶质的成分产生了兴趣并做如下实验探究。
(3)猜想1:只含有NaCl;猜想2:含有NaCl、HCl;猜想3:含有 。(2分)
【实验探究】
实验步骤 实验现象 实验结论
实验一 取一定量反应后的溶液于试管中, 无明显现象 猜想2不成立
实验二 另取一定量反应后的溶液于试管中,滴加 猜想3成立
(4)请完善下面表格:(3分)
活动二:定量探究抗酸药物与“胃酸”的反应,对比分析产生CO2的速率快慢和抗酸能力强弱,从而评价两种抗酸药物的适用情况。
如图1,利用数字化实验分别测定等质量碳酸氢钠片、铝碳酸镁片与“胃酸”反应时,产生CO2的速率快慢和pH的变化,得到“二氧化碳体积分数与时间”关系曲线(如图2)、“pH与时间”关系曲线(如图3)。请结合图示分析并回答问题:
(5)患有胃溃疡的病人不易过多服用哪种药物?并说明理由: 。(2分)
四、综合应用题(共1小题,共6分)
9.鼻炎是一种常见的疾病,通过洗鼻器向鼻腔内喷入洗鼻液(质量分数0.9%的NaCl溶液),能明显清洁鼻腔,保持鼻腔湿润,有效缓解患者的症状。
【精制粗盐】经初步提纯后的粗盐中含有杂质,设计如下方案精制提纯(下图)
(1)操作Ⅰ、Ⅱ中都用到的玻璃仪器有 和烧杯。(1分)
(2)通过操作Ⅱ得到溶液A,溶液A中含有杂质碳酸钠,写出加入稀盐酸后反应的化学方程式 。(1分)
【配制洗鼻液】
(3)现要配制1500g0.9%的洗鼻液。图是配制洗鼻液的实验操作示意图。需要称量NaCl的质量是 g,如图装置正确的操作顺序是:丁→ (填“甲乙”或“乙甲”)→丙;图中存在一处明显错误,该错误会导致所配得溶液中溶质质量分数 (填“>”或“<”)0.9%。(3分)
【拓展延伸】氯化钠是必不可少的生活用品,氯化钠的溶解度如下表所示。
温度/℃ 0 20 40 60 80
溶解度/g 35.7 36.0 36.6 37.3 38.4
(4)20℃时,某兴趣小组同学分别按照表中图方法配制甲、乙两份氯化钠溶液。溶液中溶质质量分数:甲 乙(填“>”“=”或“<”)。(1分)
五、计算题(共1小题,共6分)
10.氧化亚铜(Cu2O)可用于船底防污漆,防止海洋生物对船舶设备的污损。现将Cu2O 和Cu的固体混合物20g放入烧杯中,加入质量分数为9.8%的稀硫酸100g,恰好完全反应后,过滤、洗涤、干燥,得到mg固体。已知:
计算:
(1)配制上述实验所用的稀硫酸,需要质量分数为98%的浓硫酸的质量为 g;
(2)m= g;
(3)求恰好完全反应时,溶液中溶质质量分数(写出计算过程,结果精确到0.1%)。
参考答案
题号 1 2 3 4 5 6
答案 D D D C C B
7.(1) 吸收空气中的水分和二氧化碳 冒气泡
(2)排尽装置内残留的气体
(3)Ca(OH)2+CO2=CaCO3↓+H2O
(4)
(5)③
8.(1) < 、
(2)
(3)NaCl、NaHCO3
(4) 加入锌粒(或铁等活泼金属,合理即可) 稀盐酸(合理即可) 产生气泡(与所用试剂对应)
(5)患有胃溃疡的病人不易过多服用碳酸氢钠片。理由是碳酸氢钠与胃酸反应会产生较多二氧化碳气体,可能会加重胃溃疡病情
9.(1)玻璃棒
(2)
(3) 13.5 乙甲 <
(4)=
10.(1)16
(2)12
(3)解:设恰好完全反应时,溶液中溶质质量为x。
答:恰好完全反应时,溶液中溶质质量分数为14.8%。
【详解】(1)稀释前后溶质质量不变,稀释后溶质质量为,属于需要质量分数为98%的浓硫酸的质量为。
(2)设:反应后生成铜的质量为x,参加反应的氧化亚铜质量为y。
m=6.4g+(20g-14.4g)=12g
(3)详解见答案。
2024-2025学年度锡林郭勒盟三县联考
九年级化学第四次模拟考试卷
考试分数:40分;考试时间:40分钟
注意事项:
1.答题前填写好自己的姓名、班级、考号等信息
2.请将答案正确填写在答题卡上
第I卷(选择题)
一、选择题(本题共6小题,每题2分,共12分)
1.下列图像能正确反映对应的实验操作的是( )
A.向一定量的浓盐酸中加水
B.高温条件下,向一定量的氧化铁中通入一氧化碳
C.向一定量的碳酸钠和氢氧化钠的混合溶液中逐滴加入稀盐酸
D.向相同质量、相同溶质质量分数的稀硫酸中分别加入锌粉和铁粉至过量
2.汽车尾气催化处理装置可将尾气中的有毒气体进行转化,发生主要反应的微观示意图如图。有关说法正确的是( )
A.该反应为置换反应 B.反应前后,原子和分子数目均不变
C.反应前后元素的化合价均改变 D.反应产物均不属于空气污染物
3.化学实验是获取知识及解决化学问题的最重要的手段,分析下列实验得出的结论,其中合理的是( )
A.蜡烛由低到高熄灭,说明通常状况下CO2不能燃烧不支持燃烧,密度小于空气
B.甲试管中铁钉生锈,乙试管中铁钉不生锈,说明只需与水接触铁钉就会生锈
C.丁实验只能说明一氧化碳具有还原性
D.甲实验既能探究空气中氧气含量,又能说明氮气不易溶于水也不支持燃烧
4.科学家利用光催化技术实现了绿色制取H2O2,反应的微观示意图如图所示。下列说法正确的是
反应后氧原子个数减少
1molH2O2含6.02×1023个氧分子
乙的化学式为H2O
参加反应的甲、乙分子个数比为2:3
5.化学与生产、生活和社会发展密切相关。下列有关说法正确的是( )
A.铝制品比铁制品耐腐蚀,是因为金属铝比金属铁活泼
B.洗洁精和汽油都可以除油污,是因为它们都有乳化作用
C.氮气可用于填充食品包装袋,是因为氮气的化学性质不活泼
D.氢氧化钠、氢氧化钙化学性质相似,是因为其溶液中都含有金属离子
6.将一定质量的水煤气(CO和的混合物)在氧气中充分燃烧,燃烧产物依次通过足量的浓硫酸和NaOH溶液,浓硫酸增重0.9g,NaOH溶液增重2.2g。该水煤气中CO和的质量比为( )
A.7:1 B.14:1 C.28:1 D.56:1
第II卷(非选择题)
二、实验题(共1小题,共5分)
7.实验室现有一包生锈的铜粉样品,其成分是铜粉、碱式碳酸铜(绿色)及少量水,为测定其中碱式碳酸铜的质量分数,某化学兴趣小组的同学利用如图所示装置进行实验。
已知装置气密性良好,每步中的反应均完全进行,碱式碳酸铜加热到220℃时发生分解,化学方程式为:Cu2(OH)2CO32CuO+CO2↑+H2O;碱石灰是固体氢氧化钠和氧化钙的混合物,可吸收水蒸气和二氧化碳。
主要实验步骤如下:
Ⅰ、将质量为m的样品装入装置B的玻璃管中,连接好装置A、B,打开弹簧夹通空气一段时间。
Ⅱ、连接好以上整套装置,关闭弹簧夹,给样品加热:待样品完全反应后,再打开弹簧夹通入空气,然后关闭恒温电加热器,直到玻璃管冷却。
Ⅲ、实验完毕,测得装置C、D中的液体质量分别增加了m1、m2,根据实验所测数据计算该样品中碱式碳酸铜的质量分数。
请回答下列问题:
(1)装置A的作用是 ,装置C中导气管口处的实验现象是 。(2分)
(2)步骤Ⅱ中,先打开弹簧夹通入空气,再关闭恒温电加热器的目的是防止倒吸和 。(1分)
(3)装置D中发生反应的化学方程式为 。(1分)
(4)该样品中碱式碳酸铜(相对分子质量为222)的质量分数的表达式为 。(1分)
(5)反思评价:实验后,同学们经过讨论交流,下列说法正确的是 (填序号)。(1分)
①装置B中的实验现象是绿色铜锈全部变成红色
②可以根据m1这个数据,进而求出该样品中碱式碳酸铜的质量分数
③实验步骤不变,若没有装置E,会导致碱式碳酸铜质量分数的测定结果偏大
三、科学探究题(共1小题,共11分)
8.胃酸过多需要服用抗酸药物,常用的抗酸药物有碳酸氢钠片、铝碳酸镁片,某兴趣小组的同学对这两种药物进行了探究。
【查阅资料】铝碳酸镁片的有效成分的化学式为Al2Mg6(OH)16CO3 4H2O,几乎不溶于水。
活动一:定性探究抗酸药物与“胃酸”的反应。
(1)胃液的pH (填“>”、“<”或“=”)7,抗酸药中的离子可以与其中的氢离子发生反应,从而降低胃液酸性。铝碳酸镁片中含有铝离子、镁离子、氢氧根离子和碳酸根离子,其中起抗酸作用的微观粒子是 (填粒子符号)。(2分)
(2)小海取一定量碳酸氢钠片与4mL稀盐酸(模拟胃酸)反应(药片中的其他成分不溶于水也不参加反应),请写出该反应的化学方程式 。(2分)
他们对反应后溶液中溶质的成分产生了兴趣并做如下实验探究。
(3)猜想1:只含有NaCl;猜想2:含有NaCl、HCl;猜想3:含有 。(2分)
【实验探究】
实验步骤 实验现象 实验结论
实验一 取一定量反应后的溶液于试管中, 无明显现象 猜想2不成立
实验二 另取一定量反应后的溶液于试管中,滴加 猜想3成立
(4)请完善下面表格:(3分)
活动二:定量探究抗酸药物与“胃酸”的反应,对比分析产生CO2的速率快慢和抗酸能力强弱,从而评价两种抗酸药物的适用情况。
如图1,利用数字化实验分别测定等质量碳酸氢钠片、铝碳酸镁片与“胃酸”反应时,产生CO2的速率快慢和pH的变化,得到“二氧化碳体积分数与时间”关系曲线(如图2)、“pH与时间”关系曲线(如图3)。请结合图示分析并回答问题:
(5)患有胃溃疡的病人不易过多服用哪种药物?并说明理由: 。(2分)
四、综合应用题(共1小题,共6分)
9.鼻炎是一种常见的疾病,通过洗鼻器向鼻腔内喷入洗鼻液(质量分数0.9%的NaCl溶液),能明显清洁鼻腔,保持鼻腔湿润,有效缓解患者的症状。
【精制粗盐】经初步提纯后的粗盐中含有杂质,设计如下方案精制提纯(下图)
(1)操作Ⅰ、Ⅱ中都用到的玻璃仪器有 和烧杯。(1分)
(2)通过操作Ⅱ得到溶液A,溶液A中含有杂质碳酸钠,写出加入稀盐酸后反应的化学方程式 。(1分)
【配制洗鼻液】
(3)现要配制1500g0.9%的洗鼻液。图是配制洗鼻液的实验操作示意图。需要称量NaCl的质量是 g,如图装置正确的操作顺序是:丁→ (填“甲乙”或“乙甲”)→丙;图中存在一处明显错误,该错误会导致所配得溶液中溶质质量分数 (填“>”或“<”)0.9%。(3分)
【拓展延伸】氯化钠是必不可少的生活用品,氯化钠的溶解度如下表所示。
温度/℃ 0 20 40 60 80
溶解度/g 35.7 36.0 36.6 37.3 38.4
(4)20℃时,某兴趣小组同学分别按照表中图方法配制甲、乙两份氯化钠溶液。溶液中溶质质量分数:甲 乙(填“>”“=”或“<”)。(1分)
五、计算题(共1小题,共6分)
10.氧化亚铜(Cu2O)可用于船底防污漆,防止海洋生物对船舶设备的污损。现将Cu2O 和Cu的固体混合物20g放入烧杯中,加入质量分数为9.8%的稀硫酸100g,恰好完全反应后,过滤、洗涤、干燥,得到mg固体。已知:
计算:
(1)配制上述实验所用的稀硫酸,需要质量分数为98%的浓硫酸的质量为 g;
(2)m= g;
(3)求恰好完全反应时,溶液中溶质质量分数(写出计算过程,结果精确到0.1%)。
参考答案
题号 1 2 3 4 5 6
答案 D D D C C B
7.(1) 吸收空气中的水分和二氧化碳 冒气泡
(2)排尽装置内残留的气体
(3)Ca(OH)2+CO2=CaCO3↓+H2O
(4)
(5)③
8.(1) < 、
(2)
(3)NaCl、NaHCO3
(4) 加入锌粒(或铁等活泼金属,合理即可) 稀盐酸(合理即可) 产生气泡(与所用试剂对应)
(5)患有胃溃疡的病人不易过多服用碳酸氢钠片。理由是碳酸氢钠与胃酸反应会产生较多二氧化碳气体,可能会加重胃溃疡病情
9.(1)玻璃棒
(2)
(3) 13.5 乙甲 <
(4)=
10.(1)16
(2)12
(3)解:设恰好完全反应时,溶液中溶质质量为x。
答:恰好完全反应时,溶液中溶质质量分数为14.8%。
【详解】(1)稀释前后溶质质量不变,稀释后溶质质量为,属于需要质量分数为98%的浓硫酸的质量为。
(2)设:反应后生成铜的质量为x,参加反应的氧化亚铜质量为y。
m=6.4g+(20g-14.4g)=12g
(3)详解见答案。
同课章节目录
