3.1.3 氯气的性质及应用(2) 课后练(含解析)高中化学 必修1(苏教版2019)
文档属性
| 名称 | 3.1.3 氯气的性质及应用(2) 课后练(含解析)高中化学 必修1(苏教版2019) |
|
|
| 格式 | doc | ||
| 文件大小 | 267.0KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 苏教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2025-06-28 10:37:32 | ||
图片预览



文档简介
第3课时 氯气的性质及应用(2)
【夯实基础】
1. (2024南通期中)1774年,瑞典化学家舍勒将软锰矿(主要成分是MnO2)与浓盐酸混合加热时,制得了Cl2。下列制备、收集Cl2及检验氯水性质的原理或装置正确的是( )
A. 制取Cl2 B. 除去Cl2中的HCl
C. 收集Cl2 D. 测新制氯水的pH
2. (2024淮安期中)在给定条件下,下列选项所示的物质间转化均能实现的是( )
A. H2OH2 B. 稀盐酸Cl2
C. HClOCl2 D. CuOCu(OH)2
3. (2024南通西藏民族中学阶段测试)下列关于漂白粉的叙述正确的是( )
A. 漂白粉可用NaOH制得
B. 漂白粉的有效成分是Ca(ClO)2
C. 漂白粉是由Cl2与消石灰制得的纯净物
D. 漂白粉暴露在空气中不会变质失效
4. (2024南通中学月考)下列关于Cl2的说法正确的是( )
A. Cl2具有很强的氧化性,在化学反应中只能作氧化剂
B. H2在Cl2中燃烧,瓶口出现白雾
C. Cl2具有漂白性,可用于漂白纸浆
D. Fe在 Cl2中的燃烧产物用数轴表示如下:
5. (2024南通通州期末)用强光照射密闭细口瓶中的新制氯水,使用传感器测得的某数据随时间的变化如图所示。该数据可能是( )
A. 氯水的pH
B. 溶液中Cl-的浓度
C. 瓶中氧气的体积分数
D. 溶液的导电能力
6. (1) 如下图所示,将氯气依次通过盛有干燥有色布条的广口瓶和盛有湿润有色布条的广口瓶,可观察到的现象是_______________________________________________________________________。
(2) 实验室要在通风橱内制备氯气,并且为了防止氯气污染空气,要有尾气处理装置,一般用 溶液吸收多余的氯气,原理是 (用化学方程式表示)。
(3) 根据这一原理,工业上常用廉价的石灰乳吸收工业氯气尾气制得漂白粉,反应的化学方程式是____________________________________________________
___________________________________________________________。
【提升素养】
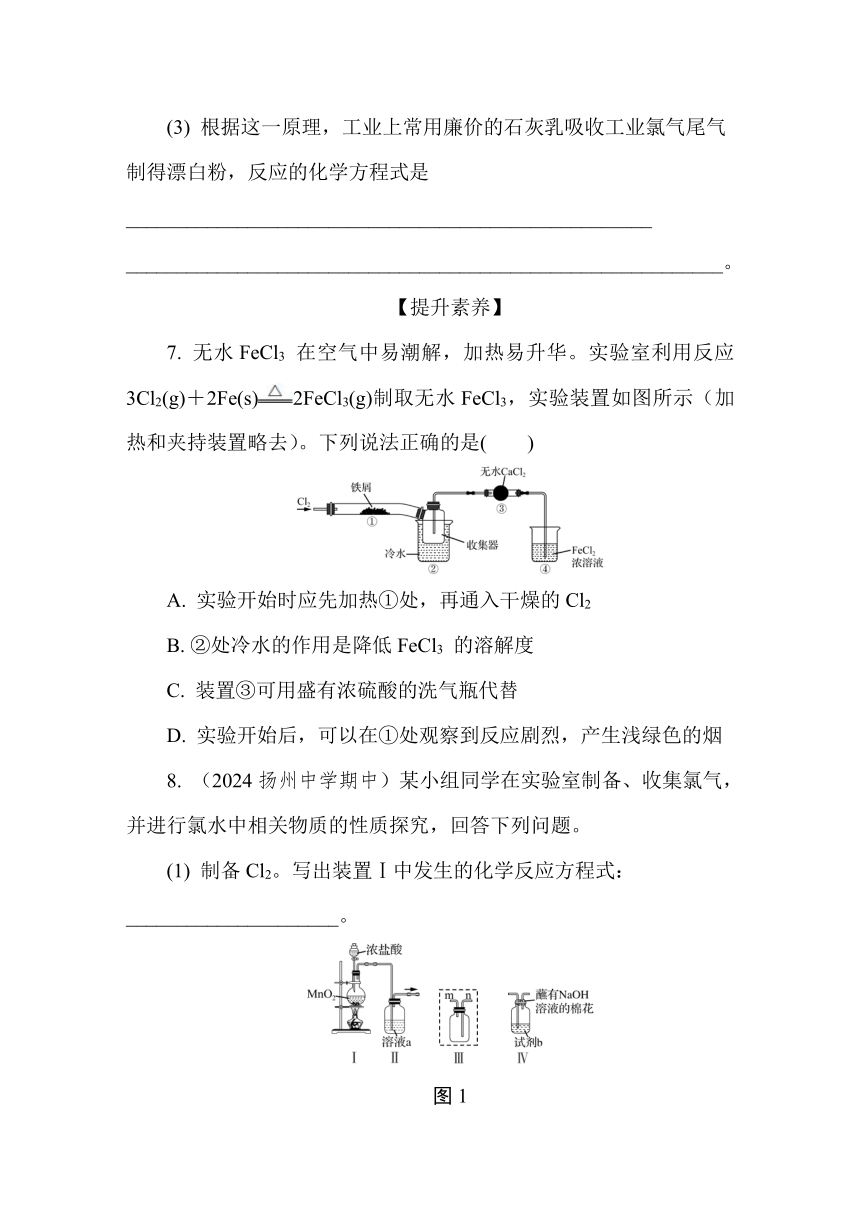
7. 无水FeCl3 在空气中易潮解,加热易升华。实验室利用反应3Cl2(g)+2Fe(s)2FeCl3(g)制取无水FeCl3,实验装置如图所示(加热和夹持装置略去)。下列说法正确的是( )
A. 实验开始时应先加热①处,再通入干燥的Cl2
B. ②处冷水的作用是降低FeCl3 的溶解度
C. 装置③可用盛有浓硫酸的洗气瓶代替
D. 实验开始后,可以在①处观察到反应剧烈,产生浅绿色的烟
8. (2024扬州中学期中)某小组同学在实验室制备、收集氯气,并进行氯水中相关物质的性质探究,回答下列问题。
(1) 制备Cl2。写出装置Ⅰ中发生的化学反应方程式:_____________________。
图1
(2) 氯水相关物质的性质探究。
①若装置Ⅳ中试剂b为H2O,可制得氯水。写出Cl2与H2O反应的化学方程式:_____________________ 。
②若装置Ⅳ中试剂b为CCl4,可制得Cl2的CCl4溶液(Cl2可溶于CCl4且不与CCl4反应)。取稀盐酸、新制氯水、Cl2的CCl4溶液,分别滴在三张红色纸条上,可观察到只有滴加新制氯水的红色纸条褪色,证明 。
③验证氯水中HClO光照分解的产物。将装置Ⅳ广口瓶中的氯水转移至三颈瓶内,将pH传感器、氯离子传感器、氧气传感器分别插入三颈瓶中(如图2),用强光照射氯水,进行实验并采集数据,获得相关变化曲线。
图2 图3
若能够证明氯水中HClO在光照下发生了分解反应,则图3中纵坐标可以表示的物理量是 (填字母)。[注:酸性溶液中,c(H+)越大,pH越小,溶液酸性越强]
a. 氯水的pH
b. 氢离子的浓度
c. 氯离子的浓度
d. 氧气的体积分数
e. 溶液的颜色
据此数据,可分析得到HClO在光照下发生的化学反应方程式为
。
(3) 若要模拟工业制备漂白粉,装置Ⅳ中试剂b为 ,制备漂白粉的化学方程式为_______________________________________。若用43.50 g二氧化锰与足量浓盐酸(溶质质量分数为36.50%)完全反应,制取氯气。将所得气体全部用于制备漂白粉,所制得的漂白粉中所含有效成分的质量为 (写出计算过程)。
第3课时 氯气的性质及应用(2)
1. B 缺少加热装置,A错误;Cl2 的密度大于空气,用向上排空气法收集,Cl2 应该“长进短出”,C错误;新制氯水会漂白pH试纸,不能用pH试纸测新制氯水的pH,D错误。
2. A MnO2和稀盐酸共热不能反应生成Cl2,B错误;光照条件下,HClO分解生成O2和HCl,C错误;CuO和水不反应,D错误。
3. B 漂白粉可用氯气和石灰乳反应制得,A错误;漂白粉是由氯化钙和次氯酸钙组成的混合物,其有效成分是Ca(ClO)2,B正确;漂白粉是由Cl2与石灰乳反应制得的混合物,C错误;漂白粉暴露在空气中吸收二氧化碳和水生成碳酸钙和次氯酸,次氯酸见光易分解,所以会变质失效,D错误。
4. B Cl2与水反应时生成HCl和HClO,Cl2既表现氧化性又表现还原性,A错误;Cl2没有漂白性,C错误;Fe在Cl2中燃烧只能生成FeCl3,D错误。
5. A HClO分解生成HCl,溶液的酸性增强,pH减小,A正确;HClO分解生成HCl,溶液中Cl-的浓度增大,B错误;HClO分解生成O2,则瓶中氧气的体积分数增大,C错误;HClO是弱电解质,分解生成强电解质HCl,溶液中离子浓度增大,则溶液的导电能力增大,D错误。
6. (1) 干燥的有色布条不褪色,湿润的有色布条褪色 (2) NaOH Cl2+2NaOH===NaCl+NaClO+H2O (3) 2Cl2+2Ca(OH)2===CaCl2+Ca(ClO)2+2H2O
7. C 先通入干燥的氯气排尽装置中空气,再加热①处,A错误;②处冷水的作用是降低温度,使气态的FeCl3 在收集器中凝华形成晶体,B错误;装置③球形干燥管中氯化钙吸收水蒸气,防止水蒸气进入收集器中导致氯化铁水解,可用盛有浓硫酸的洗气瓶代替,C正确;实验开始后,可以在①处观察到反应剧烈,产生棕黄色的烟,D错误。
8. (1) MnO2+4HCl(浓)MnCl2+Cl2↑+2H2O
(2) ①Cl2+H2O HCl+HClO
②氯水中HClO具有漂白作用
③ bcd 2HClO2HCl+O2↑
(3) 石灰乳 2Ca(OH)2+2Cl2===CaCl2+Ca(ClO)2+2H2O 35.75 g
解析:(3) 工业上制备漂白粉是将Cl2通入冷的熟石灰中,则装置Ⅳ中试剂b为石灰乳,氯气和Ca(OH)2反应生成CaCl2、Ca(ClO)2和水;漂白粉中所含有效成分是Ca(ClO)2,设Ca(ClO)2的质量为m,可得关系式
2MnO2 ~ 2Cl2 ~ Ca(ClO)2
2×87 143
43.50 g m
则=,解得m=35.75 g。
在氯水中含有多种微粒,因此在与不同物质发生反应时,表现出不同微粒的性质,列表如下:
所加试剂 参与反应的微粒 实验现象 化学方程式或解释
AgNO3溶液 Cl- 白色沉淀 HCl+AgNO3===AgCl↓+HNO3
Na2CO3固体 H+ 有气泡产生 2HCl+Na2CO3===2NaCl+CO2↑+H2O
有色布条 HClO 有色布条颜色褪去 漂白性
FeCl2溶液 Cl2 溶液由浅绿色变成黄色 2FeCl2+Cl2===2FeCl3
石蕊溶液 HClO、H+ 先变红后褪色 酸性和漂白性
【夯实基础】
1. (2024南通期中)1774年,瑞典化学家舍勒将软锰矿(主要成分是MnO2)与浓盐酸混合加热时,制得了Cl2。下列制备、收集Cl2及检验氯水性质的原理或装置正确的是( )
A. 制取Cl2 B. 除去Cl2中的HCl
C. 收集Cl2 D. 测新制氯水的pH
2. (2024淮安期中)在给定条件下,下列选项所示的物质间转化均能实现的是( )
A. H2OH2 B. 稀盐酸Cl2
C. HClOCl2 D. CuOCu(OH)2
3. (2024南通西藏民族中学阶段测试)下列关于漂白粉的叙述正确的是( )
A. 漂白粉可用NaOH制得
B. 漂白粉的有效成分是Ca(ClO)2
C. 漂白粉是由Cl2与消石灰制得的纯净物
D. 漂白粉暴露在空气中不会变质失效
4. (2024南通中学月考)下列关于Cl2的说法正确的是( )
A. Cl2具有很强的氧化性,在化学反应中只能作氧化剂
B. H2在Cl2中燃烧,瓶口出现白雾
C. Cl2具有漂白性,可用于漂白纸浆
D. Fe在 Cl2中的燃烧产物用数轴表示如下:
5. (2024南通通州期末)用强光照射密闭细口瓶中的新制氯水,使用传感器测得的某数据随时间的变化如图所示。该数据可能是( )
A. 氯水的pH
B. 溶液中Cl-的浓度
C. 瓶中氧气的体积分数
D. 溶液的导电能力
6. (1) 如下图所示,将氯气依次通过盛有干燥有色布条的广口瓶和盛有湿润有色布条的广口瓶,可观察到的现象是_______________________________________________________________________。
(2) 实验室要在通风橱内制备氯气,并且为了防止氯气污染空气,要有尾气处理装置,一般用 溶液吸收多余的氯气,原理是 (用化学方程式表示)。
(3) 根据这一原理,工业上常用廉价的石灰乳吸收工业氯气尾气制得漂白粉,反应的化学方程式是____________________________________________________
___________________________________________________________。
【提升素养】
7. 无水FeCl3 在空气中易潮解,加热易升华。实验室利用反应3Cl2(g)+2Fe(s)2FeCl3(g)制取无水FeCl3,实验装置如图所示(加热和夹持装置略去)。下列说法正确的是( )
A. 实验开始时应先加热①处,再通入干燥的Cl2
B. ②处冷水的作用是降低FeCl3 的溶解度
C. 装置③可用盛有浓硫酸的洗气瓶代替
D. 实验开始后,可以在①处观察到反应剧烈,产生浅绿色的烟
8. (2024扬州中学期中)某小组同学在实验室制备、收集氯气,并进行氯水中相关物质的性质探究,回答下列问题。
(1) 制备Cl2。写出装置Ⅰ中发生的化学反应方程式:_____________________。
图1
(2) 氯水相关物质的性质探究。
①若装置Ⅳ中试剂b为H2O,可制得氯水。写出Cl2与H2O反应的化学方程式:_____________________ 。
②若装置Ⅳ中试剂b为CCl4,可制得Cl2的CCl4溶液(Cl2可溶于CCl4且不与CCl4反应)。取稀盐酸、新制氯水、Cl2的CCl4溶液,分别滴在三张红色纸条上,可观察到只有滴加新制氯水的红色纸条褪色,证明 。
③验证氯水中HClO光照分解的产物。将装置Ⅳ广口瓶中的氯水转移至三颈瓶内,将pH传感器、氯离子传感器、氧气传感器分别插入三颈瓶中(如图2),用强光照射氯水,进行实验并采集数据,获得相关变化曲线。
图2 图3
若能够证明氯水中HClO在光照下发生了分解反应,则图3中纵坐标可以表示的物理量是 (填字母)。[注:酸性溶液中,c(H+)越大,pH越小,溶液酸性越强]
a. 氯水的pH
b. 氢离子的浓度
c. 氯离子的浓度
d. 氧气的体积分数
e. 溶液的颜色
据此数据,可分析得到HClO在光照下发生的化学反应方程式为
。
(3) 若要模拟工业制备漂白粉,装置Ⅳ中试剂b为 ,制备漂白粉的化学方程式为_______________________________________。若用43.50 g二氧化锰与足量浓盐酸(溶质质量分数为36.50%)完全反应,制取氯气。将所得气体全部用于制备漂白粉,所制得的漂白粉中所含有效成分的质量为 (写出计算过程)。
第3课时 氯气的性质及应用(2)
1. B 缺少加热装置,A错误;Cl2 的密度大于空气,用向上排空气法收集,Cl2 应该“长进短出”,C错误;新制氯水会漂白pH试纸,不能用pH试纸测新制氯水的pH,D错误。
2. A MnO2和稀盐酸共热不能反应生成Cl2,B错误;光照条件下,HClO分解生成O2和HCl,C错误;CuO和水不反应,D错误。
3. B 漂白粉可用氯气和石灰乳反应制得,A错误;漂白粉是由氯化钙和次氯酸钙组成的混合物,其有效成分是Ca(ClO)2,B正确;漂白粉是由Cl2与石灰乳反应制得的混合物,C错误;漂白粉暴露在空气中吸收二氧化碳和水生成碳酸钙和次氯酸,次氯酸见光易分解,所以会变质失效,D错误。
4. B Cl2与水反应时生成HCl和HClO,Cl2既表现氧化性又表现还原性,A错误;Cl2没有漂白性,C错误;Fe在Cl2中燃烧只能生成FeCl3,D错误。
5. A HClO分解生成HCl,溶液的酸性增强,pH减小,A正确;HClO分解生成HCl,溶液中Cl-的浓度增大,B错误;HClO分解生成O2,则瓶中氧气的体积分数增大,C错误;HClO是弱电解质,分解生成强电解质HCl,溶液中离子浓度增大,则溶液的导电能力增大,D错误。
6. (1) 干燥的有色布条不褪色,湿润的有色布条褪色 (2) NaOH Cl2+2NaOH===NaCl+NaClO+H2O (3) 2Cl2+2Ca(OH)2===CaCl2+Ca(ClO)2+2H2O
7. C 先通入干燥的氯气排尽装置中空气,再加热①处,A错误;②处冷水的作用是降低温度,使气态的FeCl3 在收集器中凝华形成晶体,B错误;装置③球形干燥管中氯化钙吸收水蒸气,防止水蒸气进入收集器中导致氯化铁水解,可用盛有浓硫酸的洗气瓶代替,C正确;实验开始后,可以在①处观察到反应剧烈,产生棕黄色的烟,D错误。
8. (1) MnO2+4HCl(浓)MnCl2+Cl2↑+2H2O
(2) ①Cl2+H2O HCl+HClO
②氯水中HClO具有漂白作用
③ bcd 2HClO2HCl+O2↑
(3) 石灰乳 2Ca(OH)2+2Cl2===CaCl2+Ca(ClO)2+2H2O 35.75 g
解析:(3) 工业上制备漂白粉是将Cl2通入冷的熟石灰中,则装置Ⅳ中试剂b为石灰乳,氯气和Ca(OH)2反应生成CaCl2、Ca(ClO)2和水;漂白粉中所含有效成分是Ca(ClO)2,设Ca(ClO)2的质量为m,可得关系式
2MnO2 ~ 2Cl2 ~ Ca(ClO)2
2×87 143
43.50 g m
则=,解得m=35.75 g。
在氯水中含有多种微粒,因此在与不同物质发生反应时,表现出不同微粒的性质,列表如下:
所加试剂 参与反应的微粒 实验现象 化学方程式或解释
AgNO3溶液 Cl- 白色沉淀 HCl+AgNO3===AgCl↓+HNO3
Na2CO3固体 H+ 有气泡产生 2HCl+Na2CO3===2NaCl+CO2↑+H2O
有色布条 HClO 有色布条颜色褪去 漂白性
FeCl2溶液 Cl2 溶液由浅绿色变成黄色 2FeCl2+Cl2===2FeCl3
石蕊溶液 HClO、H+ 先变红后褪色 酸性和漂白性
