3.2.3 碳酸钠 碳酸氢钠 课后练(含答案)高中化学 必修1(苏教版2019)
文档属性
| 名称 | 3.2.3 碳酸钠 碳酸氢钠 课后练(含答案)高中化学 必修1(苏教版2019) |  | |
| 格式 | doc | ||
| 文件大小 | 341.1KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 苏教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2025-06-28 22:26:28 | ||
图片预览




文档简介
第7课时 碳酸钠 碳酸氢钠
【夯实基础】
1. (2024无锡一中月考)下列关于Na2CO3和NaHCO3的说法错误的是( )
A. Na2CO3俗称苏打,NaHCO3俗称小苏打
B. 相同温度时,在水中的溶解性:NaHCO3>Na2CO3
C. Na2CO3溶于水放热,NaHCO3溶于水吸热
D. 与同浓度盐酸反应的剧烈程度:NaHCO3>Na2CO3
2. 下列不能用来鉴别Na2CO3和NaHCO3两种无色固体的实验操作是( )
A. 分别加热这两种固体,并将生成的气体通入澄清石灰水中
B. 分别加热这两种固体,并称量加热前后的质量
C. 分别在这两种固体物质中滴加等浓度的稀盐酸
D. 分别在这两种物质的溶液中加入澄清石灰水
3. (2024扬州宝应期中)下列关于苏打(Na2CO3)和小苏打(NaHCO3)的说法错误的是( )
A. 用澄清石灰水可以鉴别Na2CO3溶液和NaHCO3溶液
B. 等物质的量的Na2CO3和NaHCO3固体,分别与相同浓度相同体积的盐酸反应,NaHCO3反应更剧烈
C. 等质量的Na2CO3和NaHCO3分别与足量盐酸反应,在相同条件下NaHCO3产生的CO2体积大
D. Na2CO3固体中混有NaHCO3杂质,可以加热至恒重除去
4. 以不同类别物质间的转化为线索,构建钠及其化合物的关系如图所示。下列分析错误的是( )
A. 上述反应类型有分解反应、化合反应、置换反应
B. 反应③表明CO2具有酸性氧化物的性质
C. 利用反应④可除去NaHCO3固体中混有的少量Na2CO3
D. 反应⑤⑥可应用于潜水艇中O2的供给
5. (2024南京九中期中)纯碱是基本化工原料。我国化学家侯德榜于1943年提出了著名的侯氏制碱法:将H2与N2合成氨,CO2通入NH3和NaCl饱和溶液中,使溶解度小的NaHCO3从溶液中析出,加热NaHCO3晶体即可获得纯碱。大大缩短了生产流程,降低了成本,实现了中国人自己制碱的梦想。如图是侯氏制碱法在实验室进行模拟实验的生产流程示意图。下列叙述正确的是( )
A. 通入A气体是为了使溶液呈酸性
B. 图中晶体和纯碱溶液可用作食用碱或工业用碱
C. 第Ⅲ步操作中析出晶体,是因为该晶体在NH4Cl溶液中溶解度较大
D. 第Ⅳ步操作得到的物质可用来治疗胃酸过多
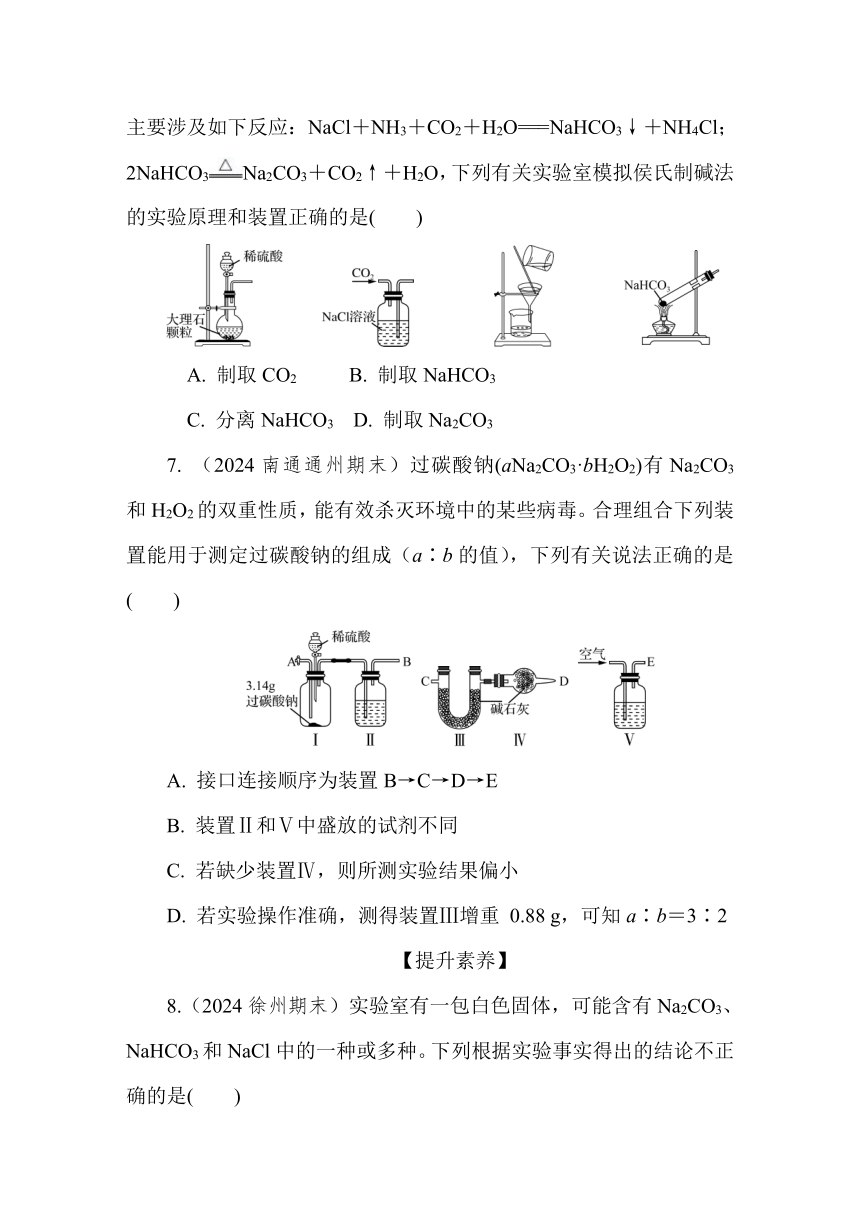
6. 以NaCl为原料,可制取纯碱。Na2CO3可用侯氏制碱法制取,主要涉及如下反应:NaCl+NH3+CO2+H2O===NaHCO3↓+NH4Cl;2NaHCO3Na2CO3+CO2↑+H2O,下列有关实验室模拟侯氏制碱法的实验原理和装置正确的是( )
A. 制取CO2 B. 制取NaHCO3
C. 分离NaHCO3 D. 制取Na2CO3
7. (2024南通通州期末)过碳酸钠(aNa2CO3·bH2O2)有Na2CO3和H2O2的双重性质,能有效杀灭环境中的某些病毒。合理组合下列装置能用于测定过碳酸钠的组成(a∶b的值),下列有关说法正确的是( )
A. 接口连接顺序为装置B→C→D→E
B. 装置Ⅱ和Ⅴ中盛放的试剂不同
C. 若缺少装置Ⅳ,则所测实验结果偏小
D. 若实验操作准确,测得装置Ⅲ增重 0.88 g,可知a∶b=3∶2
【提升素养】
8.(2024徐州期末)实验室有一包白色固体,可能含有Na2CO3、NaHCO3和NaCl中的一种或多种。下列根据实验事实得出的结论不正确的是( )
A. 取一定量固体,溶解,向溶液中滴入1~2滴酚酞溶液,溶液变成浅红色,说明原固体中一定含有NaHCO3
B. 取一定量固体,溶解,向溶液中加入适量CaO粉末,充分反应后观察到有白色沉淀生成,说明原固体中至少含有Na2CO3和NaHCO3中的一种
C. 取一定量固体,溶解,向溶液中滴加硝酸酸化后再加入AgNO3溶液,观察到有白色沉淀生成,说明原固体中一定含有NaCl
D. 称取3.80 g固体,加热至恒重,质量减少了0.620 g。用足量稀盐酸溶解残留固体,充分反应后,收集到0.880 g气体,说明原固体中含有Na2CO3、NaHCO3和NaCl
9. (2024苏州常熟中学期末)国际化学年中国宣传口号是“化学——我们的生活,我们的未来”,学习化学应该明白“从生活中来,到生活中去”的道理。Na2CO3和NaHCO3是日常生活中经常遇到的物质。请填空:
(1) 甲组同学为了检验某含有NaHCO3杂质的Na2CO3样品的纯度,现将w1 g样品加热至质量不再发生变化,其质量变为w2 g,则该Na2CO3样品的纯度(质量分数)是____________________________________________________________。
(2) 混合样品中碳酸钠的质量分数,也可通过加热分解得到的CO2质量进行计算,乙组同学设计的实验装置如图所示,则下列说法正确的是 (填字母)。
A B C
A. X气体可以是空气,反应前和反应后均需通一段时间空气
B. 装置B、C之间缺少CO2的干燥装置
C. 没有a装置会导致所测碳酸钠的质量分数偏高
D. a装置内应装碱石灰,目的是尾气处理
第7课时 碳酸钠 碳酸氢钠
1. B Na2CO3和NaHCO3均溶于水,相同温度时,Na2CO3在水中的溶解性大于NaHCO3,B错误。
2. D 加热这两种固体物质并将生成的气体通入澄清石灰水中,碳酸钠不分解,质量不变,碳酸氢钠分解生成二氧化碳,质量减小,石灰水出现浑浊,可以鉴别,A、B正确;在这两种固体中滴加等浓度的稀盐酸,碳酸钠开始无现象,生成碳酸氢钠,全部都转化成碳酸氢钠后,开始放出气体,碳酸氢钠中滴加盐酸后立即有气体生成,C正确;在这两种物质的溶液中加入澄清石灰水,都有白色沉淀生成,无法鉴别,D错误。
3. A 分别向Na2CO3溶液和NaHCO3溶液中滴加澄清石灰水,均会产生白色沉淀,现象相同,无法鉴别,A错误。
Na2CO3、NaHCO3的除杂
除杂方法或试剂
Na2CO3固体(NaHCO3) 加热至恒重
NaHCO3溶液(Na2CO3) 通入足量CO2气体
Na2CO3溶液(NaHCO3) 加入适量NaOH溶液
4. C 由图可知,反应④为分解反应,反应①为化合反应,反应②为置换反应,A正确;反应③中,CO2和NaOH反应生成Na2CO3和H2O,说明CO2具有酸性氧化物的性质,B正确;反应④中,NaHCO3受热分解生成Na2CO3、CO2和H2O,除去的是NaHCO3,C错误;反应⑤⑥中,均有O2生成,可应用于潜水艇中O2的供给,D正确。
5. B 气体A为NH3,通入A气体是为了使溶液呈碱性,增大CO2的溶解度,A错误;图中晶体是NaHCO3,纯碱是Na2CO3,NaHCO3和Na2CO3可用作食用碱或工业用碱,B正确;第Ⅲ步操作中析出晶体,是因为NaHCO3在NH4Cl溶液中溶解度较小,以晶体形式析出,C错误;第Ⅳ步得到的物质是Na2CO3,Na2CO3的碱性较强,会损伤胃黏膜,不能用于治疗胃酸过多,D错误。
侯氏制碱法工艺流程
6. C 稀硫酸与CaCO3反应会生成微溶的CaSO4,附着在固体表面,影响反应的进行,应该用稀盐酸与CaCO3反应制备CO2,A错误;CO2在饱和食盐水中溶解度较小,向饱和食盐水中先通入NH3使溶液呈碱性,再通入CO2,且CO2应该从长管进,B错误;NaHCO3溶解度小,从饱和溶液中析出晶体,可以用过滤的方法分离固体和滤液,C正确;NaHCO3不稳定,受热易分解,在试管中加热固体时管口应向下倾斜,防止冷凝水倒流炸裂试管,D错误。
7. B 稀硫酸与过碳酸钠反应生成CO2,由于空气中含有CO2,所以需要除去空气中的CO2,又因为还需要防止空气中的水蒸气进入Ⅲ,所以连接顺序是装置E→A→B→C→D,A错误;装置Ⅱ和Ⅴ中盛放的试剂分别是浓硫酸和氢氧化钠溶液,B正确;若缺少装置Ⅳ,空气中的二氧化碳和水蒸气进入装置中,则所测实验结果偏大,C错误;若实验操作准确,测得装置Ⅲ增重0.88 g,n(CO)=n(CO2)==0.02 mol,m(Na2CO3)=0.02 mol×106 g/mol=2.12 g,则 m(H2O2)=3.14 g-2.12 g=1.02 g,n(H2O2)==0.03 mol可知a∶b=2∶3,D错误。
8. A 加入酚酞,溶液变成浅红色,说明原白色固体中含有Na2CO3和NaHCO3中的一种或两种,A错误;加入CaO与水反应生成Ca(OH)2,Ca(OH)2与Na2CO3或NaHCO3反应均能产生白色沉淀CaCO3,B正确;先滴加硝酸酸化,排除CO和HCO的干扰,再滴加AgNO3有白色沉淀生成,说明溶液中含有Cl-,原固体中含有NaCl,C正确;称取3.8 g 固体,加热,质量减少,说明其中含有NaHCO3,根据差量法
2NaHCO3Na2CO3+H2O+CO2↑ Δm
168 106 18 44 62
m(NaHCO3) m1(Na2CO3) 0.62 g
解得m(NaHCO3)=1.68 g,m1(Na2CO3)=1.06 g。用足量稀盐酸溶解残留固体,发生反应
Na2CO3+2HCl===2NaCl+H2O+CO2↑
106 44
m2(Na2CO3) 0.88 g
解得m2(Na2CO3)=2.12 g,原固体中的m(Na2CO3)=2.12 g-1.06 g=1.06 g。原固体中Na2CO3和NaHCO3的质量总和为1.68 g+1.06 g=2.74 g<3.80 g,故原固体中含有NaCl,D正确。
9. (1) (2) B
测定Na2CO3质量分数的常用方法
(1) 气体法
①测定原理:Na2CO3+H2SO4===Na2SO4+H2O+CO2↑。
依据CO2的体积确定Na2CO3的物质的量,进而确定纯碱中Na2CO3的含量。
②实验操作:向m g纯碱样品中加入足量的稀硫酸,准确测量产生CO2气体的体积为V mL(已折算为标准状况)。
③数据处理
纯碱样品中,Na2CO3的质量= mol×106 g/mol= g,则纯碱样品中,Na2CO3的质量分数=×100%=%。
(2) 沉淀法
①测定原理:Na2CO3+BaCl2===BaCO3↓+2NaCl。
依据BaCO3沉淀的质量,确定Na2CO3的物质的量,进而确定纯碱中Na2CO3的含量。
②实验操作:先将m g纯碱样品溶于水配成溶液,向溶液中加入过量的BaCl2溶液,经过滤、洗涤、干燥得BaCO3沉淀的质量为n g。
③数据处理
纯碱样品中,Na2CO3的质量=×106 g/mol= g,则纯碱样品中,Na2CO3的质量分数=×100%=×100%。
【夯实基础】
1. (2024无锡一中月考)下列关于Na2CO3和NaHCO3的说法错误的是( )
A. Na2CO3俗称苏打,NaHCO3俗称小苏打
B. 相同温度时,在水中的溶解性:NaHCO3>Na2CO3
C. Na2CO3溶于水放热,NaHCO3溶于水吸热
D. 与同浓度盐酸反应的剧烈程度:NaHCO3>Na2CO3
2. 下列不能用来鉴别Na2CO3和NaHCO3两种无色固体的实验操作是( )
A. 分别加热这两种固体,并将生成的气体通入澄清石灰水中
B. 分别加热这两种固体,并称量加热前后的质量
C. 分别在这两种固体物质中滴加等浓度的稀盐酸
D. 分别在这两种物质的溶液中加入澄清石灰水
3. (2024扬州宝应期中)下列关于苏打(Na2CO3)和小苏打(NaHCO3)的说法错误的是( )
A. 用澄清石灰水可以鉴别Na2CO3溶液和NaHCO3溶液
B. 等物质的量的Na2CO3和NaHCO3固体,分别与相同浓度相同体积的盐酸反应,NaHCO3反应更剧烈
C. 等质量的Na2CO3和NaHCO3分别与足量盐酸反应,在相同条件下NaHCO3产生的CO2体积大
D. Na2CO3固体中混有NaHCO3杂质,可以加热至恒重除去
4. 以不同类别物质间的转化为线索,构建钠及其化合物的关系如图所示。下列分析错误的是( )
A. 上述反应类型有分解反应、化合反应、置换反应
B. 反应③表明CO2具有酸性氧化物的性质
C. 利用反应④可除去NaHCO3固体中混有的少量Na2CO3
D. 反应⑤⑥可应用于潜水艇中O2的供给
5. (2024南京九中期中)纯碱是基本化工原料。我国化学家侯德榜于1943年提出了著名的侯氏制碱法:将H2与N2合成氨,CO2通入NH3和NaCl饱和溶液中,使溶解度小的NaHCO3从溶液中析出,加热NaHCO3晶体即可获得纯碱。大大缩短了生产流程,降低了成本,实现了中国人自己制碱的梦想。如图是侯氏制碱法在实验室进行模拟实验的生产流程示意图。下列叙述正确的是( )
A. 通入A气体是为了使溶液呈酸性
B. 图中晶体和纯碱溶液可用作食用碱或工业用碱
C. 第Ⅲ步操作中析出晶体,是因为该晶体在NH4Cl溶液中溶解度较大
D. 第Ⅳ步操作得到的物质可用来治疗胃酸过多
6. 以NaCl为原料,可制取纯碱。Na2CO3可用侯氏制碱法制取,主要涉及如下反应:NaCl+NH3+CO2+H2O===NaHCO3↓+NH4Cl;2NaHCO3Na2CO3+CO2↑+H2O,下列有关实验室模拟侯氏制碱法的实验原理和装置正确的是( )
A. 制取CO2 B. 制取NaHCO3
C. 分离NaHCO3 D. 制取Na2CO3
7. (2024南通通州期末)过碳酸钠(aNa2CO3·bH2O2)有Na2CO3和H2O2的双重性质,能有效杀灭环境中的某些病毒。合理组合下列装置能用于测定过碳酸钠的组成(a∶b的值),下列有关说法正确的是( )
A. 接口连接顺序为装置B→C→D→E
B. 装置Ⅱ和Ⅴ中盛放的试剂不同
C. 若缺少装置Ⅳ,则所测实验结果偏小
D. 若实验操作准确,测得装置Ⅲ增重 0.88 g,可知a∶b=3∶2
【提升素养】
8.(2024徐州期末)实验室有一包白色固体,可能含有Na2CO3、NaHCO3和NaCl中的一种或多种。下列根据实验事实得出的结论不正确的是( )
A. 取一定量固体,溶解,向溶液中滴入1~2滴酚酞溶液,溶液变成浅红色,说明原固体中一定含有NaHCO3
B. 取一定量固体,溶解,向溶液中加入适量CaO粉末,充分反应后观察到有白色沉淀生成,说明原固体中至少含有Na2CO3和NaHCO3中的一种
C. 取一定量固体,溶解,向溶液中滴加硝酸酸化后再加入AgNO3溶液,观察到有白色沉淀生成,说明原固体中一定含有NaCl
D. 称取3.80 g固体,加热至恒重,质量减少了0.620 g。用足量稀盐酸溶解残留固体,充分反应后,收集到0.880 g气体,说明原固体中含有Na2CO3、NaHCO3和NaCl
9. (2024苏州常熟中学期末)国际化学年中国宣传口号是“化学——我们的生活,我们的未来”,学习化学应该明白“从生活中来,到生活中去”的道理。Na2CO3和NaHCO3是日常生活中经常遇到的物质。请填空:
(1) 甲组同学为了检验某含有NaHCO3杂质的Na2CO3样品的纯度,现将w1 g样品加热至质量不再发生变化,其质量变为w2 g,则该Na2CO3样品的纯度(质量分数)是____________________________________________________________。
(2) 混合样品中碳酸钠的质量分数,也可通过加热分解得到的CO2质量进行计算,乙组同学设计的实验装置如图所示,则下列说法正确的是 (填字母)。
A B C
A. X气体可以是空气,反应前和反应后均需通一段时间空气
B. 装置B、C之间缺少CO2的干燥装置
C. 没有a装置会导致所测碳酸钠的质量分数偏高
D. a装置内应装碱石灰,目的是尾气处理
第7课时 碳酸钠 碳酸氢钠
1. B Na2CO3和NaHCO3均溶于水,相同温度时,Na2CO3在水中的溶解性大于NaHCO3,B错误。
2. D 加热这两种固体物质并将生成的气体通入澄清石灰水中,碳酸钠不分解,质量不变,碳酸氢钠分解生成二氧化碳,质量减小,石灰水出现浑浊,可以鉴别,A、B正确;在这两种固体中滴加等浓度的稀盐酸,碳酸钠开始无现象,生成碳酸氢钠,全部都转化成碳酸氢钠后,开始放出气体,碳酸氢钠中滴加盐酸后立即有气体生成,C正确;在这两种物质的溶液中加入澄清石灰水,都有白色沉淀生成,无法鉴别,D错误。
3. A 分别向Na2CO3溶液和NaHCO3溶液中滴加澄清石灰水,均会产生白色沉淀,现象相同,无法鉴别,A错误。
Na2CO3、NaHCO3的除杂
除杂方法或试剂
Na2CO3固体(NaHCO3) 加热至恒重
NaHCO3溶液(Na2CO3) 通入足量CO2气体
Na2CO3溶液(NaHCO3) 加入适量NaOH溶液
4. C 由图可知,反应④为分解反应,反应①为化合反应,反应②为置换反应,A正确;反应③中,CO2和NaOH反应生成Na2CO3和H2O,说明CO2具有酸性氧化物的性质,B正确;反应④中,NaHCO3受热分解生成Na2CO3、CO2和H2O,除去的是NaHCO3,C错误;反应⑤⑥中,均有O2生成,可应用于潜水艇中O2的供给,D正确。
5. B 气体A为NH3,通入A气体是为了使溶液呈碱性,增大CO2的溶解度,A错误;图中晶体是NaHCO3,纯碱是Na2CO3,NaHCO3和Na2CO3可用作食用碱或工业用碱,B正确;第Ⅲ步操作中析出晶体,是因为NaHCO3在NH4Cl溶液中溶解度较小,以晶体形式析出,C错误;第Ⅳ步得到的物质是Na2CO3,Na2CO3的碱性较强,会损伤胃黏膜,不能用于治疗胃酸过多,D错误。
侯氏制碱法工艺流程
6. C 稀硫酸与CaCO3反应会生成微溶的CaSO4,附着在固体表面,影响反应的进行,应该用稀盐酸与CaCO3反应制备CO2,A错误;CO2在饱和食盐水中溶解度较小,向饱和食盐水中先通入NH3使溶液呈碱性,再通入CO2,且CO2应该从长管进,B错误;NaHCO3溶解度小,从饱和溶液中析出晶体,可以用过滤的方法分离固体和滤液,C正确;NaHCO3不稳定,受热易分解,在试管中加热固体时管口应向下倾斜,防止冷凝水倒流炸裂试管,D错误。
7. B 稀硫酸与过碳酸钠反应生成CO2,由于空气中含有CO2,所以需要除去空气中的CO2,又因为还需要防止空气中的水蒸气进入Ⅲ,所以连接顺序是装置E→A→B→C→D,A错误;装置Ⅱ和Ⅴ中盛放的试剂分别是浓硫酸和氢氧化钠溶液,B正确;若缺少装置Ⅳ,空气中的二氧化碳和水蒸气进入装置中,则所测实验结果偏大,C错误;若实验操作准确,测得装置Ⅲ增重0.88 g,n(CO)=n(CO2)==0.02 mol,m(Na2CO3)=0.02 mol×106 g/mol=2.12 g,则 m(H2O2)=3.14 g-2.12 g=1.02 g,n(H2O2)==0.03 mol可知a∶b=2∶3,D错误。
8. A 加入酚酞,溶液变成浅红色,说明原白色固体中含有Na2CO3和NaHCO3中的一种或两种,A错误;加入CaO与水反应生成Ca(OH)2,Ca(OH)2与Na2CO3或NaHCO3反应均能产生白色沉淀CaCO3,B正确;先滴加硝酸酸化,排除CO和HCO的干扰,再滴加AgNO3有白色沉淀生成,说明溶液中含有Cl-,原固体中含有NaCl,C正确;称取3.8 g 固体,加热,质量减少,说明其中含有NaHCO3,根据差量法
2NaHCO3Na2CO3+H2O+CO2↑ Δm
168 106 18 44 62
m(NaHCO3) m1(Na2CO3) 0.62 g
解得m(NaHCO3)=1.68 g,m1(Na2CO3)=1.06 g。用足量稀盐酸溶解残留固体,发生反应
Na2CO3+2HCl===2NaCl+H2O+CO2↑
106 44
m2(Na2CO3) 0.88 g
解得m2(Na2CO3)=2.12 g,原固体中的m(Na2CO3)=2.12 g-1.06 g=1.06 g。原固体中Na2CO3和NaHCO3的质量总和为1.68 g+1.06 g=2.74 g<3.80 g,故原固体中含有NaCl,D正确。
9. (1) (2) B
测定Na2CO3质量分数的常用方法
(1) 气体法
①测定原理:Na2CO3+H2SO4===Na2SO4+H2O+CO2↑。
依据CO2的体积确定Na2CO3的物质的量,进而确定纯碱中Na2CO3的含量。
②实验操作:向m g纯碱样品中加入足量的稀硫酸,准确测量产生CO2气体的体积为V mL(已折算为标准状况)。
③数据处理
纯碱样品中,Na2CO3的质量= mol×106 g/mol= g,则纯碱样品中,Na2CO3的质量分数=×100%=%。
(2) 沉淀法
①测定原理:Na2CO3+BaCl2===BaCO3↓+2NaCl。
依据BaCO3沉淀的质量,确定Na2CO3的物质的量,进而确定纯碱中Na2CO3的含量。
②实验操作:先将m g纯碱样品溶于水配成溶液,向溶液中加入过量的BaCl2溶液,经过滤、洗涤、干燥得BaCO3沉淀的质量为n g。
③数据处理
纯碱样品中,Na2CO3的质量=×106 g/mol= g,则纯碱样品中,Na2CO3的质量分数=×100%=×100%。
