3.3.1 粗盐提纯 从海水中提取溴 课后练(含答案)高中化学 必修1(苏教版2019)
文档属性
| 名称 | 3.3.1 粗盐提纯 从海水中提取溴 课后练(含答案)高中化学 必修1(苏教版2019) |  | |
| 格式 | doc | ||
| 文件大小 | 358.5KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 苏教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2025-06-28 22:31:38 | ||
图片预览



文档简介
第三单元 海洋化学资源的综合利用
第9课时 粗盐提纯 从海水中提取溴
【夯实基础】
1. (CN)2的性质和Cl2 类似。下列叙述错误的是( )
A. (CN)2 可以和H2 反应
B. (CN)2 不能和碱反应
C. CN-具有还原性
D. (CN)2 的性质活泼
2. (2024常州二中学情检测)空气吹出法工艺,是目前“海水(呈弱碱性)提溴”的最主要方法之一,其工艺流程如图所示。下列说法错误的是( )
A. “吹出塔”步骤中利用了Br2的挥发性
B. “吸收塔”内发生反应的化学方程式为Br2+SO2+2H2O===H2SO4+2HBr
C. 工业Br2中含少量Cl2,可用NaOH溶液除去
D. 在该流程中,每提取1 mol Br2,理论上至少消耗44.8 L Cl2(标准状况)
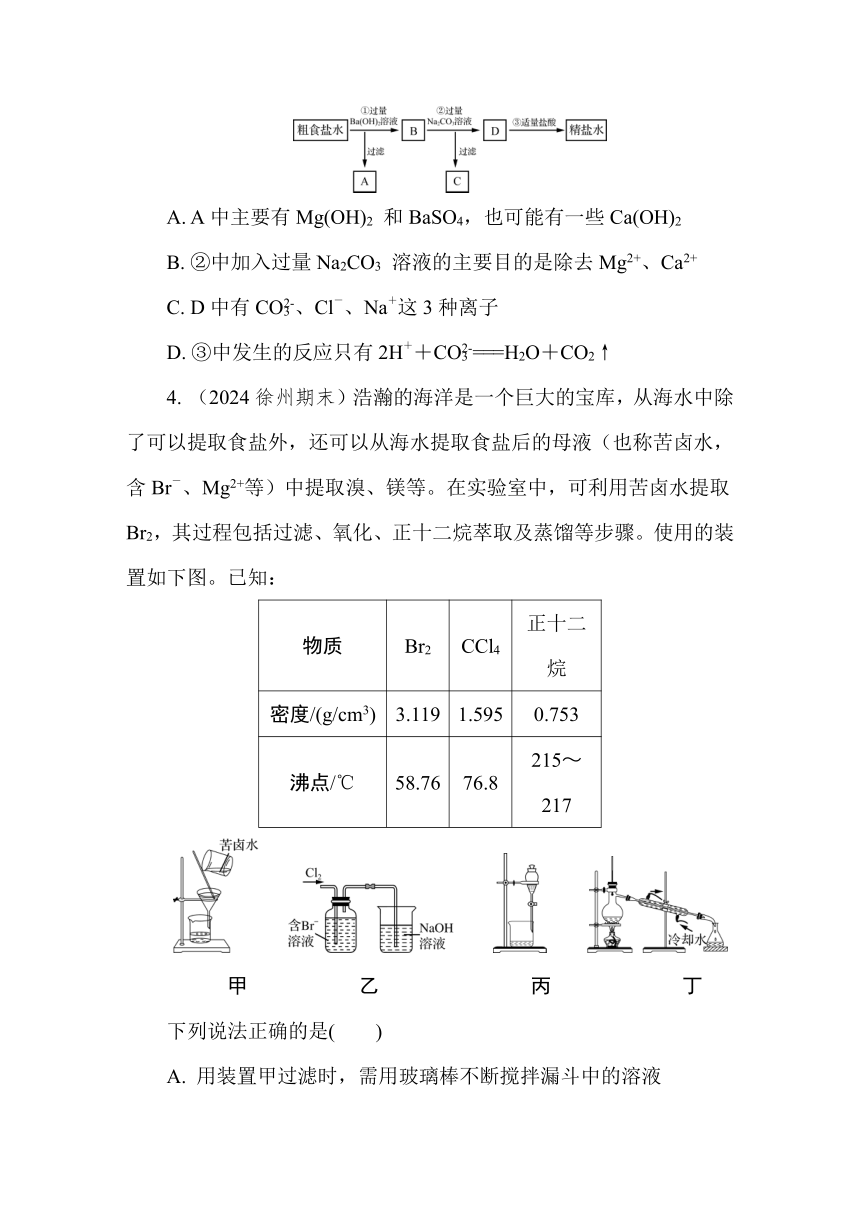
3. 为从粗食盐水中除去Ca2+、Mg2+、SO等离子,以制得精盐水,某同学设计如下方案。下列说法正确的是( )
A. A中主要有Mg(OH)2 和BaSO4,也可能有一些Ca(OH)2
B. ②中加入过量Na2CO3 溶液的主要目的是除去Mg2+、Ca2+
C. D中有CO、Cl-、Na+这3种离子
D. ③中发生的反应只有2H++CO===H2O+CO2↑
4. (2024徐州期末)浩瀚的海洋是一个巨大的宝库,从海水中除了可以提取食盐外,还可以从海水提取食盐后的母液(也称苦卤水,含Br-、Mg2+等)中提取溴、镁等。在实验室中,可利用苦卤水提取Br2,其过程包括过滤、氧化、正十二烷萃取及蒸馏等步骤。使用的装置如下图。已知:
物质 Br2 CCl4 正十二烷
密度/(g/cm3) 3.119 1.595 0.753
沸点/℃ 58.76 76.8 215~217
甲 乙 丙 丁
下列说法正确的是( )
A. 用装置甲过滤时,需用玻璃棒不断搅拌漏斗中的溶液
B. 用装置乙将含Br-溶液中的Br-氧化成Br2
C. 装置丙中用正十二烷而不用CCl4的原因为正十二烷的密度小
D. 用装置丁进行蒸馏时,先收集到正十二烷馏分
5. (2024淮安期末)从海水中提取Br2的工业流程如图,下列说法正确的是( )
A. 卤水中氯化钠的浓度比海水中氯化钠浓度小
B. 步骤Ⅰ中发生反应的离子方程式为Br-+Cl2===Br2+Cl-
C. 步骤Ⅱ中通入热空气吹出Br2,利用了Br2的挥发性
D. 步骤Ⅲ反应中氧化剂与还原剂的物质的量之比为1∶1
6. (2024 扬州高邮月考)海水提溴常用“空气吹出法”,其部分流程如图所示。下列说法错误的是( )
A. “酸化”的目的是抑制Cl2、Br2与水反应
B. “吹出”步骤利用了Br2的挥发性
C. “吸收”所得溶液中大量存在的微粒有Cl-、Br-、SO
D. “氧化Ⅱ”产生可循环使用的物质X为H2SO4
7. 开发利用海水化学资源的部分过程如图所示:
下列关于开发利用海水化学资源部分过程的说法正确的是( )
A. ①的操作是先通入足量的NH3
B. SO2的水溶液能导电,所以SO2属于电解质
C. 鉴别NaHCO3和Na2CO3溶液可以用澄清石灰水
D. 粗盐中含有Ca2+、Mg2+、SO等杂质离子,加入除杂试剂的顺序依次是Na2CO3溶液、NaOH溶液、BaCl2溶液
【提升素养】
8. (2024泰州靖江中学期末)海水提纯精盐的过程是用化学沉淀法去除粗盐中的杂质离子Ca2+、Mg2+和SO,请完成下列各题。
(1) 下面是粗盐提纯的部分操作步骤,请补充③处实验步骤:
①用天平称取5.0 g粗盐,放入100 mL烧杯中,然后加入20 mL蒸馏水,用玻璃棒搅拌,使粗盐全部溶解,得到粗盐水。
②向粗盐水中滴加过量的BaCl2溶液,使SO与Ba2+完全反应生成BaSO4后将烧杯静置。
③______________________________________________________________________________________________________________________________________。
④向粗盐水中滴加过量的NaOH溶液,使Mg2+与OH-完全反应生成Mg(OH)2沉淀,然后滴加过量的饱和Na2CO3溶液,使Ca2+、Ba2+与CO完全反应生成沉淀。
⑤…
(2) 有学生设计的粗盐提纯工艺流程图如下:
①上述流程图中③处加入的试剂是 (填名称)。
②写出流程中③处发生反应的离子方程式: 、
。
(3) 方案评价:化学沉淀法中沉淀剂BaCl2和Na2CO3加入的顺序 (填“能”或“不能”)交换。
第9课时 粗盐提纯 从海水中提取溴
1. B (CN)2 与Cl2的性质很相似,所以可以根据Cl2的性质预测(CN)2 的性质。Cl2可以与H2 反应生成HCl,故(CN)2 可以和H2 反应,A正确;Cl2可以与碱反应生成盐,故(CN)2 能和碱反应生成盐,B错误;Cl-能被氧化,具有还原性,则CN-具有还原性,C正确;Cl2的性质活泼,是常见的氧化剂,故(CN)2 的性质活泼,D正确。
2. C
3. A ①过滤后得到的A中主要有Mg(OH)2 和BaSO4,也可能有一些Ca(OH)2,A正确;②再加过量的Na2CO3溶液,除去Ca2+和过量的Ba2+,B错误;①加入过量的Ba(OH)2,引入了OH-,则D中有OH-、CO、Cl-、Na+这4种离子,C错误;③加入适量的盐酸反应过量的OH-和CO,发生的反应有H++OH-===H2O、2H++CO===H2O+CO2↑,D错误。
4. B 过滤时,玻璃棒与三层滤纸的一边接触,不能搅拌漏斗中的溶液,A错误;Cl2的氧化性大于Br2,用装置乙将含Br-溶液中的Br-氧化成Br2,B正确;装置丙中用正十二烷而不用CCl4的原因是正十二烷的沸点与Br2沸点相差大,便于蒸馏,C错误;Br2的沸点比正十二烷低,用装置丁进行蒸馏时,先收集到Br2,D错误。
5. C 卤水中为饱和氯化钠溶液,浓度比海水中氯化钠浓度大,A错误;步骤Ⅰ中Cl2和Br-发生反应的离子方程式为2Br-+Cl2===Br2+2Cl-,B错误;溴单质具有挥发性,通过热空气吹出,并用纯碱吸收,得到NaBr和NaBrO3,C正确;NaBr和NaBrO3加硫酸酸化后得到溴单质,化学方程式为5NaBr+NaBrO3+3H2SO4===3Na2SO4+3Br2+3H2O,则反应中氧化剂与还原剂的物质的量之比为1∶5,D错误。
6. C Cl2与水反应生成HCl和HClO、Br2与水反应生成HBr和HBrO,向浓缩海水加入硫酸“酸化”的目的是抑制Cl2、Br2与水反应,A正确;液溴具有挥发性,则“吹出”步骤利用了Br2的挥发性,B正确;“吸收”涉及反应的化学方程式为Br2+SO2+2H2O===H2SO4+2HBr,溶液中不可能存在Cl-,C错误;向H2SO4和HBr的混合溶液中通入Cl2,则“氧化Ⅱ”涉及反应的化学方程式为Cl2+2HBr===Br2+2HCl,H2SO4的沸点较高,不易被高温水蒸气吹出,留在溶液中,故可循环使用的物质X为H2SO4,D正确。
富集溴的方法
①SO2吸收Br2,反应的化学方程式为SO2+Br2+2H2O===2HBr+H2SO4,再用Cl2将HBr氧化为Br2,反应的化学方程式为Cl2+2HBr===Br2+2HCl。
②碱液Na2CO3吸收Br2,生成NaBrO3、NaBr和CO2,BrO、Br-在酸性条件下发生归中反应生成Br2。
7. A 为了增大二氧化碳的溶解度,先通入足量氨气,A正确;二氧化硫与水反应生成亚硫酸,亚硫酸部分电离出阴阳离子,溶液导电,而二氧化硫自身不能电离出离子,所以二氧化硫属于非电解质,B错误;NaHCO3和Na2CO3溶液都能使澄清石灰水变浑浊,不能鉴别,C错误;加碳酸钠除去钙离子及过量钡离子,应先加BaCl2溶液,再加Na2CO3溶液,D错误。
8. (1) 沿烧杯壁向上层清液继续滴加2~3滴BaCl2溶液,若不出现浑浊,则表明SO沉淀完全,若出现沉淀,则继续滴加BaCl2溶液,直至SO沉淀完全
(2) ①稀盐酸 ②H++OH-===H2O 2H++CO===H2O+CO2↑
(3) 不能
物质除杂和分离注意的问题
(1) 除杂试剂要过量。
(2) 后续试剂应能除去过量的前一试剂。
(3) 尽可能将杂质转化为所需物质。
(4) 除去多种杂质时考虑加入试剂的合理顺序。
第9课时 粗盐提纯 从海水中提取溴
【夯实基础】
1. (CN)2的性质和Cl2 类似。下列叙述错误的是( )
A. (CN)2 可以和H2 反应
B. (CN)2 不能和碱反应
C. CN-具有还原性
D. (CN)2 的性质活泼
2. (2024常州二中学情检测)空气吹出法工艺,是目前“海水(呈弱碱性)提溴”的最主要方法之一,其工艺流程如图所示。下列说法错误的是( )
A. “吹出塔”步骤中利用了Br2的挥发性
B. “吸收塔”内发生反应的化学方程式为Br2+SO2+2H2O===H2SO4+2HBr
C. 工业Br2中含少量Cl2,可用NaOH溶液除去
D. 在该流程中,每提取1 mol Br2,理论上至少消耗44.8 L Cl2(标准状况)
3. 为从粗食盐水中除去Ca2+、Mg2+、SO等离子,以制得精盐水,某同学设计如下方案。下列说法正确的是( )
A. A中主要有Mg(OH)2 和BaSO4,也可能有一些Ca(OH)2
B. ②中加入过量Na2CO3 溶液的主要目的是除去Mg2+、Ca2+
C. D中有CO、Cl-、Na+这3种离子
D. ③中发生的反应只有2H++CO===H2O+CO2↑
4. (2024徐州期末)浩瀚的海洋是一个巨大的宝库,从海水中除了可以提取食盐外,还可以从海水提取食盐后的母液(也称苦卤水,含Br-、Mg2+等)中提取溴、镁等。在实验室中,可利用苦卤水提取Br2,其过程包括过滤、氧化、正十二烷萃取及蒸馏等步骤。使用的装置如下图。已知:
物质 Br2 CCl4 正十二烷
密度/(g/cm3) 3.119 1.595 0.753
沸点/℃ 58.76 76.8 215~217
甲 乙 丙 丁
下列说法正确的是( )
A. 用装置甲过滤时,需用玻璃棒不断搅拌漏斗中的溶液
B. 用装置乙将含Br-溶液中的Br-氧化成Br2
C. 装置丙中用正十二烷而不用CCl4的原因为正十二烷的密度小
D. 用装置丁进行蒸馏时,先收集到正十二烷馏分
5. (2024淮安期末)从海水中提取Br2的工业流程如图,下列说法正确的是( )
A. 卤水中氯化钠的浓度比海水中氯化钠浓度小
B. 步骤Ⅰ中发生反应的离子方程式为Br-+Cl2===Br2+Cl-
C. 步骤Ⅱ中通入热空气吹出Br2,利用了Br2的挥发性
D. 步骤Ⅲ反应中氧化剂与还原剂的物质的量之比为1∶1
6. (2024 扬州高邮月考)海水提溴常用“空气吹出法”,其部分流程如图所示。下列说法错误的是( )
A. “酸化”的目的是抑制Cl2、Br2与水反应
B. “吹出”步骤利用了Br2的挥发性
C. “吸收”所得溶液中大量存在的微粒有Cl-、Br-、SO
D. “氧化Ⅱ”产生可循环使用的物质X为H2SO4
7. 开发利用海水化学资源的部分过程如图所示:
下列关于开发利用海水化学资源部分过程的说法正确的是( )
A. ①的操作是先通入足量的NH3
B. SO2的水溶液能导电,所以SO2属于电解质
C. 鉴别NaHCO3和Na2CO3溶液可以用澄清石灰水
D. 粗盐中含有Ca2+、Mg2+、SO等杂质离子,加入除杂试剂的顺序依次是Na2CO3溶液、NaOH溶液、BaCl2溶液
【提升素养】
8. (2024泰州靖江中学期末)海水提纯精盐的过程是用化学沉淀法去除粗盐中的杂质离子Ca2+、Mg2+和SO,请完成下列各题。
(1) 下面是粗盐提纯的部分操作步骤,请补充③处实验步骤:
①用天平称取5.0 g粗盐,放入100 mL烧杯中,然后加入20 mL蒸馏水,用玻璃棒搅拌,使粗盐全部溶解,得到粗盐水。
②向粗盐水中滴加过量的BaCl2溶液,使SO与Ba2+完全反应生成BaSO4后将烧杯静置。
③______________________________________________________________________________________________________________________________________。
④向粗盐水中滴加过量的NaOH溶液,使Mg2+与OH-完全反应生成Mg(OH)2沉淀,然后滴加过量的饱和Na2CO3溶液,使Ca2+、Ba2+与CO完全反应生成沉淀。
⑤…
(2) 有学生设计的粗盐提纯工艺流程图如下:
①上述流程图中③处加入的试剂是 (填名称)。
②写出流程中③处发生反应的离子方程式: 、
。
(3) 方案评价:化学沉淀法中沉淀剂BaCl2和Na2CO3加入的顺序 (填“能”或“不能”)交换。
第9课时 粗盐提纯 从海水中提取溴
1. B (CN)2 与Cl2的性质很相似,所以可以根据Cl2的性质预测(CN)2 的性质。Cl2可以与H2 反应生成HCl,故(CN)2 可以和H2 反应,A正确;Cl2可以与碱反应生成盐,故(CN)2 能和碱反应生成盐,B错误;Cl-能被氧化,具有还原性,则CN-具有还原性,C正确;Cl2的性质活泼,是常见的氧化剂,故(CN)2 的性质活泼,D正确。
2. C
3. A ①过滤后得到的A中主要有Mg(OH)2 和BaSO4,也可能有一些Ca(OH)2,A正确;②再加过量的Na2CO3溶液,除去Ca2+和过量的Ba2+,B错误;①加入过量的Ba(OH)2,引入了OH-,则D中有OH-、CO、Cl-、Na+这4种离子,C错误;③加入适量的盐酸反应过量的OH-和CO,发生的反应有H++OH-===H2O、2H++CO===H2O+CO2↑,D错误。
4. B 过滤时,玻璃棒与三层滤纸的一边接触,不能搅拌漏斗中的溶液,A错误;Cl2的氧化性大于Br2,用装置乙将含Br-溶液中的Br-氧化成Br2,B正确;装置丙中用正十二烷而不用CCl4的原因是正十二烷的沸点与Br2沸点相差大,便于蒸馏,C错误;Br2的沸点比正十二烷低,用装置丁进行蒸馏时,先收集到Br2,D错误。
5. C 卤水中为饱和氯化钠溶液,浓度比海水中氯化钠浓度大,A错误;步骤Ⅰ中Cl2和Br-发生反应的离子方程式为2Br-+Cl2===Br2+2Cl-,B错误;溴单质具有挥发性,通过热空气吹出,并用纯碱吸收,得到NaBr和NaBrO3,C正确;NaBr和NaBrO3加硫酸酸化后得到溴单质,化学方程式为5NaBr+NaBrO3+3H2SO4===3Na2SO4+3Br2+3H2O,则反应中氧化剂与还原剂的物质的量之比为1∶5,D错误。
6. C Cl2与水反应生成HCl和HClO、Br2与水反应生成HBr和HBrO,向浓缩海水加入硫酸“酸化”的目的是抑制Cl2、Br2与水反应,A正确;液溴具有挥发性,则“吹出”步骤利用了Br2的挥发性,B正确;“吸收”涉及反应的化学方程式为Br2+SO2+2H2O===H2SO4+2HBr,溶液中不可能存在Cl-,C错误;向H2SO4和HBr的混合溶液中通入Cl2,则“氧化Ⅱ”涉及反应的化学方程式为Cl2+2HBr===Br2+2HCl,H2SO4的沸点较高,不易被高温水蒸气吹出,留在溶液中,故可循环使用的物质X为H2SO4,D正确。
富集溴的方法
①SO2吸收Br2,反应的化学方程式为SO2+Br2+2H2O===2HBr+H2SO4,再用Cl2将HBr氧化为Br2,反应的化学方程式为Cl2+2HBr===Br2+2HCl。
②碱液Na2CO3吸收Br2,生成NaBrO3、NaBr和CO2,BrO、Br-在酸性条件下发生归中反应生成Br2。
7. A 为了增大二氧化碳的溶解度,先通入足量氨气,A正确;二氧化硫与水反应生成亚硫酸,亚硫酸部分电离出阴阳离子,溶液导电,而二氧化硫自身不能电离出离子,所以二氧化硫属于非电解质,B错误;NaHCO3和Na2CO3溶液都能使澄清石灰水变浑浊,不能鉴别,C错误;加碳酸钠除去钙离子及过量钡离子,应先加BaCl2溶液,再加Na2CO3溶液,D错误。
8. (1) 沿烧杯壁向上层清液继续滴加2~3滴BaCl2溶液,若不出现浑浊,则表明SO沉淀完全,若出现沉淀,则继续滴加BaCl2溶液,直至SO沉淀完全
(2) ①稀盐酸 ②H++OH-===H2O 2H++CO===H2O+CO2↑
(3) 不能
物质除杂和分离注意的问题
(1) 除杂试剂要过量。
(2) 后续试剂应能除去过量的前一试剂。
(3) 尽可能将杂质转化为所需物质。
(4) 除去多种杂质时考虑加入试剂的合理顺序。
