3.1.2 氯气的性质及应用(1) 课后练(含答案)高中化学 必修1(苏教版2019)
文档属性
| 名称 | 3.1.2 氯气的性质及应用(1) 课后练(含答案)高中化学 必修1(苏教版2019) |

|
|
| 格式 | doc | ||
| 文件大小 | 650.0KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 苏教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2025-06-28 22:29:38 | ||
图片预览



文档简介
第2课时 氯气的性质及应用(1)
【夯实基础】
1. 下列物质属于纯净物的是( )
A. 液氯 B. 氯水
C. 盐酸 D. “84”消毒液
2. 2024年6月27日,约旦的亚喀巴港口一个储存氯气的罐箱在吊装过程中掉落,导致数十吨氯气瞬间泄漏。下列有关说法正确的是( )
A. 氯气、氯水、液氯的成分相同
B. 可用pH试纸测定泄漏地点水溶液的pH
C. 氯气泄漏时,可用含有氢氧化钠溶液的湿毛巾捂住口鼻
D. 氯气泄漏时,应该向上风口和地势较高处转移疏散人群
3. (2024盐城东台期末)下列有关氯气的实验装置或操作能达到实验目的的是( )
① ② ③ ④
A. ①制备Cl2
B. ②除去Cl2中的HCl
C. ③将溶液中的Br-氧化为Br2
D. ④测氯水的pH
4. 下列说法中,正确的是( )
A. 氢气在氯气中燃烧,发出苍白色的火焰
B. 氯气泄漏,可用浸有KOH溶液的毛巾捂住口鼻,逃离现场
C. 铜丝在氯气中燃烧,生成蓝色的氯化铜固体
D. 氯元素在自然界中既有游离态又有化合态存在
5.(2024连云港赣榆阶段考)下列关于新制氯水的说法错误的是( )
A. 向氯水中滴入Na2CO3溶液,有气体生成,该气体为CO2
B. 将氯水滴入紫色石蕊试液,石蕊试液先变红后褪色,说明Cl2有漂白性
C. 将氯水滴入AgNO3溶液,有白色沉淀生成,其化学方程式为AgNO3+HCl===AgCl↓+HNO3
D. 氯水中含有Cl2、HClO分子,也含有H+、Cl-等离子,说明Cl2与H2O不能完全反应
6. 如下图所示,从A处通入新制备的Cl2,关闭B阀时,C处的红色布条看不到明显现象;当打开B阀后,C处红色布条逐渐褪色。D瓶中装的是( )
①浓硫酸 ②NaOH溶液 ③H2O ④饱和NaCl溶液
A. ①② B. ①③ C. ②④ D. ③④
7. (2024南通期中)在指定条件下,下列选项所示的物质间转化不能实现的是( )
A. FeFeCl3
B. NaClO(溶液)HClO
C. Ca(OH)2(溶液)Ca(ClO)2
D. HClO(溶液)Cl2
8. (2024南通如皋期末)下列制取、净化、干燥、收集氯气实验的装置中,能够达到实验目的的是( )
A.制取Cl2 B. 除HCl C. 干燥Cl2 D. 收集Cl2
9. 将足量 CO2气体通入下列物质中,没有明显现象的是( )
A. CaCl2溶液 B. 澄清石灰水
C. Ca(ClO)2溶液 D. CaCO3的悬浊液
【提升素养】
10. 下列关于氯水的叙述正确的是( )
①新制氯水中只含Cl2 分子和H2O分子
②新制氯水可使紫色石蕊试纸先变红后褪色
③氯水光照时有气泡冒出,该气体为Cl2
④氯水放置数天后,溶液的酸性将减弱
⑤新制氯水呈黄绿色,久置氯水无色
⑥新制氯水漂白作用强于久置氯水
A. ①③④ B. ②③④
C. ③⑤⑥ D. ②⑤⑥
11. (2024泰州靖江中学期末)下列实验方案能达到实验目的的是( )
A. 用盐酸酸化的硝酸银鉴别自来水和蒸馏水
B. 用分液漏斗分离氯水与酒精的混合物
C. 将Cl2分别通入放有干燥和湿润的有色布条的广口瓶探究漂白原理
D. 用饱和NaOH溶液除去Cl2气体中混有的少量HCl气体
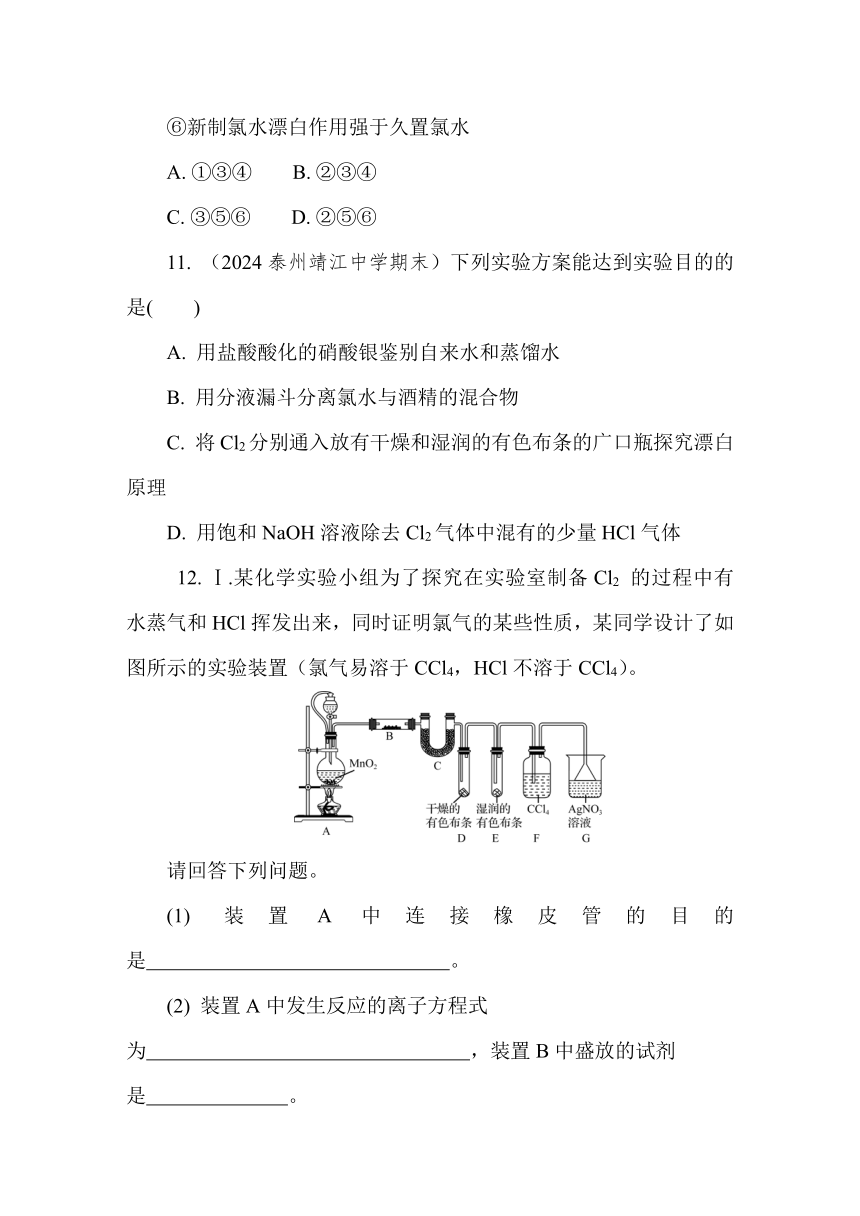
12. Ⅰ.某化学实验小组为了探究在实验室制备Cl2 的过程中有水蒸气和HCl挥发出来,同时证明氯气的某些性质,某同学设计了如图所示的实验装置(氯气易溶于CCl4,HCl不溶于CCl4)。
请回答下列问题。
(1) 装置A中连接橡皮管的目的是 。
(2) 装置A中发生反应的离子方程式为 ,装置B中盛放的试剂是 。
(3) 有同学基于实验的严谨性考虑,认为可在F、G两个装置之间再加一个装有湿润的淀粉-KI试纸的装置,其目的是 。
Ⅱ.某研究性学习小组欲制备漂白粉,设计在上述装置A后连接如图所示的组合装置。
(4) 装置②中发生反应的化学方程式为____________________________________________________________________。
(5) 制漂白粉的反应是放热反应,反应温度较高时伴有副反应发生,改进该实验装置以减少副反应发生的方法是______________________________________。
第2课时 氯气的性质及应用(1)
1. A 液氯是氯气的液态单质,属于纯净物,A正确;氯水是氯气溶于水形成的混合物,B错误;盐酸是氯化氢的水溶液,属于混合物,C错误;“84”消毒液的主要成分是次氯酸钠,所以它属于混合物,D错误。
2. D 氯气是气态、液氯为液态,两者均为氯的单质,氯水是氯气溶于水后形成的混合物,三者成分不同,A错误;氯气溶于水后形成氯水,氯水中含有HClO,具有漂白性,不能用pH试纸测氯水的pH,B错误;NaOH具有强腐蚀性,会灼伤皮肤,应选择小苏打或者苏打溶液浸湿的毛巾捂住口鼻,C错误;氯气的密度大于空气的,氯气泄漏会往下沉,且随风扩散,为了防止中毒,应该向上风口和地势较高处转移疏散人群,D正确。
3. C 缺少加热装置,A错误;会引入新的杂质气体CO2,可改用饱和食盐水,B错误;氯水可漂白pH试纸,不能用pH试纸测氯水的pH,D错误。
一般用pH计测量氯水的pH。
4. A 纯净的氢气在氯气中燃烧生成HCl,发出苍白色的火焰,A正确;氯气泄漏,可用浸有碳酸氢钠溶液的毛巾捂住口鼻,逃离现场,不能用氢氧化钾溶液,氢氧化钾溶液碱性太强,B错误;铜丝在氯气中燃烧,生成棕黄色的氯化铜,其水溶液为蓝色,C错误;氯气非常活泼,自然界中氯元素没有游离态,只有化合态,D错误。
5. B 氯水中的H+使紫色石蕊试液变红,氯水中的HClO(具有漂白性)使石蕊试液褪色,Cl2没有漂白性,B错误。
新制氯水的多重性质
6. A A处通入氯气,关闭B阀后,C处的红色布条看不到明显现象,当打开B阀后,C处红色布条逐渐褪色,说明D处可以干燥Cl2或吸收Cl2。浓硫酸具有吸水性,能够干燥Cl2,①正确;Cl2能够被NaOH溶液吸收,②正确;Cl2通过水会带出水蒸气,能使有色布条褪色,③错误;Cl2与食盐水不反应,但进入C的为潮湿的氯气,含HClO,则C处红色布条逐渐褪色,④错误。①②正确,故选A。
7. D 光照条件下,HClO分解生成O2和HCl,D错误。
8. D 浓盐酸与二氧化锰共热发生氧化还原反应生成氯气,装置中缺酒精灯,无法制得氯气,A错误;饱和食盐水除去氯气中的氯化氢应该长管进短管出,B错误;氯气能与碱石灰反应,不能用碱石灰干燥氯气,应选用硅胶或五氧化二磷,C错误;氯气的密度大于空气的,故用长管进短管出收集氯气,D正确。
9. A CaCl2溶液与二氧化碳不反应,没有明显现象,A正确;澄清石灰水与二氧化碳反应后,澄清的石灰水变浑浊,再继续通入二氧化碳,浊液又变澄清,B错误;Ca(ClO)2溶液与二氧化碳反应生成碳酸钙沉淀,溶液变浑浊,再继续通入二氧化碳,浊液又变澄清,C错误;向CaCO3的悬浊液中通入二氧化碳,悬浊液变澄清,D错误。
10. D 新制氯水中含有的分子有Cl2、HClO、H2O,①错误;新制氯水中含有H+,可使紫色石蕊试纸变红,含有HClO,可使试纸褪色,②正确;氯水中含有HClO,不稳定,见光易分解生成O2,③错误;氯水放置数天后,次氯酸分解生成盐酸,溶液的酸性增强,④错误;新制氯水呈黄绿色,久置氯水由于次氯酸分解,促进氯气和水的反应,不断消耗氯气,则溶液最终变成无色,⑤正确;新制氯水中含有次氯酸,漂白作用强,而久置氯水中次氯酸分解生成氯化氢和氧气,则无漂白作用,⑥正确。故选D。
11. C 盐酸中含有Cl-,硝酸银不能用盐酸酸化,A不符合题意;水与酒精能互溶,不能用分液漏斗分离氯水与酒精的混合物,B不符合题意;将Cl2分别通入放有干燥和湿润的有色布条的广口瓶,可以发现干燥的有色布条不褪色,而湿润的有色布条褪色,可以证明干燥的Cl2不具有漂白性,具有漂白性的是HClO,C符合题意;Cl2和HCl气体都与NaOH反应,不能用饱和NaOH溶液除去Cl2气体中混有的少量HCl气体,应该用饱和食盐水,D不符合题意。
12. Ⅰ. (1) 使内外压强相等,有利于分液漏斗中的浓盐酸顺利滴下 (2) MnO2+4H++2Cl-Mn2++Cl2↑+2H2O 无水硫酸铜 (3) 验证HCl中的Cl2 已经完全除去(或检验是否还含有Cl2) Ⅱ. (4) 2Ca(OH)2+2Cl2===CaCl2+Ca(ClO)2+2H2O (5) 将装置②置于冷水浴中进行实验
【夯实基础】
1. 下列物质属于纯净物的是( )
A. 液氯 B. 氯水
C. 盐酸 D. “84”消毒液
2. 2024年6月27日,约旦的亚喀巴港口一个储存氯气的罐箱在吊装过程中掉落,导致数十吨氯气瞬间泄漏。下列有关说法正确的是( )
A. 氯气、氯水、液氯的成分相同
B. 可用pH试纸测定泄漏地点水溶液的pH
C. 氯气泄漏时,可用含有氢氧化钠溶液的湿毛巾捂住口鼻
D. 氯气泄漏时,应该向上风口和地势较高处转移疏散人群
3. (2024盐城东台期末)下列有关氯气的实验装置或操作能达到实验目的的是( )
① ② ③ ④
A. ①制备Cl2
B. ②除去Cl2中的HCl
C. ③将溶液中的Br-氧化为Br2
D. ④测氯水的pH
4. 下列说法中,正确的是( )
A. 氢气在氯气中燃烧,发出苍白色的火焰
B. 氯气泄漏,可用浸有KOH溶液的毛巾捂住口鼻,逃离现场
C. 铜丝在氯气中燃烧,生成蓝色的氯化铜固体
D. 氯元素在自然界中既有游离态又有化合态存在
5.(2024连云港赣榆阶段考)下列关于新制氯水的说法错误的是( )
A. 向氯水中滴入Na2CO3溶液,有气体生成,该气体为CO2
B. 将氯水滴入紫色石蕊试液,石蕊试液先变红后褪色,说明Cl2有漂白性
C. 将氯水滴入AgNO3溶液,有白色沉淀生成,其化学方程式为AgNO3+HCl===AgCl↓+HNO3
D. 氯水中含有Cl2、HClO分子,也含有H+、Cl-等离子,说明Cl2与H2O不能完全反应
6. 如下图所示,从A处通入新制备的Cl2,关闭B阀时,C处的红色布条看不到明显现象;当打开B阀后,C处红色布条逐渐褪色。D瓶中装的是( )
①浓硫酸 ②NaOH溶液 ③H2O ④饱和NaCl溶液
A. ①② B. ①③ C. ②④ D. ③④
7. (2024南通期中)在指定条件下,下列选项所示的物质间转化不能实现的是( )
A. FeFeCl3
B. NaClO(溶液)HClO
C. Ca(OH)2(溶液)Ca(ClO)2
D. HClO(溶液)Cl2
8. (2024南通如皋期末)下列制取、净化、干燥、收集氯气实验的装置中,能够达到实验目的的是( )
A.制取Cl2 B. 除HCl C. 干燥Cl2 D. 收集Cl2
9. 将足量 CO2气体通入下列物质中,没有明显现象的是( )
A. CaCl2溶液 B. 澄清石灰水
C. Ca(ClO)2溶液 D. CaCO3的悬浊液
【提升素养】
10. 下列关于氯水的叙述正确的是( )
①新制氯水中只含Cl2 分子和H2O分子
②新制氯水可使紫色石蕊试纸先变红后褪色
③氯水光照时有气泡冒出,该气体为Cl2
④氯水放置数天后,溶液的酸性将减弱
⑤新制氯水呈黄绿色,久置氯水无色
⑥新制氯水漂白作用强于久置氯水
A. ①③④ B. ②③④
C. ③⑤⑥ D. ②⑤⑥
11. (2024泰州靖江中学期末)下列实验方案能达到实验目的的是( )
A. 用盐酸酸化的硝酸银鉴别自来水和蒸馏水
B. 用分液漏斗分离氯水与酒精的混合物
C. 将Cl2分别通入放有干燥和湿润的有色布条的广口瓶探究漂白原理
D. 用饱和NaOH溶液除去Cl2气体中混有的少量HCl气体
12. Ⅰ.某化学实验小组为了探究在实验室制备Cl2 的过程中有水蒸气和HCl挥发出来,同时证明氯气的某些性质,某同学设计了如图所示的实验装置(氯气易溶于CCl4,HCl不溶于CCl4)。
请回答下列问题。
(1) 装置A中连接橡皮管的目的是 。
(2) 装置A中发生反应的离子方程式为 ,装置B中盛放的试剂是 。
(3) 有同学基于实验的严谨性考虑,认为可在F、G两个装置之间再加一个装有湿润的淀粉-KI试纸的装置,其目的是 。
Ⅱ.某研究性学习小组欲制备漂白粉,设计在上述装置A后连接如图所示的组合装置。
(4) 装置②中发生反应的化学方程式为____________________________________________________________________。
(5) 制漂白粉的反应是放热反应,反应温度较高时伴有副反应发生,改进该实验装置以减少副反应发生的方法是______________________________________。
第2课时 氯气的性质及应用(1)
1. A 液氯是氯气的液态单质,属于纯净物,A正确;氯水是氯气溶于水形成的混合物,B错误;盐酸是氯化氢的水溶液,属于混合物,C错误;“84”消毒液的主要成分是次氯酸钠,所以它属于混合物,D错误。
2. D 氯气是气态、液氯为液态,两者均为氯的单质,氯水是氯气溶于水后形成的混合物,三者成分不同,A错误;氯气溶于水后形成氯水,氯水中含有HClO,具有漂白性,不能用pH试纸测氯水的pH,B错误;NaOH具有强腐蚀性,会灼伤皮肤,应选择小苏打或者苏打溶液浸湿的毛巾捂住口鼻,C错误;氯气的密度大于空气的,氯气泄漏会往下沉,且随风扩散,为了防止中毒,应该向上风口和地势较高处转移疏散人群,D正确。
3. C 缺少加热装置,A错误;会引入新的杂质气体CO2,可改用饱和食盐水,B错误;氯水可漂白pH试纸,不能用pH试纸测氯水的pH,D错误。
一般用pH计测量氯水的pH。
4. A 纯净的氢气在氯气中燃烧生成HCl,发出苍白色的火焰,A正确;氯气泄漏,可用浸有碳酸氢钠溶液的毛巾捂住口鼻,逃离现场,不能用氢氧化钾溶液,氢氧化钾溶液碱性太强,B错误;铜丝在氯气中燃烧,生成棕黄色的氯化铜,其水溶液为蓝色,C错误;氯气非常活泼,自然界中氯元素没有游离态,只有化合态,D错误。
5. B 氯水中的H+使紫色石蕊试液变红,氯水中的HClO(具有漂白性)使石蕊试液褪色,Cl2没有漂白性,B错误。
新制氯水的多重性质
6. A A处通入氯气,关闭B阀后,C处的红色布条看不到明显现象,当打开B阀后,C处红色布条逐渐褪色,说明D处可以干燥Cl2或吸收Cl2。浓硫酸具有吸水性,能够干燥Cl2,①正确;Cl2能够被NaOH溶液吸收,②正确;Cl2通过水会带出水蒸气,能使有色布条褪色,③错误;Cl2与食盐水不反应,但进入C的为潮湿的氯气,含HClO,则C处红色布条逐渐褪色,④错误。①②正确,故选A。
7. D 光照条件下,HClO分解生成O2和HCl,D错误。
8. D 浓盐酸与二氧化锰共热发生氧化还原反应生成氯气,装置中缺酒精灯,无法制得氯气,A错误;饱和食盐水除去氯气中的氯化氢应该长管进短管出,B错误;氯气能与碱石灰反应,不能用碱石灰干燥氯气,应选用硅胶或五氧化二磷,C错误;氯气的密度大于空气的,故用长管进短管出收集氯气,D正确。
9. A CaCl2溶液与二氧化碳不反应,没有明显现象,A正确;澄清石灰水与二氧化碳反应后,澄清的石灰水变浑浊,再继续通入二氧化碳,浊液又变澄清,B错误;Ca(ClO)2溶液与二氧化碳反应生成碳酸钙沉淀,溶液变浑浊,再继续通入二氧化碳,浊液又变澄清,C错误;向CaCO3的悬浊液中通入二氧化碳,悬浊液变澄清,D错误。
10. D 新制氯水中含有的分子有Cl2、HClO、H2O,①错误;新制氯水中含有H+,可使紫色石蕊试纸变红,含有HClO,可使试纸褪色,②正确;氯水中含有HClO,不稳定,见光易分解生成O2,③错误;氯水放置数天后,次氯酸分解生成盐酸,溶液的酸性增强,④错误;新制氯水呈黄绿色,久置氯水由于次氯酸分解,促进氯气和水的反应,不断消耗氯气,则溶液最终变成无色,⑤正确;新制氯水中含有次氯酸,漂白作用强,而久置氯水中次氯酸分解生成氯化氢和氧气,则无漂白作用,⑥正确。故选D。
11. C 盐酸中含有Cl-,硝酸银不能用盐酸酸化,A不符合题意;水与酒精能互溶,不能用分液漏斗分离氯水与酒精的混合物,B不符合题意;将Cl2分别通入放有干燥和湿润的有色布条的广口瓶,可以发现干燥的有色布条不褪色,而湿润的有色布条褪色,可以证明干燥的Cl2不具有漂白性,具有漂白性的是HClO,C符合题意;Cl2和HCl气体都与NaOH反应,不能用饱和NaOH溶液除去Cl2气体中混有的少量HCl气体,应该用饱和食盐水,D不符合题意。
12. Ⅰ. (1) 使内外压强相等,有利于分液漏斗中的浓盐酸顺利滴下 (2) MnO2+4H++2Cl-Mn2++Cl2↑+2H2O 无水硫酸铜 (3) 验证HCl中的Cl2 已经完全除去(或检验是否还含有Cl2) Ⅱ. (4) 2Ca(OH)2+2Cl2===CaCl2+Ca(ClO)2+2H2O (5) 将装置②置于冷水浴中进行实验
