专题2 研究物质的基本方法 检测卷(含答案)高中化学必修1(苏教版2019)
文档属性
| 名称 | 专题2 研究物质的基本方法 检测卷(含答案)高中化学必修1(苏教版2019) |  | |
| 格式 | doc | ||
| 文件大小 | 382.1KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 苏教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2025-07-01 15:05:01 | ||
图片预览



文档简介
专题2 研究物质的基本方法 检测卷
可能用到的相对原子质量:H:1 C:12 N:14 O:16 Na:23 Mg:24 S:32 Cl:35.5 Ca:40 Cu:64 Ba:137
一、 单项选择题:本题包括12小题。
1. 简单原子的原子结构可用下图形象地表示,其中“●”表示质子或电子,“○”表示中子,则下列有关的叙述正确的是( )
A. ①②③是三种化学性质不同的粒子
B. ①②③具有相同的质量数
C. ①②③为同素异形体
D. ①②③互为同位素
2. (扬州高邮期中)下列有关化学用语的说法正确的是( )
A. 中子数为8的氧原子:O
B. H、D、T互为同位素
C. Na+的结构示意图:
D. NaOH的电离方程式:NaOH===Na++O2-+H+
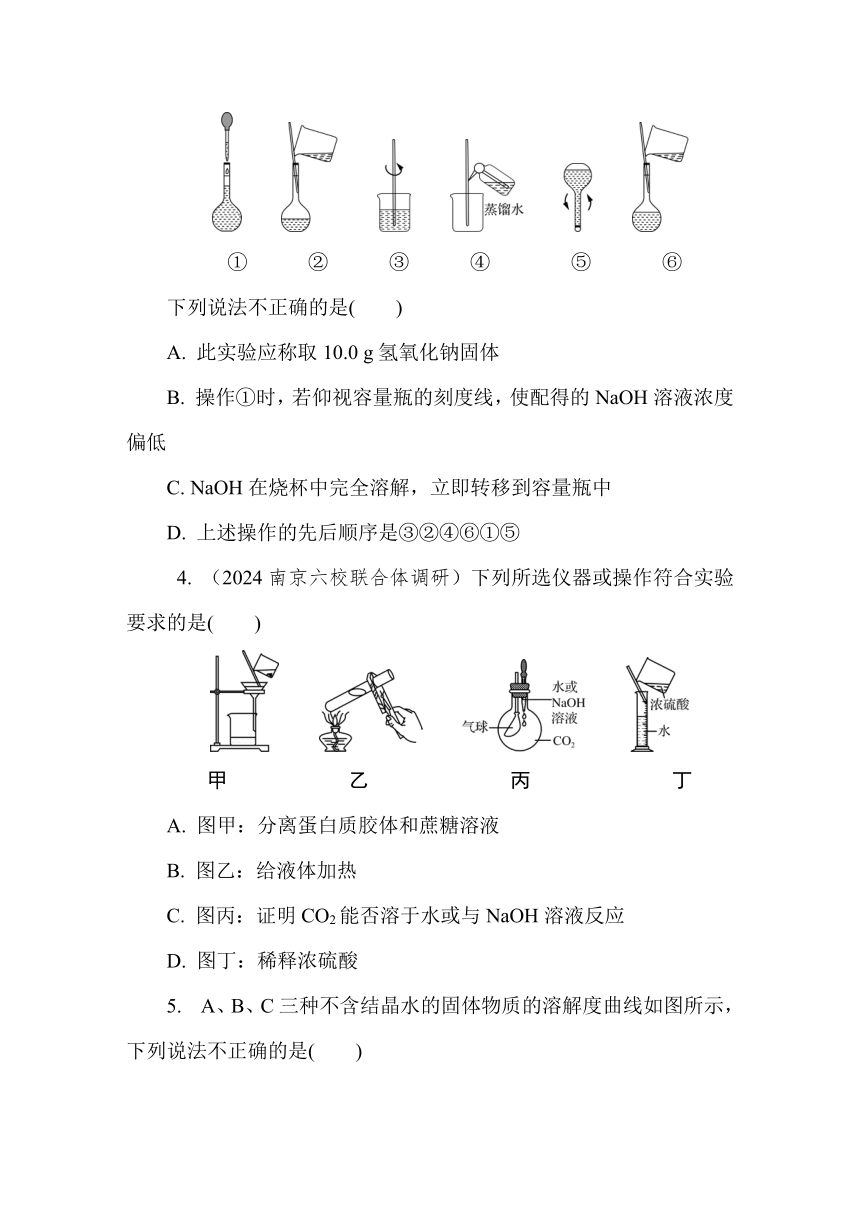
3. (2024南通通州高级中学期中)某实验需1 mol/L NaOH溶液250 mL,配制该NaOH溶液的几个关键实验步骤和操作示意图如下:
① ② ③ ④ ⑤ ⑥
下列说法不正确的是( )
A. 此实验应称取10.0 g氢氧化钠固体
B. 操作①时,若仰视容量瓶的刻度线,使配得的NaOH溶液浓度偏低
C. NaOH在烧杯中完全溶解,立即转移到容量瓶中
D. 上述操作的先后顺序是③②④⑥①⑤
4. (2024南京六校联合体调研)下列所选仪器或操作符合实验要求的是( )
甲 乙 丙 丁
A. 图甲:分离蛋白质胶体和蔗糖溶液
B. 图乙:给液体加热
C. 图丙:证明CO2能否溶于水或与NaOH溶液反应
D. 图丁:稀释浓硫酸
5. A、B、C三种不含结晶水的固体物质的溶解度曲线如图所示,下列说法不正确的是( )
A. T1℃时,A、C两种饱和溶液的溶质质量分数相等
B. A中含有少量杂质B,则可以通过蒸发浓缩、降温结晶的方法进行分离
C. 升温可使近饱和的C溶液变成饱和溶液
D. 将T2℃时C的饱和溶液升温到T3℃时溶质的质量不变
6. (2024南通如皋期末)用碳酸钠晶体(Na2CO3·10H2O)配制100 mL 0.1 mol/L碳酸钠溶液。下列说法正确的是( )
A. 所需称量Na2CO3·10H2O的质量为1.06 g
B. 称量后的Na2CO3·10H2O应放在容量瓶中进行溶解
C. 容量瓶使用之前应进行干燥,不能有水残留
D. 当定容加水距离刻度线还有1~2 cm时,应改用胶头滴管缓慢滴加
7. 下列说法不正确的是( )
①质子数相同的粒子一定属于同种元素;②电子数相同的粒子不一定是同种元素;③一种元素只能有一种质量数;④某种元素的相对原子质量取整数,就是其质量数;⑤质子数相同,电子数也相同的粒子,不可能是一种分子和一种离子;⑥同位素的性质几乎完全相同。
A. ①③④⑥ B. ①②④⑤
C. ②③⑤⑥ D. ②⑤
8.(2024泰州中学质检)工业上监测SO2含量是否达到排放标准的化学反应原理是SO2+H2O2+BaCl2===BaSO4↓+2HCl,设NA为阿伏加德罗常数的值。下列说法正确的是( )
A. 0.2 mol/L BaCl2溶液中Cl-的浓度为0.1 mol/L
B. 生成2.33 g BaSO4沉淀时,吸收SO2的体积为0.224 L
C. 常温常压下,17 g H2O2中所含分子总数为0.5NA
D. SO2溶液能导电,故SO2是电解质
9. (2024无锡江阴四校联考)下列说法正确的是( )
A. 标准状况下,6.02×1022个水分子的体积约为2.24 L
B. 11.2 L CH4与18 g H2O中的H原子数一定相等
C. 4.0 g NaOH溶解在100 mL水中所得溶液中c(Na+)=1.0 mol/L
D. 25 mL 2.0 mol/L NaCl溶液加水稀释到100 mL,稀释后溶液中c(Cl-)=0.50 mol/L
10. (2024苏州大学附属中学阶段检测)230Th和 232Th是钍的两种同位素,232Th可以转化成 233U。下列有关Th的说法正确的是( )
A. Th 元素的质量数是232
B. Th 元素的相对原子质量是231
C. 232Th 转换成 233U是化学变化
D. 230Th和 232Th的化学性质相同
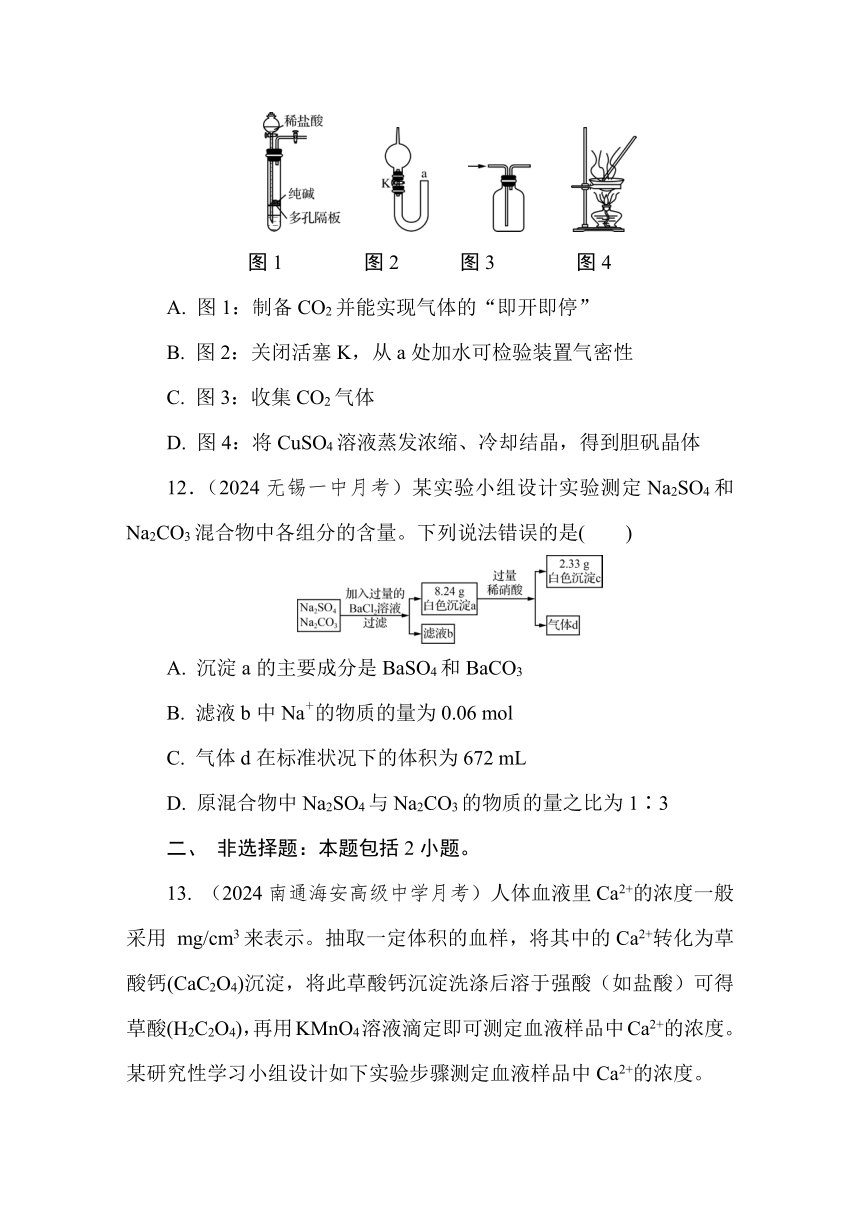
11.(2024淮阴中学阶段考)下列实验不能达到实验目的的是( )
图1 图2 图3 图4
A. 图1:制备CO2并能实现气体的“即开即停”
B. 图2:关闭活塞K,从a处加水可检验装置气密性
C. 图3:收集CO2气体
D. 图4:将CuSO4溶液蒸发浓缩、冷却结晶,得到胆矾晶体
12.(2024无锡一中月考)某实验小组设计实验测定Na2SO4和Na2CO3混合物中各组分的含量。下列说法错误的是( )
A. 沉淀a的主要成分是BaSO4和BaCO3
B. 滤液b中Na+的物质的量为0.06 mol
C. 气体d在标准状况下的体积为672 mL
D. 原混合物中Na2SO4与Na2CO3的物质的量之比为1∶3
二、 非选择题:本题包括2小题。
13. (2024南通海安高级中学月考)人体血液里Ca2+的浓度一般采用 mg/cm3来表示。抽取一定体积的血样,将其中的Ca2+转化为草酸钙(CaC2O4)沉淀,将此草酸钙沉淀洗涤后溶于强酸(如盐酸)可得草酸(H2C2O4),再用KMnO4溶液滴定即可测定血液样品中Ca2+的浓度。某研究性学习小组设计如下实验步骤测定血液样品中Ca2+的浓度。
步骤1:配制KMnO4标准溶液。配制100 mL KMnO4标准溶液的过程如图所示:
(1) 需用的仪器有天平、药匙、烧杯、玻璃棒、量筒、 。请你观察图示判断,其中不正确的操作有 (填序号)。
(2) 如果用图示的操作所配制的溶液进行实验,在其他操作正确的情况下,所配制的溶液浓度将 (填“偏大”“偏小”或“无影响”)。
步骤2:测定血液样品中Ca2+的浓度。抽取血样20.00 mL,经过上述处理后得到草酸,再用0.020 mol/L KMnO4溶液滴定,使草酸转化成CO2逸出,这时共消耗12.00 mL KMnO4溶液。
已知:CaC2O4+2HCl===CaCl2+H2C2O4,2KMnO4+5H2C2O4+6HCl===2MnCl2+2KCl+10CO2↑+8H2O。
(3) 经过计算,血液样品中Ca2+的浓度为 mg/cm3。
14. (2024扬州邗江期中)已知:硫代硫酸钠(化学式为Na2S2O3)易溶于水,具有强还原性,其相对分子质量是158。某实验室配制500 mL 0.100 mol/L Na2S2O3溶液,并测定样品中CuSO4·5H2O的纯度。
(1) 使用无水硫代硫酸钠进行配制,需要固体的质量是 。配制过程中需要的玻璃仪器有玻璃棒、烧杯、胶头滴管和 。
(2) 配制时使用的蒸馏水需先烧开再冷却,其目的是_____________________。
(3) 定容时俯视刻度线,则配制得到的Na2S2O3溶液的浓度将 (填“偏大”“偏小”或“不变”)。定容时,如果不小心加水超过了刻度线,则处理的方法是______________________________________________________。
(4) 测定样品CuSO4·5H2O的纯度:准确称取0.500 0 g CuSO4·5H2O样品,加入适量水溶解,转移至碘量瓶中,加过量KI溶液并用稀硫酸酸化,以淀粉溶液为指示剂,用0.100 mol/L Na2S2O3溶液滴定至终点,消耗Na2S2O3溶液19.20 mL。过程中发生下列反应:2CuSO4+4KI===2CuI↓+I2+2K2SO4;2Na2S2O3+I2===
Na2S4O6+2NaI;计算CuSO4·5H2O样品的纯度[纯度=×100%,写出计算过程]。
专题2 检测卷
1. D 最外层电子数决定化学性质,三种原子的最外层电子数相同,故化学性质相同,A错误;质量数=质子数+中子数,H、H、H的质量数分别为1、2、3,质量数不同,B错误;同种元素组成的结构不同的单质之间互为同素异形体,①②③是不同的原子,不是单质,故不是同素异形体,C错误;由分析可知,①②③代表的微粒分别为H、H、H,质子数相同、中子数不同,互为同位素,D正确。
2. B 质子数为8,中子数为8,则质量数为16,该氧原子为 8O,A错误;H、D、T的质子数相等,中子数不相等,互为同位素,B正确;Na的核电荷数为11 ,Na+的结构示意图为,C错误;NaOH的电离方程式:NaOH===Na++OH-,D错误。
3. C 此实验应称取氢氧化钠固体的质量为0.25 L×1 mol/L×40 g/mol=10.0 g,A正确;操作①时,若仰视容量瓶的刻度线,所配溶液的体积偏大,溶质物质的量不变,从而使配得的NaOH溶液浓度偏低,B正确;NaOH在烧杯中完全溶解,由于放热,使得溶液的温度升高,若立即转移到容量瓶中,会影响容量瓶的精度,C错误;配制溶液时,应依次进行溶解、转移、洗涤、转移、定容、上下颠倒并摇匀,所以操作的先后顺序是③②④⑥①⑤,D正确。
4. C 胶体和溶液均可透过滤纸,不能用过滤法分离蛋白质胶体和蔗糖溶液,A错误;给液体加热时,液体体积不能超过试管容积的,B错误;不能在量筒中稀释浓硫酸,D错误。
5. D T1℃时,A、C两种饱和溶液的溶解度相等,A正确;A、B的溶解度都随温度的升高而增大,而且A的溶解度受温度影响大,所以A中含有少量杂质B,则可以通过蒸发浓缩、降温结晶的方法进行分离,B正确;C的溶解度随温度升高而减小,则升温可使近饱和的C溶液变成饱和溶液,C正确;C的溶解度随温度升高而减小,将T2℃时C的饱和溶液升温到T3℃时,会有晶体析出,溶质的质量会减小,D错误。
6. D 100 mL 0.1 mol/L碳酸钠溶液中含有溶质的物质的量n(Na2CO3)=0.1 mol/L×0.1 L=0.01 mol,则根据元素守恒知需称量Na2CO3·10H2O的质量为m(Na2CO3·10H2O)=0.01 mol×286 g/mol=2.86 g,A错误;不能在容量瓶中溶解固体,称量后的Na2CO3·10H2O应放在烧杯中进行溶解,B错误;容量瓶是准确配制一定体积、一定物质的量浓度溶液的仪器,使用之前不需进行干燥,C错误;配制溶液在最后定容操作时,当加水距离刻度线还有1~2 cm时,应改用胶头滴管缓慢滴加,直至凹液面最低处与刻度线相切,D正确。
7. A 质子数相同的粒子不一定属于同种元素,例如水分子和氨气分子等,①错误;电子数相同的粒子不一定是同种元素,例如Na+和F-,②正确;一种元素不一定只能有一种质量数,例如 H、H、H,质量数分别为1、2、3,③错误;质量数应该是将原子内所有质子和中子的相对质量取近似整数值相加而得到的数值,④错误;质子数相同,电子数也相同的粒子,不可能是一种分子和一种离子,⑤正确;同位素的物理性质不同,化学性质几乎完全相同,⑥错误。故选A。
8. C 0.2 mol/L BaCl2溶液中Cl-的浓度为0.4 mol/L,A错误;气体所处的状况未知,无法计算体积,B错误;17 g H2O2的物质的量==0.5 mol,所含分子总数为0.5NA,C正确;SO2是非电解质,D错误。
9. D 标准状况下,水不是气体,无法计算水的体积,A错误;气体所处的状况未知,无法计算气体的物质的量,B错误;溶液的体积未知,无法计算c(Na+),C错误;稀释前后溶质的物质的量不变,2.0 mol/L×25 mL=c(NaCl)×100 mL,c(NaCl)=0.50 mol/L,则稀释后c(Cl-)=0.50 mol/L,D正确。
10. D 232Th的质量数是232,A错误;Th元素的相对原子质量是Th各种同位素相对原子质量的平均值,B错误;232Th转换成233U是原子核发生变化,属于物理变化,C错误;230Th和 232Th核外电子排布相同,所以化学性质相同,D正确。
11. A 纯碱是Na2CO3,易溶于水,图1所示装置不能实现气体的“即开即停”,不能达到实验目的,A符合题意。
12. B Na2SO4、Na2CO3与过量BaCl2溶液反应,生成的白色沉淀a为BaSO4、BaCO3,A正确;向沉淀中加入过量稀硝酸,不溶的2.33 g白色沉淀c为BaSO4,则n(Na2SO4)=n(BaSO4)==0.01 mol,n(Na2CO3)=n(BaCO3)==0.03 mol,滤液b中n(Na+)=(0.01 mol+0.03 mol) ×2=0.08 mol,B错误;由碳原子守恒知,标准状况下,V(CO2)=0.03 mol×22.4 L/mol=0.672 L=672 mL,C正确;混合物中Na2SO4、Na2CO3的物质的量分别为0.01 mol、0.03 mol,则Na2SO4、Na2CO3的物质的量之比为1∶3,D正确。
13. (1) 100 mL容量瓶、胶头滴管 ②⑤
(2) 偏小 (3) 1.2 mg/cm3
14. (1) 7.9 g 500 mL容量瓶 (2) 除去水中的溶解氧,防止硫代硫酸钠被氧化 (3) 偏大 重新配制
(4) 解:n(Na2S2O3)=c(Na2S2O3)·V(Na2S2O3)
=0.100 mol/L×0.019 2 L=0.001 92 mol
2CuSO4 ~ I2 ~ 2Na2S2O3
2 2
n(CuSO4) 0.001 92 mol
n(CuSO4)=0.001 92 mol
n(CuSO4·5H2O)=n(CuSO4)=0.001 92 mol
m(CuSO4·5H2O)=n(CuSO4·5H2O)·M(CuSO4·5H2O)=0.001 92 mol×250 g/mol=0.480 g
该CuSO4·5H2O样品的纯度=×100%=96.0%
可能用到的相对原子质量:H:1 C:12 N:14 O:16 Na:23 Mg:24 S:32 Cl:35.5 Ca:40 Cu:64 Ba:137
一、 单项选择题:本题包括12小题。
1. 简单原子的原子结构可用下图形象地表示,其中“●”表示质子或电子,“○”表示中子,则下列有关的叙述正确的是( )
A. ①②③是三种化学性质不同的粒子
B. ①②③具有相同的质量数
C. ①②③为同素异形体
D. ①②③互为同位素
2. (扬州高邮期中)下列有关化学用语的说法正确的是( )
A. 中子数为8的氧原子:O
B. H、D、T互为同位素
C. Na+的结构示意图:
D. NaOH的电离方程式:NaOH===Na++O2-+H+
3. (2024南通通州高级中学期中)某实验需1 mol/L NaOH溶液250 mL,配制该NaOH溶液的几个关键实验步骤和操作示意图如下:
① ② ③ ④ ⑤ ⑥
下列说法不正确的是( )
A. 此实验应称取10.0 g氢氧化钠固体
B. 操作①时,若仰视容量瓶的刻度线,使配得的NaOH溶液浓度偏低
C. NaOH在烧杯中完全溶解,立即转移到容量瓶中
D. 上述操作的先后顺序是③②④⑥①⑤
4. (2024南京六校联合体调研)下列所选仪器或操作符合实验要求的是( )
甲 乙 丙 丁
A. 图甲:分离蛋白质胶体和蔗糖溶液
B. 图乙:给液体加热
C. 图丙:证明CO2能否溶于水或与NaOH溶液反应
D. 图丁:稀释浓硫酸
5. A、B、C三种不含结晶水的固体物质的溶解度曲线如图所示,下列说法不正确的是( )
A. T1℃时,A、C两种饱和溶液的溶质质量分数相等
B. A中含有少量杂质B,则可以通过蒸发浓缩、降温结晶的方法进行分离
C. 升温可使近饱和的C溶液变成饱和溶液
D. 将T2℃时C的饱和溶液升温到T3℃时溶质的质量不变
6. (2024南通如皋期末)用碳酸钠晶体(Na2CO3·10H2O)配制100 mL 0.1 mol/L碳酸钠溶液。下列说法正确的是( )
A. 所需称量Na2CO3·10H2O的质量为1.06 g
B. 称量后的Na2CO3·10H2O应放在容量瓶中进行溶解
C. 容量瓶使用之前应进行干燥,不能有水残留
D. 当定容加水距离刻度线还有1~2 cm时,应改用胶头滴管缓慢滴加
7. 下列说法不正确的是( )
①质子数相同的粒子一定属于同种元素;②电子数相同的粒子不一定是同种元素;③一种元素只能有一种质量数;④某种元素的相对原子质量取整数,就是其质量数;⑤质子数相同,电子数也相同的粒子,不可能是一种分子和一种离子;⑥同位素的性质几乎完全相同。
A. ①③④⑥ B. ①②④⑤
C. ②③⑤⑥ D. ②⑤
8.(2024泰州中学质检)工业上监测SO2含量是否达到排放标准的化学反应原理是SO2+H2O2+BaCl2===BaSO4↓+2HCl,设NA为阿伏加德罗常数的值。下列说法正确的是( )
A. 0.2 mol/L BaCl2溶液中Cl-的浓度为0.1 mol/L
B. 生成2.33 g BaSO4沉淀时,吸收SO2的体积为0.224 L
C. 常温常压下,17 g H2O2中所含分子总数为0.5NA
D. SO2溶液能导电,故SO2是电解质
9. (2024无锡江阴四校联考)下列说法正确的是( )
A. 标准状况下,6.02×1022个水分子的体积约为2.24 L
B. 11.2 L CH4与18 g H2O中的H原子数一定相等
C. 4.0 g NaOH溶解在100 mL水中所得溶液中c(Na+)=1.0 mol/L
D. 25 mL 2.0 mol/L NaCl溶液加水稀释到100 mL,稀释后溶液中c(Cl-)=0.50 mol/L
10. (2024苏州大学附属中学阶段检测)230Th和 232Th是钍的两种同位素,232Th可以转化成 233U。下列有关Th的说法正确的是( )
A. Th 元素的质量数是232
B. Th 元素的相对原子质量是231
C. 232Th 转换成 233U是化学变化
D. 230Th和 232Th的化学性质相同
11.(2024淮阴中学阶段考)下列实验不能达到实验目的的是( )
图1 图2 图3 图4
A. 图1:制备CO2并能实现气体的“即开即停”
B. 图2:关闭活塞K,从a处加水可检验装置气密性
C. 图3:收集CO2气体
D. 图4:将CuSO4溶液蒸发浓缩、冷却结晶,得到胆矾晶体
12.(2024无锡一中月考)某实验小组设计实验测定Na2SO4和Na2CO3混合物中各组分的含量。下列说法错误的是( )
A. 沉淀a的主要成分是BaSO4和BaCO3
B. 滤液b中Na+的物质的量为0.06 mol
C. 气体d在标准状况下的体积为672 mL
D. 原混合物中Na2SO4与Na2CO3的物质的量之比为1∶3
二、 非选择题:本题包括2小题。
13. (2024南通海安高级中学月考)人体血液里Ca2+的浓度一般采用 mg/cm3来表示。抽取一定体积的血样,将其中的Ca2+转化为草酸钙(CaC2O4)沉淀,将此草酸钙沉淀洗涤后溶于强酸(如盐酸)可得草酸(H2C2O4),再用KMnO4溶液滴定即可测定血液样品中Ca2+的浓度。某研究性学习小组设计如下实验步骤测定血液样品中Ca2+的浓度。
步骤1:配制KMnO4标准溶液。配制100 mL KMnO4标准溶液的过程如图所示:
(1) 需用的仪器有天平、药匙、烧杯、玻璃棒、量筒、 。请你观察图示判断,其中不正确的操作有 (填序号)。
(2) 如果用图示的操作所配制的溶液进行实验,在其他操作正确的情况下,所配制的溶液浓度将 (填“偏大”“偏小”或“无影响”)。
步骤2:测定血液样品中Ca2+的浓度。抽取血样20.00 mL,经过上述处理后得到草酸,再用0.020 mol/L KMnO4溶液滴定,使草酸转化成CO2逸出,这时共消耗12.00 mL KMnO4溶液。
已知:CaC2O4+2HCl===CaCl2+H2C2O4,2KMnO4+5H2C2O4+6HCl===2MnCl2+2KCl+10CO2↑+8H2O。
(3) 经过计算,血液样品中Ca2+的浓度为 mg/cm3。
14. (2024扬州邗江期中)已知:硫代硫酸钠(化学式为Na2S2O3)易溶于水,具有强还原性,其相对分子质量是158。某实验室配制500 mL 0.100 mol/L Na2S2O3溶液,并测定样品中CuSO4·5H2O的纯度。
(1) 使用无水硫代硫酸钠进行配制,需要固体的质量是 。配制过程中需要的玻璃仪器有玻璃棒、烧杯、胶头滴管和 。
(2) 配制时使用的蒸馏水需先烧开再冷却,其目的是_____________________。
(3) 定容时俯视刻度线,则配制得到的Na2S2O3溶液的浓度将 (填“偏大”“偏小”或“不变”)。定容时,如果不小心加水超过了刻度线,则处理的方法是______________________________________________________。
(4) 测定样品CuSO4·5H2O的纯度:准确称取0.500 0 g CuSO4·5H2O样品,加入适量水溶解,转移至碘量瓶中,加过量KI溶液并用稀硫酸酸化,以淀粉溶液为指示剂,用0.100 mol/L Na2S2O3溶液滴定至终点,消耗Na2S2O3溶液19.20 mL。过程中发生下列反应:2CuSO4+4KI===2CuI↓+I2+2K2SO4;2Na2S2O3+I2===
Na2S4O6+2NaI;计算CuSO4·5H2O样品的纯度[纯度=×100%,写出计算过程]。
专题2 检测卷
1. D 最外层电子数决定化学性质,三种原子的最外层电子数相同,故化学性质相同,A错误;质量数=质子数+中子数,H、H、H的质量数分别为1、2、3,质量数不同,B错误;同种元素组成的结构不同的单质之间互为同素异形体,①②③是不同的原子,不是单质,故不是同素异形体,C错误;由分析可知,①②③代表的微粒分别为H、H、H,质子数相同、中子数不同,互为同位素,D正确。
2. B 质子数为8,中子数为8,则质量数为16,该氧原子为 8O,A错误;H、D、T的质子数相等,中子数不相等,互为同位素,B正确;Na的核电荷数为11 ,Na+的结构示意图为,C错误;NaOH的电离方程式:NaOH===Na++OH-,D错误。
3. C 此实验应称取氢氧化钠固体的质量为0.25 L×1 mol/L×40 g/mol=10.0 g,A正确;操作①时,若仰视容量瓶的刻度线,所配溶液的体积偏大,溶质物质的量不变,从而使配得的NaOH溶液浓度偏低,B正确;NaOH在烧杯中完全溶解,由于放热,使得溶液的温度升高,若立即转移到容量瓶中,会影响容量瓶的精度,C错误;配制溶液时,应依次进行溶解、转移、洗涤、转移、定容、上下颠倒并摇匀,所以操作的先后顺序是③②④⑥①⑤,D正确。
4. C 胶体和溶液均可透过滤纸,不能用过滤法分离蛋白质胶体和蔗糖溶液,A错误;给液体加热时,液体体积不能超过试管容积的,B错误;不能在量筒中稀释浓硫酸,D错误。
5. D T1℃时,A、C两种饱和溶液的溶解度相等,A正确;A、B的溶解度都随温度的升高而增大,而且A的溶解度受温度影响大,所以A中含有少量杂质B,则可以通过蒸发浓缩、降温结晶的方法进行分离,B正确;C的溶解度随温度升高而减小,则升温可使近饱和的C溶液变成饱和溶液,C正确;C的溶解度随温度升高而减小,将T2℃时C的饱和溶液升温到T3℃时,会有晶体析出,溶质的质量会减小,D错误。
6. D 100 mL 0.1 mol/L碳酸钠溶液中含有溶质的物质的量n(Na2CO3)=0.1 mol/L×0.1 L=0.01 mol,则根据元素守恒知需称量Na2CO3·10H2O的质量为m(Na2CO3·10H2O)=0.01 mol×286 g/mol=2.86 g,A错误;不能在容量瓶中溶解固体,称量后的Na2CO3·10H2O应放在烧杯中进行溶解,B错误;容量瓶是准确配制一定体积、一定物质的量浓度溶液的仪器,使用之前不需进行干燥,C错误;配制溶液在最后定容操作时,当加水距离刻度线还有1~2 cm时,应改用胶头滴管缓慢滴加,直至凹液面最低处与刻度线相切,D正确。
7. A 质子数相同的粒子不一定属于同种元素,例如水分子和氨气分子等,①错误;电子数相同的粒子不一定是同种元素,例如Na+和F-,②正确;一种元素不一定只能有一种质量数,例如 H、H、H,质量数分别为1、2、3,③错误;质量数应该是将原子内所有质子和中子的相对质量取近似整数值相加而得到的数值,④错误;质子数相同,电子数也相同的粒子,不可能是一种分子和一种离子,⑤正确;同位素的物理性质不同,化学性质几乎完全相同,⑥错误。故选A。
8. C 0.2 mol/L BaCl2溶液中Cl-的浓度为0.4 mol/L,A错误;气体所处的状况未知,无法计算体积,B错误;17 g H2O2的物质的量==0.5 mol,所含分子总数为0.5NA,C正确;SO2是非电解质,D错误。
9. D 标准状况下,水不是气体,无法计算水的体积,A错误;气体所处的状况未知,无法计算气体的物质的量,B错误;溶液的体积未知,无法计算c(Na+),C错误;稀释前后溶质的物质的量不变,2.0 mol/L×25 mL=c(NaCl)×100 mL,c(NaCl)=0.50 mol/L,则稀释后c(Cl-)=0.50 mol/L,D正确。
10. D 232Th的质量数是232,A错误;Th元素的相对原子质量是Th各种同位素相对原子质量的平均值,B错误;232Th转换成233U是原子核发生变化,属于物理变化,C错误;230Th和 232Th核外电子排布相同,所以化学性质相同,D正确。
11. A 纯碱是Na2CO3,易溶于水,图1所示装置不能实现气体的“即开即停”,不能达到实验目的,A符合题意。
12. B Na2SO4、Na2CO3与过量BaCl2溶液反应,生成的白色沉淀a为BaSO4、BaCO3,A正确;向沉淀中加入过量稀硝酸,不溶的2.33 g白色沉淀c为BaSO4,则n(Na2SO4)=n(BaSO4)==0.01 mol,n(Na2CO3)=n(BaCO3)==0.03 mol,滤液b中n(Na+)=(0.01 mol+0.03 mol) ×2=0.08 mol,B错误;由碳原子守恒知,标准状况下,V(CO2)=0.03 mol×22.4 L/mol=0.672 L=672 mL,C正确;混合物中Na2SO4、Na2CO3的物质的量分别为0.01 mol、0.03 mol,则Na2SO4、Na2CO3的物质的量之比为1∶3,D正确。
13. (1) 100 mL容量瓶、胶头滴管 ②⑤
(2) 偏小 (3) 1.2 mg/cm3
14. (1) 7.9 g 500 mL容量瓶 (2) 除去水中的溶解氧,防止硫代硫酸钠被氧化 (3) 偏大 重新配制
(4) 解:n(Na2S2O3)=c(Na2S2O3)·V(Na2S2O3)
=0.100 mol/L×0.019 2 L=0.001 92 mol
2CuSO4 ~ I2 ~ 2Na2S2O3
2 2
n(CuSO4) 0.001 92 mol
n(CuSO4)=0.001 92 mol
n(CuSO4·5H2O)=n(CuSO4)=0.001 92 mol
m(CuSO4·5H2O)=n(CuSO4·5H2O)·M(CuSO4·5H2O)=0.001 92 mol×250 g/mol=0.480 g
该CuSO4·5H2O样品的纯度=×100%=96.0%
