1.1.3 热化学方程式和燃烧热 教学课件(共25张PPT)高中化学人教版(2019)选修一
文档属性
| 名称 | 1.1.3 热化学方程式和燃烧热 教学课件(共25张PPT)高中化学人教版(2019)选修一 |  | |
| 格式 | pptx | ||
| 文件大小 | 17.9MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2025-07-01 10:27:54 | ||
图片预览







文档简介
(共25张PPT)
1.1.3 热化学方程式和燃烧热
核心素养目标
1.宏观辨识与微观探析:
热化学方程式方面:学生能够从宏观层面理解热化学方程式中各物质的种类及状态,以及反应所伴随的能量变化。能从微观角度,依据化学键的断裂与形成,理解反应热产生的本质原因,并将其与热化学方程式中的能量变化相关联。
燃烧热方面:从宏观角度,学生可以通过观察物质燃烧的现象,如发光、发热等,认识到燃烧是一种剧烈的放热反应。从微观层面,能深入理解燃烧过程中分子内化学键的断裂以及与氧气反应形成新化学键的过程,从而解释燃烧热产生的微观机制。
2.变化观念与平衡思想:
热化学方程式方面:学生要认识到化学反应必然伴随着物质变化和能量变化,热化学方程式正是对这两种变化的综合体现。理解反应热(ΔH)与物质的量、物质状态等因素密切相关,当这些因素改变时,反应热也会相应改变。
核心素养目标
2.变化观念与平衡思想:
燃烧热方面:理解燃烧热是在特定条件下对物质燃烧放热能力的一种定量描述。认识到不同物质具有不同的燃烧热,这是由物质本身的性质决定的。认识到不同物质具有不同的燃烧热,这是由物质本身的性质决定的。在分析燃料的燃烧过程时,能够运用能量守恒的思想,理解燃料燃烧释放的能量与环境之间的能量交换和平衡关系。
3.科学态度与社会责任:
热化学方程式方面:在书写和分析热化学方程式的过程中,培养学生严谨认真的科学态度。要求学生准确标注物质状态、反应热的数值和单位,以及注意化学计量数与反应热的对应关系,任何一个细节的错误都可能导致对反应能量变化的错误理解。通过对热化学方程式的学习,让学生认识到化学科学在定量研究化学反应能量变化方面的重要性和精确性。
燃烧热方面:引导学生关注燃烧热在能源利用和环境保护方面的重要意义。
学习重难点
学习重点
1.热化学方程式的概念,即能表示参加反应物质的量和反应热关系的化学方程式。
2.热化学方程式的书写规则。
3.燃烧热的概念。
4.利用燃烧热的概念进行相关计算
学习难点
1.理解热化学方程式中 ΔH 的单位 “mol ” 的含义。
2.从微观化学键角度理解反应热与热化学方程式的关系。
3.对 “完全燃烧生成稳定氧化物” 的理解。
4.从能量变化的本质角度理解燃烧热的大小与物质结构的关系
课前导入
这些燃料在燃烧时都能放出热量,但它们放出热量的能力一样吗?如何衡量不同燃料燃烧时放出热量的多少呢?
煤炭火力发电
汽油在汽车中的使用
热化学方程式
PART 01
H2 + Cl2 2HCl
1.热化学方程式
通过上一节的学习我们知道,化学反应过程中的反应热与化学键的断裂与形成有关,即能量的变化是以发生变化的物质为基础的,那么,如何更准确地表示一个化学反应的热效应?如何准确地描述物质间的化学反应及其能量变化?下面我们来学习热化学方程式。
思考:下述化学方程式与一般的化学方程式有何不同?
点燃
H2(g) + Cl2 (g) 2HCl(g)
ΔH =
-184.6 kJ/mol
物质变化
能量变化
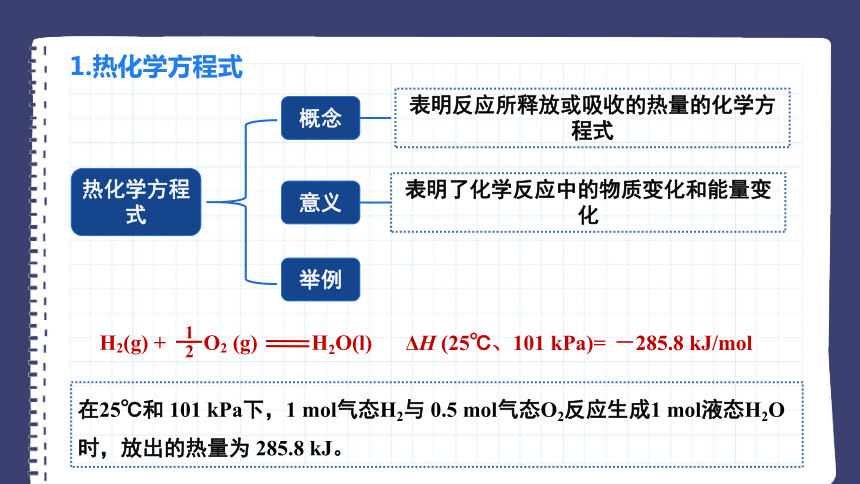
1.热化学方程式
热化学方程式
概念
意义
举例
表明反应所释放或吸收的热量的化学方程式
表明了化学反应中的物质变化和能量变化
H2(g) + O2 (g) H2O(l)
ΔH (25℃、101 kPa)=
-285.8 kJ/mol
1
2
在25℃和 101 kPa下,1 mol气态H2与 0.5 mol气态O2反应生成1 mol液态H2O时,放出的热量为 285.8 kJ。
通常用小写英文字母g、l、s分别表示物质的状态为气态、液态、固态,用aq表示物质为水溶液中的溶质,不再用“↑”“↓”来标记气体生成物和难溶生成物。
(1)写出化学方程式
2.书写热化学方程式的方法
热化学方程式中各物质前的化学计量数不表示分子个数,只表示物质的量,因此,可以用整数或分数来表示。
(2)注明反应物和生成物的聚集状态
H2(g) + 1/2O2(g) = H2O(l) △H =-285.8 kJ /mol
2.书写热化学方程式的方法
PS:
(1)注意纯液体和溶液的区别,如纯水表示为H O(l),NaOH溶液中的NaOH表示为NaOH(aq)。
(2)化学式相同的同素异形体除需注明聚集状态外,还需注明其名称,因为结构不同,物质具有的能量也不同,如热化学方程式中的金刚石应表示为“C(金刚石,s)”。
(3)用△H表示化学反应放出或吸收的热量
2.书写热化学方程式的方法
①放热反应的△H为“-”,吸热反应的△H为“+”。
②书写热化学方程式时,△H必须与化学方程式中的化学计量数相对应,如果化学计量数加倍,则△H也加倍。
下列热化学方程式有什么不同与联系
H2(g) + 1/2O2(g) = H2O(l) △H =-285.8 kJ /mol
2H2(g) + O2(g) = 2H2O(l) △H =-571.6 kJ /mol
(3)用△H表示化学反应放出或吸收的热量
2.书写热化学方程式的方法
对于可逆反应,正逆反应的反应热ΔH数值相等,符号相反。
可逆反应的ΔH 是指物质完全反应时的热效应。
可逆反应实际吸收或放出的热量要小于ΔH的数值!!!
2SO2(g) +O2(g) 2SO3(g) △H= -197kJ/mol
2NH3(g) N2(g)+3H2(g) ΔH = + 92.4kJ/mol
2.书写热化学方程式的方法
(4)注明反应时的温度和压强
温度和压强不同,其△H也不同。但常用的△H的数据,一般都是25℃和101 kPa时的数据,因此可不特别注明。
思考:△H单位中“每摩尔”表示什么?
①H2(g)+O2(g)= H2O(g) △H = – 242 kJ/mol
②2H2(g)+ O2(g) = 2H2O(g) △H = – 484 kJ/mol
2.书写热化学方程式的方法
答:“每摩尔”不是指“每摩尔某物质”,而是指“每摩尔反应”。
对于反应①:1 mol H2(g) 与 mol O2(g)反应生成1 mol H2O(g)表示“每摩尔反应”,“每摩尔反应”放出242 kJ的热量。
对于反应②:2 mol H2(g) 与1 mol O2(g) 反应生成2 mol H2O(g)表示“每摩尔反应”,“每摩尔反应”放出484 kJ的热量。
因此,书写热化学方程式时, △H 必须与化学方程式的化学计量数一一对应。
燃烧热
PART 02
1.燃烧热的概念
101 kPa时,1 mol纯物质完全燃烧生成指定产物时所放出的热量。
单位:kJ·mol-1。
反应条件
限定可燃物的量
生成物不能再燃烧
完全燃烧时,不同元素对应的指定产物:
H
C
S
N
H2O(l)
而不是H2O(g)
CO2 (g)
而不是CO(g)
SO2 (g)
N2 (g)
而不是SO3(g)
燃烧热是一种反应热,用文字叙述燃烧热时,用正值;用△H表示燃烧热时,要加“-”。如H (g)的燃烧热为285.8 kJ/mol或H (g)的燃烧热△H=-285.8 kJ/mol。
2.燃烧热的表述方法
以下为部分燃料的燃烧热,结合燃料本身的特点及燃料的选择条件,讨论以下燃料的应用。
燃料 燃烧热(kJ/mol)
S(s) 296
H2(g) 285.8
CH4(g) 890.3
C2H5OH(l) 1366.8
大气污染,一般不作燃料
不易制备、运输,但无污染且燃烧热较大,是未来新能源
西气东输工程,家庭常用燃料
可再生能源,液体易运输,且燃烧热较大,逐渐被应用于乙醇汽油中
根据以下物质的燃烧热数据,计算相同质量的H2(g)、CH4(g)、C2H5OH(l)
完全燃烧放出的热量,说明用液氢作为火箭燃料的优点。
燃料 燃烧热(kJ/mol) 1 g燃料完全燃烧放出的热量(kJ)
H2(g) 285.8
CH4(g) 890.3
C2H5OH(l) 1366.8
由计算可知,相同质量的上述三种燃料, H2(g) 完全燃烧放出的热量最多,同时, H2(g) 燃烧产物无污染,这是用液氢作为火箭燃料的优点。
142.9
55.6
29.7
2.燃烧热的表述方法
以1 mol可燃物为标准来配平其余物质的化学计量数(可以是分数),同时可燃物要完全燃烧生成指定产物。
3.表示燃烧热的热化学方程式的书写
如:辛烷C8H18燃烧的热化学方程式为:
2C8H18(l)+ 25 O2(g)=16CO2(g)+ 18H2O(l) ΔH= - 11036 kJ·mol-1
表示辛烷C8H18燃烧热的热化学方程式为:
C8H18(l)+ 25/2 O2(g)=8CO2(g)+ 9H2O(l) ΔH= - 5518 kJ·mol-1
“可燃物燃烧的热化学方程式”与“表示可燃物燃烧热的热化学方程式”的意义不同,书写要求不同。前者对任何物质的化学计量数都不作要求,可燃物的化学计量数可为任意值,而后者要求可燃物的化学计量数必须是1。
随堂测试
1.判断正误
(1)反应HCl(g)===H2(g)+Cl2(g) ΔH=+92.3 kJ·mol-1,则H2(g)+Cl2(g)===2HCl(g) ΔH=184.6 kJ·mol-1。( )
(2)NaOH(aq)+HCl(aq) ===NaCl(aq)+H2O(l)ΔH=+57.3 kJ·mol-1。( )
(3)由N2(g)+3H2(g) 2NH3(g) ΔH=-92.2 kJ·mol-1可知,当0.5 mol N2(g)与足量的H2(g)混合充分反应后放出46.1 kJ的热量。( )
×
×
×
随堂测试
2.根据如图所示的各物质能量变化关系,判断下列热化学方程式正确的是( )
A.C(s,金刚石)+O2(g) ===CO2(g) ΔH1=a kJ·mol-1(a<0)
B.C(s,石墨)+O2(g) ===CO2(g) ΔH2=b kJ·mol-1(b>0)
C.C+O2===CO2 ΔH3=c kJ·mol-1(c>0)
D.C(s,金刚石) ===C(s,石墨) ΔH4=d kJ·mol-1(d>0)
A
随堂测试
3.已知充分燃烧a g乙烯气体时生成1 mol二氧化碳气体和1 mol液态水,并放出热量b kJ,则乙烯燃烧的热化学方程式正确的是
( )
A.2C2H4(g)+6O2(g) ===4CO2(g)+4H2O(l) ΔH=-4b kJ/mol
B.C2H4(g)+3O2(g) ===2CO2(g)+2H2O(l) ΔH=+2b kJ/mol
C.2C2H4(g)+6O2(g) ===4CO2(g)+4H2O(l) ΔH=-2b kJ/mol
D.2C2H4(g)+6O2(g) ===4CO2(g)+4H2O(l) ΔH=+b kJ/mol
A
随堂测试
4.已知几种可燃物的燃烧热如表所示:
则2CH4(g) === C2H2(g)+3H2(g)的ΔH为( )
A.+378 kJ·mol-1 B.-378 kJ·mol-1
C.+568 kJ·mol-1 D.-568 kJ·mol-1
可燃物 CH4(g) C2H2(g) H2(g)
燃烧热ΔH /(kJ·mol-1) -890 -1 300 -286
A
随堂测试
5.已知298 K、101 kPa时,H2(g)、CO(g)、C2H5OH(l)、CH4(g)的燃烧热分别为285.8 kJ·mol-1、283.0 kJ·mol-1、1 366.8 kJ·mol-1、890.3 kJ·mol-1。下列热化学方程式的书写正确的是( )
A.2H2(g)+O2(g) ===2H2O(g) ΔH=-571.6 kJ·mol-1
B.2CO(g)+O2(g) ===2CO2(g) ΔH=-283.0 kJ·mol-1
C.C2H5OH(l)+3O2(g) ===2CO2(g)+3H2O(l) ΔH=-1 366.8 kJ
D.CH4(g)+2O2(g) ===CO2(g)+2H2O(l) ΔH=-890.3 kJ·mol-1
D
谢谢观看
1.1.3 热化学方程式和燃烧热
核心素养目标
1.宏观辨识与微观探析:
热化学方程式方面:学生能够从宏观层面理解热化学方程式中各物质的种类及状态,以及反应所伴随的能量变化。能从微观角度,依据化学键的断裂与形成,理解反应热产生的本质原因,并将其与热化学方程式中的能量变化相关联。
燃烧热方面:从宏观角度,学生可以通过观察物质燃烧的现象,如发光、发热等,认识到燃烧是一种剧烈的放热反应。从微观层面,能深入理解燃烧过程中分子内化学键的断裂以及与氧气反应形成新化学键的过程,从而解释燃烧热产生的微观机制。
2.变化观念与平衡思想:
热化学方程式方面:学生要认识到化学反应必然伴随着物质变化和能量变化,热化学方程式正是对这两种变化的综合体现。理解反应热(ΔH)与物质的量、物质状态等因素密切相关,当这些因素改变时,反应热也会相应改变。
核心素养目标
2.变化观念与平衡思想:
燃烧热方面:理解燃烧热是在特定条件下对物质燃烧放热能力的一种定量描述。认识到不同物质具有不同的燃烧热,这是由物质本身的性质决定的。认识到不同物质具有不同的燃烧热,这是由物质本身的性质决定的。在分析燃料的燃烧过程时,能够运用能量守恒的思想,理解燃料燃烧释放的能量与环境之间的能量交换和平衡关系。
3.科学态度与社会责任:
热化学方程式方面:在书写和分析热化学方程式的过程中,培养学生严谨认真的科学态度。要求学生准确标注物质状态、反应热的数值和单位,以及注意化学计量数与反应热的对应关系,任何一个细节的错误都可能导致对反应能量变化的错误理解。通过对热化学方程式的学习,让学生认识到化学科学在定量研究化学反应能量变化方面的重要性和精确性。
燃烧热方面:引导学生关注燃烧热在能源利用和环境保护方面的重要意义。
学习重难点
学习重点
1.热化学方程式的概念,即能表示参加反应物质的量和反应热关系的化学方程式。
2.热化学方程式的书写规则。
3.燃烧热的概念。
4.利用燃烧热的概念进行相关计算
学习难点
1.理解热化学方程式中 ΔH 的单位 “mol ” 的含义。
2.从微观化学键角度理解反应热与热化学方程式的关系。
3.对 “完全燃烧生成稳定氧化物” 的理解。
4.从能量变化的本质角度理解燃烧热的大小与物质结构的关系
课前导入
这些燃料在燃烧时都能放出热量,但它们放出热量的能力一样吗?如何衡量不同燃料燃烧时放出热量的多少呢?
煤炭火力发电
汽油在汽车中的使用
热化学方程式
PART 01
H2 + Cl2 2HCl
1.热化学方程式
通过上一节的学习我们知道,化学反应过程中的反应热与化学键的断裂与形成有关,即能量的变化是以发生变化的物质为基础的,那么,如何更准确地表示一个化学反应的热效应?如何准确地描述物质间的化学反应及其能量变化?下面我们来学习热化学方程式。
思考:下述化学方程式与一般的化学方程式有何不同?
点燃
H2(g) + Cl2 (g) 2HCl(g)
ΔH =
-184.6 kJ/mol
物质变化
能量变化
1.热化学方程式
热化学方程式
概念
意义
举例
表明反应所释放或吸收的热量的化学方程式
表明了化学反应中的物质变化和能量变化
H2(g) + O2 (g) H2O(l)
ΔH (25℃、101 kPa)=
-285.8 kJ/mol
1
2
在25℃和 101 kPa下,1 mol气态H2与 0.5 mol气态O2反应生成1 mol液态H2O时,放出的热量为 285.8 kJ。
通常用小写英文字母g、l、s分别表示物质的状态为气态、液态、固态,用aq表示物质为水溶液中的溶质,不再用“↑”“↓”来标记气体生成物和难溶生成物。
(1)写出化学方程式
2.书写热化学方程式的方法
热化学方程式中各物质前的化学计量数不表示分子个数,只表示物质的量,因此,可以用整数或分数来表示。
(2)注明反应物和生成物的聚集状态
H2(g) + 1/2O2(g) = H2O(l) △H =-285.8 kJ /mol
2.书写热化学方程式的方法
PS:
(1)注意纯液体和溶液的区别,如纯水表示为H O(l),NaOH溶液中的NaOH表示为NaOH(aq)。
(2)化学式相同的同素异形体除需注明聚集状态外,还需注明其名称,因为结构不同,物质具有的能量也不同,如热化学方程式中的金刚石应表示为“C(金刚石,s)”。
(3)用△H表示化学反应放出或吸收的热量
2.书写热化学方程式的方法
①放热反应的△H为“-”,吸热反应的△H为“+”。
②书写热化学方程式时,△H必须与化学方程式中的化学计量数相对应,如果化学计量数加倍,则△H也加倍。
下列热化学方程式有什么不同与联系
H2(g) + 1/2O2(g) = H2O(l) △H =-285.8 kJ /mol
2H2(g) + O2(g) = 2H2O(l) △H =-571.6 kJ /mol
(3)用△H表示化学反应放出或吸收的热量
2.书写热化学方程式的方法
对于可逆反应,正逆反应的反应热ΔH数值相等,符号相反。
可逆反应的ΔH 是指物质完全反应时的热效应。
可逆反应实际吸收或放出的热量要小于ΔH的数值!!!
2SO2(g) +O2(g) 2SO3(g) △H= -197kJ/mol
2NH3(g) N2(g)+3H2(g) ΔH = + 92.4kJ/mol
2.书写热化学方程式的方法
(4)注明反应时的温度和压强
温度和压强不同,其△H也不同。但常用的△H的数据,一般都是25℃和101 kPa时的数据,因此可不特别注明。
思考:△H单位中“每摩尔”表示什么?
①H2(g)+O2(g)= H2O(g) △H = – 242 kJ/mol
②2H2(g)+ O2(g) = 2H2O(g) △H = – 484 kJ/mol
2.书写热化学方程式的方法
答:“每摩尔”不是指“每摩尔某物质”,而是指“每摩尔反应”。
对于反应①:1 mol H2(g) 与 mol O2(g)反应生成1 mol H2O(g)表示“每摩尔反应”,“每摩尔反应”放出242 kJ的热量。
对于反应②:2 mol H2(g) 与1 mol O2(g) 反应生成2 mol H2O(g)表示“每摩尔反应”,“每摩尔反应”放出484 kJ的热量。
因此,书写热化学方程式时, △H 必须与化学方程式的化学计量数一一对应。
燃烧热
PART 02
1.燃烧热的概念
101 kPa时,1 mol纯物质完全燃烧生成指定产物时所放出的热量。
单位:kJ·mol-1。
反应条件
限定可燃物的量
生成物不能再燃烧
完全燃烧时,不同元素对应的指定产物:
H
C
S
N
H2O(l)
而不是H2O(g)
CO2 (g)
而不是CO(g)
SO2 (g)
N2 (g)
而不是SO3(g)
燃烧热是一种反应热,用文字叙述燃烧热时,用正值;用△H表示燃烧热时,要加“-”。如H (g)的燃烧热为285.8 kJ/mol或H (g)的燃烧热△H=-285.8 kJ/mol。
2.燃烧热的表述方法
以下为部分燃料的燃烧热,结合燃料本身的特点及燃料的选择条件,讨论以下燃料的应用。
燃料 燃烧热(kJ/mol)
S(s) 296
H2(g) 285.8
CH4(g) 890.3
C2H5OH(l) 1366.8
大气污染,一般不作燃料
不易制备、运输,但无污染且燃烧热较大,是未来新能源
西气东输工程,家庭常用燃料
可再生能源,液体易运输,且燃烧热较大,逐渐被应用于乙醇汽油中
根据以下物质的燃烧热数据,计算相同质量的H2(g)、CH4(g)、C2H5OH(l)
完全燃烧放出的热量,说明用液氢作为火箭燃料的优点。
燃料 燃烧热(kJ/mol) 1 g燃料完全燃烧放出的热量(kJ)
H2(g) 285.8
CH4(g) 890.3
C2H5OH(l) 1366.8
由计算可知,相同质量的上述三种燃料, H2(g) 完全燃烧放出的热量最多,同时, H2(g) 燃烧产物无污染,这是用液氢作为火箭燃料的优点。
142.9
55.6
29.7
2.燃烧热的表述方法
以1 mol可燃物为标准来配平其余物质的化学计量数(可以是分数),同时可燃物要完全燃烧生成指定产物。
3.表示燃烧热的热化学方程式的书写
如:辛烷C8H18燃烧的热化学方程式为:
2C8H18(l)+ 25 O2(g)=16CO2(g)+ 18H2O(l) ΔH= - 11036 kJ·mol-1
表示辛烷C8H18燃烧热的热化学方程式为:
C8H18(l)+ 25/2 O2(g)=8CO2(g)+ 9H2O(l) ΔH= - 5518 kJ·mol-1
“可燃物燃烧的热化学方程式”与“表示可燃物燃烧热的热化学方程式”的意义不同,书写要求不同。前者对任何物质的化学计量数都不作要求,可燃物的化学计量数可为任意值,而后者要求可燃物的化学计量数必须是1。
随堂测试
1.判断正误
(1)反应HCl(g)===H2(g)+Cl2(g) ΔH=+92.3 kJ·mol-1,则H2(g)+Cl2(g)===2HCl(g) ΔH=184.6 kJ·mol-1。( )
(2)NaOH(aq)+HCl(aq) ===NaCl(aq)+H2O(l)ΔH=+57.3 kJ·mol-1。( )
(3)由N2(g)+3H2(g) 2NH3(g) ΔH=-92.2 kJ·mol-1可知,当0.5 mol N2(g)与足量的H2(g)混合充分反应后放出46.1 kJ的热量。( )
×
×
×
随堂测试
2.根据如图所示的各物质能量变化关系,判断下列热化学方程式正确的是( )
A.C(s,金刚石)+O2(g) ===CO2(g) ΔH1=a kJ·mol-1(a<0)
B.C(s,石墨)+O2(g) ===CO2(g) ΔH2=b kJ·mol-1(b>0)
C.C+O2===CO2 ΔH3=c kJ·mol-1(c>0)
D.C(s,金刚石) ===C(s,石墨) ΔH4=d kJ·mol-1(d>0)
A
随堂测试
3.已知充分燃烧a g乙烯气体时生成1 mol二氧化碳气体和1 mol液态水,并放出热量b kJ,则乙烯燃烧的热化学方程式正确的是
( )
A.2C2H4(g)+6O2(g) ===4CO2(g)+4H2O(l) ΔH=-4b kJ/mol
B.C2H4(g)+3O2(g) ===2CO2(g)+2H2O(l) ΔH=+2b kJ/mol
C.2C2H4(g)+6O2(g) ===4CO2(g)+4H2O(l) ΔH=-2b kJ/mol
D.2C2H4(g)+6O2(g) ===4CO2(g)+4H2O(l) ΔH=+b kJ/mol
A
随堂测试
4.已知几种可燃物的燃烧热如表所示:
则2CH4(g) === C2H2(g)+3H2(g)的ΔH为( )
A.+378 kJ·mol-1 B.-378 kJ·mol-1
C.+568 kJ·mol-1 D.-568 kJ·mol-1
可燃物 CH4(g) C2H2(g) H2(g)
燃烧热ΔH /(kJ·mol-1) -890 -1 300 -286
A
随堂测试
5.已知298 K、101 kPa时,H2(g)、CO(g)、C2H5OH(l)、CH4(g)的燃烧热分别为285.8 kJ·mol-1、283.0 kJ·mol-1、1 366.8 kJ·mol-1、890.3 kJ·mol-1。下列热化学方程式的书写正确的是( )
A.2H2(g)+O2(g) ===2H2O(g) ΔH=-571.6 kJ·mol-1
B.2CO(g)+O2(g) ===2CO2(g) ΔH=-283.0 kJ·mol-1
C.C2H5OH(l)+3O2(g) ===2CO2(g)+3H2O(l) ΔH=-1 366.8 kJ
D.CH4(g)+2O2(g) ===CO2(g)+2H2O(l) ΔH=-890.3 kJ·mol-1
D
谢谢观看
