1.1.2 反应热与焓变 教学课件(共24张PPT)高中化学人教版(2019)选修一
文档属性
| 名称 | 1.1.2 反应热与焓变 教学课件(共24张PPT)高中化学人教版(2019)选修一 |  | |
| 格式 | pptx | ||
| 文件大小 | 19.2MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2025-07-01 10:28:05 | ||
图片预览






文档简介
(共24张PPT)
1.1.2 反应热与焓变
核心素养目标
1.宏观辨识与微观探析:
宏观层面:通过观察化学反应中热量的释放或吸收现象,识别反应热的宏观表现,建立 “热量变化→反应类型” 的关联认知。
微观层面:从化学键断裂与形成的角度,理解反应热的本质是微观粒子能量变化的宏观体现,建立 “化学键能变化→焓变(ΔH)→宏观热效应” 的分析路径。
2.变化观念与平衡思想:
能量变化观念:认识化学反应必然伴随能量变化,理解反应热是能量变化的定量表征),建立 “物质变化与能量变化统一” 的化学思维。
3.科学态度与社会责任:
科学探究态度:通过中和热测定实验,培养严谨的实验操作习惯和数据处理能力,体会定量实验对化学研究的重要性。
学习重难点
学习重点
1.反应热的概念:明确等温条件下反应热的定义及表示方法。
2.焓变与反应热的关系:理解等压条件下 ΔH = 反应热,能用化学键键能计算简单反应的焓变。
3.中和热测定原理:掌握实验操作步骤和误差分析方法
学习难点
1.焓(H)的抽象概念:从内能角度理解焓的物理意义,建立 “焓变(ΔH)= 生成物总焓 - 反应物总焓” 的模型。
2.微观键能与宏观焓变的关联:通过具体反应的键能数据计算 ΔH,突破 “微观能量变化量化为宏观热效应” 的思维障碍。
课前导入
飞机飞的高,全靠燃油烧,来回狂飞几千里,热量独领风骚。
飞机的运行动力来源于航空燃油的燃烧,不同燃料燃烧放出的热量不同,我们如何定量地描述这些过程中的热量变化呢?
反应热与焓变
PART 01
化学反应为什么会产生反应热?
这是因为化学反应前后体系的内能(符号为U)发生了变化。
1.焓变
(1)内能:是体系内物质的各种能量的总和,受温度、压强和物质的聚集状态等影响。
(2)焓:是与内能有关的物理量,符号为 H。
1.焓变
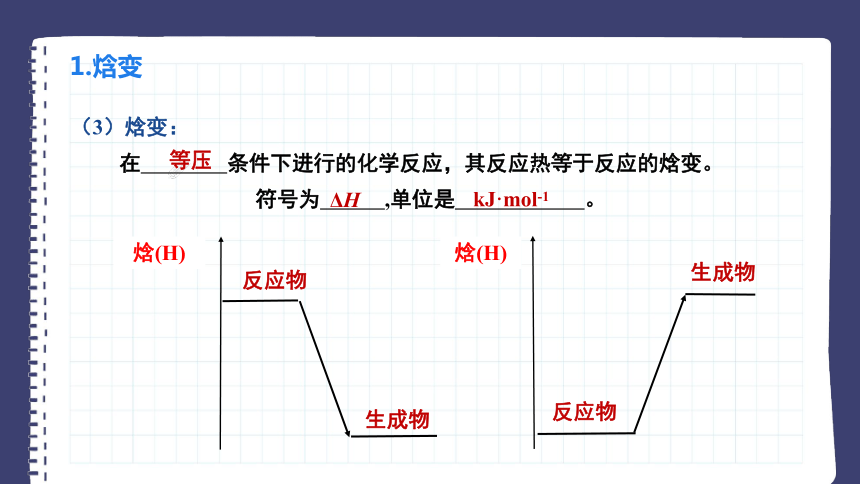
(3)焓变:
在 条件下进行的化学反应,其反应热等于反应的焓变。
符号为 ,单位是 。
等压
ΔH
kJ·mol-1
内能(U)
焓(H)
反应物
生成物
内能(U)
反应物
生成物
焓(H)
2.反应热和焓变的比较
反应热 焓变
不同点 概念
相同点 单位 “+”“-”的意义 数据来源 联系 注意 在等温条件下,化学反应体系向环境释放或从环境吸收的热量
化学反应中生成物的总焓与反应物的总焓之差
kJ/mol(或kJ·mol-1)
“+”表示反应吸热,“-”表示反应放热
实验测得或用已知数据计算
在等压条件下(如在敞口容器中)进行的化学反应,其反应热等于反应的焓变
(1)任何化学反应都有反应热。
(2)根据反应热或焓变可以判断一个化学反应是吸热反应还是放热反应。
(3)物理变化(如物质三态之间的变化)中的热量变化不是反应热
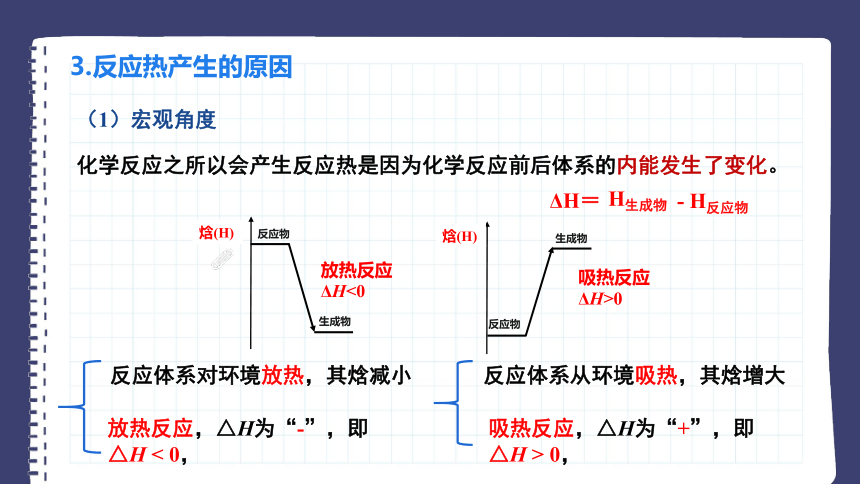
(1)宏观角度
3.反应热产生的原因
化学反应之所以会产生反应热是因为化学反应前后体系的内能发生了变化。
ΔH=
H生成物
- H反应物
焓(H)
反应物
生成物
放热反应
ΔH<0
反应物
生成物
吸热反应
ΔH>0
焓(H)
放热反应,△H为“-”,即△H < 0,
反应体系对环境放热,其焓减小
吸热反应,△H为“+”,即△H > 0,
反应体系从环境吸热,其焓增大
3.反应热产生的原因
(2)微观角度
化学反应的本质:
旧化学键的断裂 和 新化学键的形成
吸收能量
放出能量
焓变计算公式: H= E断键- E成键=E反键总- E生键总
化学键的断裂和形成时的能量变化是化学反应中能量变化的主要原因。
3.反应热产生的原因
以H2(g)+Cl2(g)==== 2HCl(g)为例
断开 1mol H—H键吸收能量436kJ
断开 1mol Cl—Cl键吸收能量243kJ
形成 2mol H—Cl键放出能量 862kJ
①断键吸能(E吸)
②成键放能(E放)
该反应的反应热计算为(放热反应):
ΔH=(436+243)-(431+431)
=-184.6 kJ/mol
反应热 ΔH= 。
E1 - E2
E1:反应物断裂化学键吸收的总能量,
E2:生成物形成化学键放出的总能量,
吸收能量 >放出能量 ΔH > 0
吸收能量 <放出能量 ΔH < 0
反应物
生成物
ΔH
E1
E2
H
3.反应热产生的原因
【例1】化学反应N2(g)+3H2(g) 2NH3(g)的能量变化如图所示:
已知N≡N、N—H的键能分别为946 kJ·mol-1、391 kJ·mol-1
(1)该反应为______反应(填“吸热”或“放热”)。
(2)拆开1 mol H2中化学键所需能量为______ kJ。
(3)该反应的反应热ΔH=______________。
放热
436
- 92 kJ·mol-1
3.反应热产生的原因
应用:物质稳定性判断
① 键能越大,破坏该化学键需要的能量越高,该化学键越难断裂,所以物质越稳定。
② 物质总能量越低,物质越稳定。
【例题】C(石墨s)= C(金刚石s) ΔH = +1.9kJ/mol,石墨、金刚石哪个更稳定?试分析物质稳定性与键能的关系。
H > 0,吸热反应,
石墨键能大,总能量低,更稳定。
金刚石
石墨
3.反应热产生的原因
4.吸热反应与放热反应
放热反应 吸热反应
△H表现形式
物质总能量变化
键能变化
联系 △H<0或△H为“-”
△H>0或△H为“+”
生成物的总能量<反应物的总能量
生成物的总能量>反应物的总能量
生成物总键能>反应物总键能
生成物总键能<反应物总键能
键能越大,物质能量越低,越稳定,反之键能越小,物质能量越高,越不稳定
4.吸热反应与放热反应
常见的吸热反应
常见的放热反应
①大多数分解反应
②某些特殊的化合反应
例:H2 (g) +I2 (g) 2HI(g) △H>0
N2 (g) +O2 (g) 2NO (g) △H>0
③某些特殊的置换反应
H2(g)+CuO(s) Cu(s)+H2O(g) △H>0
④Ba(OH)2 8H2O与NH4Cl的反应
△
放电
△
①燃烧
②中和反应
③金属与酸的反应
④化合反应一般为放热反应
(除C+CO2 2CO、 H2 +I2 2HI、N2 +O2 2NO等)
⑤中学所学的置换反应多为放热反应
高温
△
放电
5.研究反应热的意义
反应热的应用
热能综
合利用
工艺条
件优化
理论
分析
给吸热反应加热;
给放热反应及时转移热量;
热能循环利用。
反应热估算
键能估算
能耗……
归纳总结
化学反应热效应
表征
反应热
恒压反应热 = 焓变 ΔH
宏观
微观
原因
体系内能的变化
放热反应 ΔH <0
吸热反应 ΔH >0
断键吸热,成键放热
ΔH = E(反应物键能和) -E(生成物键能和)
应用
热能利用
工艺操作
反应的可行性
选择反应条件
随堂测试
1.判断正误
(1)物质发生化学反应一定伴随着能量变化,伴随能量变化的物质变化一定都是化学变化。( )
(2)放热反应有的需要加热才能进行,有些吸热反应常温下即可进行。
( )
(3)焓变的大小与物质的种类、数量、聚集状态以及温度、压强等有关。
( )
(4)比较热量的多少是比较绝对值,而比较焓变的大小则是比较代数值(包含正负号)。( )
×
√
√
√
随堂测试
2.下列反应中生成物的总能量大于反应物的总能量的是( )
A.氧化钙溶于水
B.乙醇燃烧
C.铝粉与氧化铁粉末反应
D.碳酸钙受热分解
D
随堂测试
3.已知化学反应A2(g)+B2(g) ===2AB(g)的能量变化如图所示,判断下列说法正确的是( )
A.该反应的ΔH=+(a-b) kJ·mol-1
B.1 mol A2(g)与1 mol B2(g)反应生成2 mol AB(g),
吸收b kJ能量
C.该反应中反应物的总能量高于生成物的总能量
D.断裂1 mol A2(g)中A—A和1 mol B2(g)中B—B,放出a kJ能量
A
随堂测试
4.常温下,1 mol化学键形成气态原子所需要的能量用E表示。结合表中信息,判断下列说法不正确的是( )
A.431 kJ·mol-1>E(H—Br)>298 kJ·mol-1
B.表中最稳定的共价键是H—F
C.H2(g)―→2H(g) ΔH=+436 kJ·mol-1
D.H2(g)+F2(g) ===2HF(g) ΔH=-25 kJ·mol-1
共价键 H—H F—F H—F H—Cl H—I
E/(kJ·mol-1) 436 157 568 431 298
D
随堂测试
5.下列变化中属于吸热反应的是( )
①液态水汽化 ②CaCO3高温分解 ③CO2(g)+C(s)2CO(g)
④Ba(OH)2·8H2O与固体NH4Cl混合 ⑤C(s)+H2O(g)CO(g)+H2(g) ⑥Al与盐酸反应
A.②③④⑤ B.①②③④⑤
C.①②④⑥ D.①④⑤
A
谢谢观看
1.1.2 反应热与焓变
核心素养目标
1.宏观辨识与微观探析:
宏观层面:通过观察化学反应中热量的释放或吸收现象,识别反应热的宏观表现,建立 “热量变化→反应类型” 的关联认知。
微观层面:从化学键断裂与形成的角度,理解反应热的本质是微观粒子能量变化的宏观体现,建立 “化学键能变化→焓变(ΔH)→宏观热效应” 的分析路径。
2.变化观念与平衡思想:
能量变化观念:认识化学反应必然伴随能量变化,理解反应热是能量变化的定量表征),建立 “物质变化与能量变化统一” 的化学思维。
3.科学态度与社会责任:
科学探究态度:通过中和热测定实验,培养严谨的实验操作习惯和数据处理能力,体会定量实验对化学研究的重要性。
学习重难点
学习重点
1.反应热的概念:明确等温条件下反应热的定义及表示方法。
2.焓变与反应热的关系:理解等压条件下 ΔH = 反应热,能用化学键键能计算简单反应的焓变。
3.中和热测定原理:掌握实验操作步骤和误差分析方法
学习难点
1.焓(H)的抽象概念:从内能角度理解焓的物理意义,建立 “焓变(ΔH)= 生成物总焓 - 反应物总焓” 的模型。
2.微观键能与宏观焓变的关联:通过具体反应的键能数据计算 ΔH,突破 “微观能量变化量化为宏观热效应” 的思维障碍。
课前导入
飞机飞的高,全靠燃油烧,来回狂飞几千里,热量独领风骚。
飞机的运行动力来源于航空燃油的燃烧,不同燃料燃烧放出的热量不同,我们如何定量地描述这些过程中的热量变化呢?
反应热与焓变
PART 01
化学反应为什么会产生反应热?
这是因为化学反应前后体系的内能(符号为U)发生了变化。
1.焓变
(1)内能:是体系内物质的各种能量的总和,受温度、压强和物质的聚集状态等影响。
(2)焓:是与内能有关的物理量,符号为 H。
1.焓变
(3)焓变:
在 条件下进行的化学反应,其反应热等于反应的焓变。
符号为 ,单位是 。
等压
ΔH
kJ·mol-1
内能(U)
焓(H)
反应物
生成物
内能(U)
反应物
生成物
焓(H)
2.反应热和焓变的比较
反应热 焓变
不同点 概念
相同点 单位 “+”“-”的意义 数据来源 联系 注意 在等温条件下,化学反应体系向环境释放或从环境吸收的热量
化学反应中生成物的总焓与反应物的总焓之差
kJ/mol(或kJ·mol-1)
“+”表示反应吸热,“-”表示反应放热
实验测得或用已知数据计算
在等压条件下(如在敞口容器中)进行的化学反应,其反应热等于反应的焓变
(1)任何化学反应都有反应热。
(2)根据反应热或焓变可以判断一个化学反应是吸热反应还是放热反应。
(3)物理变化(如物质三态之间的变化)中的热量变化不是反应热
(1)宏观角度
3.反应热产生的原因
化学反应之所以会产生反应热是因为化学反应前后体系的内能发生了变化。
ΔH=
H生成物
- H反应物
焓(H)
反应物
生成物
放热反应
ΔH<0
反应物
生成物
吸热反应
ΔH>0
焓(H)
放热反应,△H为“-”,即△H < 0,
反应体系对环境放热,其焓减小
吸热反应,△H为“+”,即△H > 0,
反应体系从环境吸热,其焓增大
3.反应热产生的原因
(2)微观角度
化学反应的本质:
旧化学键的断裂 和 新化学键的形成
吸收能量
放出能量
焓变计算公式: H= E断键- E成键=E反键总- E生键总
化学键的断裂和形成时的能量变化是化学反应中能量变化的主要原因。
3.反应热产生的原因
以H2(g)+Cl2(g)==== 2HCl(g)为例
断开 1mol H—H键吸收能量436kJ
断开 1mol Cl—Cl键吸收能量243kJ
形成 2mol H—Cl键放出能量 862kJ
①断键吸能(E吸)
②成键放能(E放)
该反应的反应热计算为(放热反应):
ΔH=(436+243)-(431+431)
=-184.6 kJ/mol
反应热 ΔH= 。
E1 - E2
E1:反应物断裂化学键吸收的总能量,
E2:生成物形成化学键放出的总能量,
吸收能量 >放出能量 ΔH > 0
吸收能量 <放出能量 ΔH < 0
反应物
生成物
ΔH
E1
E2
H
3.反应热产生的原因
【例1】化学反应N2(g)+3H2(g) 2NH3(g)的能量变化如图所示:
已知N≡N、N—H的键能分别为946 kJ·mol-1、391 kJ·mol-1
(1)该反应为______反应(填“吸热”或“放热”)。
(2)拆开1 mol H2中化学键所需能量为______ kJ。
(3)该反应的反应热ΔH=______________。
放热
436
- 92 kJ·mol-1
3.反应热产生的原因
应用:物质稳定性判断
① 键能越大,破坏该化学键需要的能量越高,该化学键越难断裂,所以物质越稳定。
② 物质总能量越低,物质越稳定。
【例题】C(石墨s)= C(金刚石s) ΔH = +1.9kJ/mol,石墨、金刚石哪个更稳定?试分析物质稳定性与键能的关系。
H > 0,吸热反应,
石墨键能大,总能量低,更稳定。
金刚石
石墨
3.反应热产生的原因
4.吸热反应与放热反应
放热反应 吸热反应
△H表现形式
物质总能量变化
键能变化
联系 △H<0或△H为“-”
△H>0或△H为“+”
生成物的总能量<反应物的总能量
生成物的总能量>反应物的总能量
生成物总键能>反应物总键能
生成物总键能<反应物总键能
键能越大,物质能量越低,越稳定,反之键能越小,物质能量越高,越不稳定
4.吸热反应与放热反应
常见的吸热反应
常见的放热反应
①大多数分解反应
②某些特殊的化合反应
例:H2 (g) +I2 (g) 2HI(g) △H>0
N2 (g) +O2 (g) 2NO (g) △H>0
③某些特殊的置换反应
H2(g)+CuO(s) Cu(s)+H2O(g) △H>0
④Ba(OH)2 8H2O与NH4Cl的反应
△
放电
△
①燃烧
②中和反应
③金属与酸的反应
④化合反应一般为放热反应
(除C+CO2 2CO、 H2 +I2 2HI、N2 +O2 2NO等)
⑤中学所学的置换反应多为放热反应
高温
△
放电
5.研究反应热的意义
反应热的应用
热能综
合利用
工艺条
件优化
理论
分析
给吸热反应加热;
给放热反应及时转移热量;
热能循环利用。
反应热估算
键能估算
能耗……
归纳总结
化学反应热效应
表征
反应热
恒压反应热 = 焓变 ΔH
宏观
微观
原因
体系内能的变化
放热反应 ΔH <0
吸热反应 ΔH >0
断键吸热,成键放热
ΔH = E(反应物键能和) -E(生成物键能和)
应用
热能利用
工艺操作
反应的可行性
选择反应条件
随堂测试
1.判断正误
(1)物质发生化学反应一定伴随着能量变化,伴随能量变化的物质变化一定都是化学变化。( )
(2)放热反应有的需要加热才能进行,有些吸热反应常温下即可进行。
( )
(3)焓变的大小与物质的种类、数量、聚集状态以及温度、压强等有关。
( )
(4)比较热量的多少是比较绝对值,而比较焓变的大小则是比较代数值(包含正负号)。( )
×
√
√
√
随堂测试
2.下列反应中生成物的总能量大于反应物的总能量的是( )
A.氧化钙溶于水
B.乙醇燃烧
C.铝粉与氧化铁粉末反应
D.碳酸钙受热分解
D
随堂测试
3.已知化学反应A2(g)+B2(g) ===2AB(g)的能量变化如图所示,判断下列说法正确的是( )
A.该反应的ΔH=+(a-b) kJ·mol-1
B.1 mol A2(g)与1 mol B2(g)反应生成2 mol AB(g),
吸收b kJ能量
C.该反应中反应物的总能量高于生成物的总能量
D.断裂1 mol A2(g)中A—A和1 mol B2(g)中B—B,放出a kJ能量
A
随堂测试
4.常温下,1 mol化学键形成气态原子所需要的能量用E表示。结合表中信息,判断下列说法不正确的是( )
A.431 kJ·mol-1>E(H—Br)>298 kJ·mol-1
B.表中最稳定的共价键是H—F
C.H2(g)―→2H(g) ΔH=+436 kJ·mol-1
D.H2(g)+F2(g) ===2HF(g) ΔH=-25 kJ·mol-1
共价键 H—H F—F H—F H—Cl H—I
E/(kJ·mol-1) 436 157 568 431 298
D
随堂测试
5.下列变化中属于吸热反应的是( )
①液态水汽化 ②CaCO3高温分解 ③CO2(g)+C(s)2CO(g)
④Ba(OH)2·8H2O与固体NH4Cl混合 ⑤C(s)+H2O(g)CO(g)+H2(g) ⑥Al与盐酸反应
A.②③④⑤ B.①②③④⑤
C.①②④⑥ D.①④⑤
A
谢谢观看
