3.3.2 影响盐类水解的因素 教学课件(共21张PPT)高中化学人教版(2019)选修一
文档属性
| 名称 | 3.3.2 影响盐类水解的因素 教学课件(共21张PPT)高中化学人教版(2019)选修一 |  | |
| 格式 | pptx | ||
| 文件大小 | 23.1MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2025-07-01 10:32:10 | ||
图片预览








文档简介
(共21张PPT)
3.3.2 影响盐类水解的因素
核心素养目标
1.宏观辨识与微观探析:
宏观层面:学生能通过实验现象,如观察不同盐溶液在改变温度、浓度、外加酸碱等条件下,溶液颜色、浑浊程度的变化,直观感受盐类水解平衡的移动。
微观层面:从微观粒子相互作用的角度深入理解影响盐类水解的因素。
2.变化观念与平衡思想:
动态平衡观念:认识到盐类水解平衡与化学平衡、电离平衡一样,是动态平衡。
定量平衡思想:借助盐类水解平衡常数,从定量角度理解盐类水解程度与外界因素的关系。
3.科学态度与社会责任:
科学探究精神:在探究影响盐类水解因素的实验过程中,培养学生严谨的科学态度和规范的实验操作技能。
社会应用意识:关注盐类水解在日常生活、生产实践和环境保护等领域的广泛应用,认识到化学知识对解决实际问题的重要价值。
学习重难点
学习重点
1.影响盐类水解平衡的因素:全面掌握影响盐类水解平衡的内因和外因。
2.盐类水解原理的应用:学会运用盐类水解原理解决实际问题。
学习难点
1.盐类水解平衡移动的定量分析:从定量角度理解盐类水解平衡移动过程中溶液中粒子浓度的变化以及水解常数的应用对学生来说具有一定难度。
2.盐类水解在复杂体系中的应用:在实际情境中,往往涉及多种平衡相互影响的复杂体系,学生难以运用盐类水解知识进行综合分析。
课前导入
妈妈用热的纯碱溶液清洗油污效果更好,纯碱本身是盐,它的溶液为什么呈碱性?为什么加热后碱性会增强,去污能力也变强了呢?
反应条件对水解平衡的影响
PART 01
1.反应条件对水解平衡的影响
盐类的水解反应一般是可逆反应,在一定条件下可达到化学平衡,该化学平衡通常叫做水解平衡。若改变条件,水解平衡就会发生移动,遵循勒夏特列原理。
【提出问题】
(1)FeCl3溶液呈酸性还是碱性?写出FeCl3发生水解的离子方程式。
(2)从反应条件考虑,影响FeCl3水解平衡的因素可能有哪些?
Fe3+ + 3H2O Fe(OH)3 + 3H+
呈酸性
1.反应条件对水解平衡的影响
【实验探究】
(1)现有以下实验用品:
试管、试管夹、试管架、胶头滴管、pH计、药匙、酒精灯、火柴;
0.01 mol/L FeCl3溶液、FeCl3晶体、浓盐酸、浓氢氧化钠溶液。
(2)实验方案
请根据所提供的实验用品(可自行增加),参照下表设计实验,完成实验并记录现象。应用平衡移动原理对实验现象进行解释。
1.反应条件对水解平衡的影响
影响因素 实验现象 解释
温度
反应物的浓度
生成物的浓度
试管中溶液的颜色明显加深,溶液的pH减小。
水解过程是吸热的,加热使水解平衡向正反应方向移动,生成更多的Fe(OH)3,颜色加深,c(H+)增大,pH减小。
试管中溶液的颜色变深。
增大c(Fe3+),水解平衡正向移动,溶液颜色变深
试管中溶液的颜色变浅。
增大c(H+),水解平衡逆向移动,溶液颜色变浅
1.反应条件对水解平衡的影响
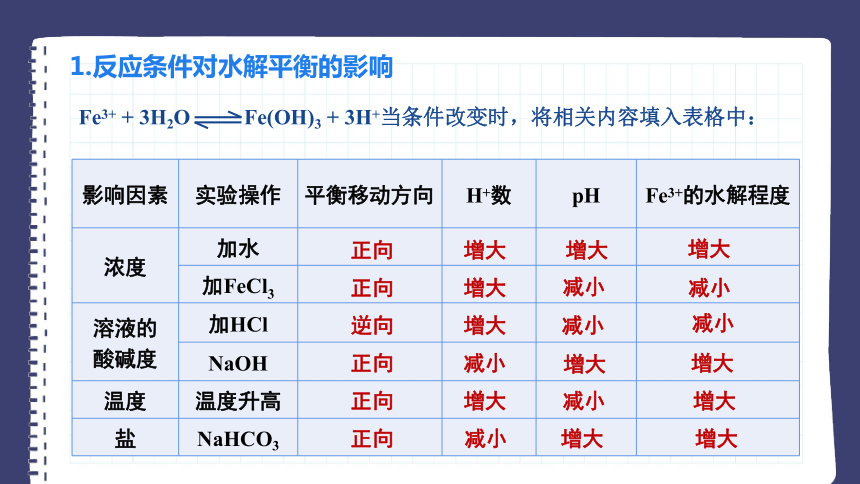
Fe3+ + 3H2O Fe(OH)3 + 3H+当条件改变时,将相关内容填入表格中:
影响因素 实验操作 平衡移动方向 H+数 pH Fe3+的水解程度
浓度 加水
加FeCl3
溶液的 酸碱度 加HCl
NaOH
温度 温度升高
盐 NaHCO3
正向
增大
增大
增大
正向
增大
减小
减小
逆向
增大
减小
减小
正向
减小
增大
增大
正向
增大
减小
增大
正向
减小
增大
增大
影响盐类水解平衡的因素
PART 02
1.影响盐类水解平衡的因素
(1)内因——盐本身的性质
构成盐的酸根离子对应的弱酸酸性越弱(或阳离子对应的弱碱碱性越弱),即越难电离(电离常数越小),该盐的水解程度越大。
强碱弱酸盐(MA)的水解:
MA A- + M+
H2O H+ + OH-
HA(弱酸)
+
A-结合H+的能力越强
HA酸性越弱即Ka越小
A-水解程度就越大
越弱越水解
1.影响盐类水解平衡的因素
(1)内因——盐本身的性质
如相同温度下,等浓度的CH3COONa与NaClO溶液的碱性谁更强?
越弱越水解
HClO
CH3COOH
酸性:
<
NaClO
CH3COONa
碱性:
>
识记常见弱酸的酸性顺序:
H2SO3 >H3PO4>HF>CH3COOH>H2CO3>HClO
1.影响盐类水解平衡的因素
(2)外因
① 温度:盐类的水解反应是吸热反应,因此升高温度促进盐类的水解,降低温度抑制盐类的水解。
② 浓度:增大盐溶液的浓度,水解平衡正向移动,但水解程度减小;加水稀释可以促进水解,水解平衡正向移动,水解程度增大。
越热越水解
越稀越水解
③ 外加酸、碱、盐:
加酸:抑制弱碱阳离子的水解;加碱:抑制弱酸阴离子的水解;
加能水解的盐:
取决于两种盐的水解形式
相同,相互抑制
相反,相互促进
盐的水解常数
PART 03
1.盐的水解常数
(1)盐的水解常数表达式
若MA为强碱弱酸盐,则其水解的离子方程式为:
A- + H2O HA + OH-
该反应的平衡常数Kh= ,Kh称为盐的水解常数。
c(HA)·c(OH-)
c(A-)
水解平衡常数是描述能水解的盐水解平衡的主要参数。
它只受温度影响,因水解过程是吸热过程,故它随温度的升高而增大。
1.影响盐类水解平衡的因素
(2)Kh与Ka(Kb)、Kw的关系
① 若常温下一元弱酸HA的电离平衡常数为Ka,水的离子积常数为Kw。请分析水溶液中NaA的Kh与Ka和Kw间的关系。
两式相乘
Ka
Kh
×
= Kw
同理:
得到:
Ka=
Kh=
∴
Kw
Ka
Kh=
Kw
Kb
Kh=
A- + H2O HA + OH-
HA A- + H+
又:
1.影响盐类水解平衡的因素
(2)水的离子积常数为Kw,二元弱酸H2CO3的电离常数为Ka1、Ka2,则分别分析Na2CO3、NaHCO3的Kh与Ka和Kw间的关系。
Na2CO3溶液:Kh1=NaHCO3溶液:Kh2=
NaHCO3:HCO3- + H2O H2CO3 + OH-
Kh2=
Ka2=
电离:H2CO3 H+ + HCO3-
HCO3- H+ + CO32-
Ka1=
Na2CO3: CO32- + H2O HCO3- + OH-
Kh1=
随堂训练
1.比较下列溶液的pH大小(填“>”“<”或“=”)
(1)0.2mol/LNH4Cl溶液____0.1mol/LNH4Cl溶液
(2)0.1mol/LNa2CO3溶液____0.1mol/LNaHCO3溶液
(3)25℃1mol/LFeCl3溶液___80℃1mol/LFeCl3溶液
(4)0.1mol/L(NH4)2CO3溶液___0.1mol/LNa2CO3溶液
<
>
>
<
随堂训练
2.向三份0.1 mol/L CH3COONa溶液中分别加入少量NH4NO3、Na2SO3、FeCl3固体(忽略溶液体积变化),则CH3COO-浓度的变化依次为 ( )
A.减小、增大、减小
B.增大、减小、减小
C.减小、增大、增大
D.增大、减小、增大
A
随堂训练
3.下列关于FeCl3水解的说法错误的是( )
A.在FeCl3稀溶液中,水解达到平衡时,无论加FeCl3饱和溶液还是加水稀释,平衡均向右移动
B.浓度为5mol·L-1和0.5mol·L-1的两种FeCl3溶液,其他条件相同时,
Fe3+的水解程度前者小于后者
C.其他条件相同时,同浓度的FeCl3溶液在50℃和20℃时发生水解,50℃
时Fe3+的水解程度比20℃时的小
D.为抑制Fe3+的水解,更好地保存FeCl3溶液,应加少量盐酸
C
谢谢观看
3.3.2 影响盐类水解的因素
核心素养目标
1.宏观辨识与微观探析:
宏观层面:学生能通过实验现象,如观察不同盐溶液在改变温度、浓度、外加酸碱等条件下,溶液颜色、浑浊程度的变化,直观感受盐类水解平衡的移动。
微观层面:从微观粒子相互作用的角度深入理解影响盐类水解的因素。
2.变化观念与平衡思想:
动态平衡观念:认识到盐类水解平衡与化学平衡、电离平衡一样,是动态平衡。
定量平衡思想:借助盐类水解平衡常数,从定量角度理解盐类水解程度与外界因素的关系。
3.科学态度与社会责任:
科学探究精神:在探究影响盐类水解因素的实验过程中,培养学生严谨的科学态度和规范的实验操作技能。
社会应用意识:关注盐类水解在日常生活、生产实践和环境保护等领域的广泛应用,认识到化学知识对解决实际问题的重要价值。
学习重难点
学习重点
1.影响盐类水解平衡的因素:全面掌握影响盐类水解平衡的内因和外因。
2.盐类水解原理的应用:学会运用盐类水解原理解决实际问题。
学习难点
1.盐类水解平衡移动的定量分析:从定量角度理解盐类水解平衡移动过程中溶液中粒子浓度的变化以及水解常数的应用对学生来说具有一定难度。
2.盐类水解在复杂体系中的应用:在实际情境中,往往涉及多种平衡相互影响的复杂体系,学生难以运用盐类水解知识进行综合分析。
课前导入
妈妈用热的纯碱溶液清洗油污效果更好,纯碱本身是盐,它的溶液为什么呈碱性?为什么加热后碱性会增强,去污能力也变强了呢?
反应条件对水解平衡的影响
PART 01
1.反应条件对水解平衡的影响
盐类的水解反应一般是可逆反应,在一定条件下可达到化学平衡,该化学平衡通常叫做水解平衡。若改变条件,水解平衡就会发生移动,遵循勒夏特列原理。
【提出问题】
(1)FeCl3溶液呈酸性还是碱性?写出FeCl3发生水解的离子方程式。
(2)从反应条件考虑,影响FeCl3水解平衡的因素可能有哪些?
Fe3+ + 3H2O Fe(OH)3 + 3H+
呈酸性
1.反应条件对水解平衡的影响
【实验探究】
(1)现有以下实验用品:
试管、试管夹、试管架、胶头滴管、pH计、药匙、酒精灯、火柴;
0.01 mol/L FeCl3溶液、FeCl3晶体、浓盐酸、浓氢氧化钠溶液。
(2)实验方案
请根据所提供的实验用品(可自行增加),参照下表设计实验,完成实验并记录现象。应用平衡移动原理对实验现象进行解释。
1.反应条件对水解平衡的影响
影响因素 实验现象 解释
温度
反应物的浓度
生成物的浓度
试管中溶液的颜色明显加深,溶液的pH减小。
水解过程是吸热的,加热使水解平衡向正反应方向移动,生成更多的Fe(OH)3,颜色加深,c(H+)增大,pH减小。
试管中溶液的颜色变深。
增大c(Fe3+),水解平衡正向移动,溶液颜色变深
试管中溶液的颜色变浅。
增大c(H+),水解平衡逆向移动,溶液颜色变浅
1.反应条件对水解平衡的影响
Fe3+ + 3H2O Fe(OH)3 + 3H+当条件改变时,将相关内容填入表格中:
影响因素 实验操作 平衡移动方向 H+数 pH Fe3+的水解程度
浓度 加水
加FeCl3
溶液的 酸碱度 加HCl
NaOH
温度 温度升高
盐 NaHCO3
正向
增大
增大
增大
正向
增大
减小
减小
逆向
增大
减小
减小
正向
减小
增大
增大
正向
增大
减小
增大
正向
减小
增大
增大
影响盐类水解平衡的因素
PART 02
1.影响盐类水解平衡的因素
(1)内因——盐本身的性质
构成盐的酸根离子对应的弱酸酸性越弱(或阳离子对应的弱碱碱性越弱),即越难电离(电离常数越小),该盐的水解程度越大。
强碱弱酸盐(MA)的水解:
MA A- + M+
H2O H+ + OH-
HA(弱酸)
+
A-结合H+的能力越强
HA酸性越弱即Ka越小
A-水解程度就越大
越弱越水解
1.影响盐类水解平衡的因素
(1)内因——盐本身的性质
如相同温度下,等浓度的CH3COONa与NaClO溶液的碱性谁更强?
越弱越水解
HClO
CH3COOH
酸性:
<
NaClO
CH3COONa
碱性:
>
识记常见弱酸的酸性顺序:
H2SO3 >H3PO4>HF>CH3COOH>H2CO3>HClO
1.影响盐类水解平衡的因素
(2)外因
① 温度:盐类的水解反应是吸热反应,因此升高温度促进盐类的水解,降低温度抑制盐类的水解。
② 浓度:增大盐溶液的浓度,水解平衡正向移动,但水解程度减小;加水稀释可以促进水解,水解平衡正向移动,水解程度增大。
越热越水解
越稀越水解
③ 外加酸、碱、盐:
加酸:抑制弱碱阳离子的水解;加碱:抑制弱酸阴离子的水解;
加能水解的盐:
取决于两种盐的水解形式
相同,相互抑制
相反,相互促进
盐的水解常数
PART 03
1.盐的水解常数
(1)盐的水解常数表达式
若MA为强碱弱酸盐,则其水解的离子方程式为:
A- + H2O HA + OH-
该反应的平衡常数Kh= ,Kh称为盐的水解常数。
c(HA)·c(OH-)
c(A-)
水解平衡常数是描述能水解的盐水解平衡的主要参数。
它只受温度影响,因水解过程是吸热过程,故它随温度的升高而增大。
1.影响盐类水解平衡的因素
(2)Kh与Ka(Kb)、Kw的关系
① 若常温下一元弱酸HA的电离平衡常数为Ka,水的离子积常数为Kw。请分析水溶液中NaA的Kh与Ka和Kw间的关系。
两式相乘
Ka
Kh
×
= Kw
同理:
得到:
Ka=
Kh=
∴
Kw
Ka
Kh=
Kw
Kb
Kh=
A- + H2O HA + OH-
HA A- + H+
又:
1.影响盐类水解平衡的因素
(2)水的离子积常数为Kw,二元弱酸H2CO3的电离常数为Ka1、Ka2,则分别分析Na2CO3、NaHCO3的Kh与Ka和Kw间的关系。
Na2CO3溶液:Kh1=NaHCO3溶液:Kh2=
NaHCO3:HCO3- + H2O H2CO3 + OH-
Kh2=
Ka2=
电离:H2CO3 H+ + HCO3-
HCO3- H+ + CO32-
Ka1=
Na2CO3: CO32- + H2O HCO3- + OH-
Kh1=
随堂训练
1.比较下列溶液的pH大小(填“>”“<”或“=”)
(1)0.2mol/LNH4Cl溶液____0.1mol/LNH4Cl溶液
(2)0.1mol/LNa2CO3溶液____0.1mol/LNaHCO3溶液
(3)25℃1mol/LFeCl3溶液___80℃1mol/LFeCl3溶液
(4)0.1mol/L(NH4)2CO3溶液___0.1mol/LNa2CO3溶液
<
>
>
<
随堂训练
2.向三份0.1 mol/L CH3COONa溶液中分别加入少量NH4NO3、Na2SO3、FeCl3固体(忽略溶液体积变化),则CH3COO-浓度的变化依次为 ( )
A.减小、增大、减小
B.增大、减小、减小
C.减小、增大、增大
D.增大、减小、增大
A
随堂训练
3.下列关于FeCl3水解的说法错误的是( )
A.在FeCl3稀溶液中,水解达到平衡时,无论加FeCl3饱和溶液还是加水稀释,平衡均向右移动
B.浓度为5mol·L-1和0.5mol·L-1的两种FeCl3溶液,其他条件相同时,
Fe3+的水解程度前者小于后者
C.其他条件相同时,同浓度的FeCl3溶液在50℃和20℃时发生水解,50℃
时Fe3+的水解程度比20℃时的小
D.为抑制Fe3+的水解,更好地保存FeCl3溶液,应加少量盐酸
C
谢谢观看
