3.2.1金属钠及钠的化合物 教学课件(共26张PPT)高中化学苏教版(2019)必修一
文档属性
| 名称 | 3.2.1金属钠及钠的化合物 教学课件(共26张PPT)高中化学苏教版(2019)必修一 |  | |
| 格式 | pptx | ||
| 文件大小 | 28.7MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 苏教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2025-07-02 09:51:29 | ||
图片预览








文档简介
(共26张PPT)
专题3 从海水中获得的化学物质
第二单元 金属钠及钠的化合物
3.2.1 钠的性质与制备
核心素养目标
科学态度与社会责任:
认识钠的活泼性带来的储存与使用风险,树立实验安全意识,体会化学研究中的严谨态度。
证据推理与模型认知:
运用钠的制备原理和用途,建立 “物质性质 — 工业制备 — 实际应用” 的分析模型。
证据推理与模型认知:
通过设计 “钠与硫酸铜溶液反应” 实验,经历 “提出假设 — 实验验证 — 误差分析” 的探究过程,理解钠与盐溶液反应的本质。
教学重难点
重点
钠与氧气、水的反应现象及方程式,钠与盐溶液反应的特点。
Na O 与水、CO 反应的方程式,以及其作为供氧剂的应用原理。
工业电解熔融 NaCl 制钠,钠在核反应堆、高压钠灯等场景的应用。
难点
Na O 与水、CO 反应中自身的歧化反应,电子转移方向和数目。
钠与水反应 “浮、熔、游、响、红” 现象对应的原因。
将钠的性质迁移至其他活泼金属的反应分析,理解同类物质的性质规律。
课前导入
在科幻电影中常出现 “钠与水爆炸” 的惊险场景,而现实中钠金属的保存瓶里总是浸泡在煤油中 —— 这种 “水火不容” 却又 “依赖煤油” 的金属,究竟有何特殊性质?1807 年,英国化学家戴维通过电解熔融苛性钠首次制得金属钠,揭开了这种活泼金属的神秘面纱。今天,我们将通过 “切、熔、浮、响” 的实验现象,探索钠原子的电子结构秘密,解密过氧化钠 “变废为氧” 的化学魔法,并揭开工业制钠与钠应用的神秘面纱。让我们像戴维一样,用科学的钥匙打开碱金属世界的大门!
01
金属钠的性质
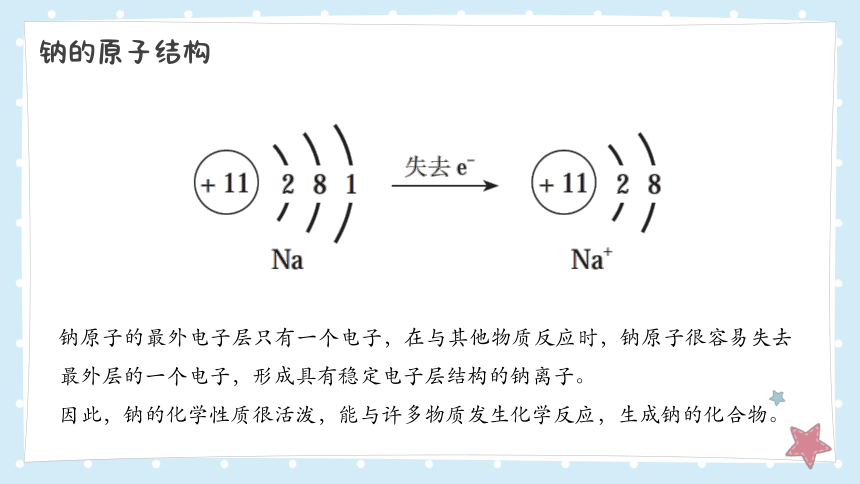
钠的原子结构
钠原子的最外电子层只有一个电子,在与其他物质反应时,钠原子很容易失去最外层的一个电子,形成具有稳定电子层结构的钠离子。
因此,钠的化学性质很活泼,能与许多物质发生化学反应,生成钠的化合物。
实验探究钠的性质
实验步骤 用镊子取一小块钠,用滤纸吸干表面的煤油 在玻璃片上用小刀切去一段的表层
实验现象 钠块表面呈暗灰色 新切开的钠表面呈银白色,具有金属光泽
钠的物理性质 颜色 状态 光泽 硬度 导电、导热性 延展性 密度 熔点 沸点
银白色 固态 金属光泽 小(质软) 良好 良好 0.97g·cm-3 97.8°C 883°C
实验探究钠的性质
钠放置在空气中 在空气中加热钠
实验现象 新切开的钠具有银白色的金属光泽,在空气中很快变暗 钠先熔化成小球,然后剧烈燃烧,火焰呈黄色,生成淡黄色固体
化学方程式 4Na+O2=2Na2O 2Na+O2Na2O2
钠是非常活泼的金属,与O2反应的条件不同时,反应现象不同,产物也不同,常温时生成Na2O,加热或点燃条件下生成Na2O2
取用金属钠的注意事项
1.取用钠必须用镊子,切不可用手直接接触,否则皮肤会被腐蚀
2.切下来未用的钠要及时放回盛放钠的试剂瓶中,切不可随意丢弃,也不可放入废液缸或自来水池中
3.为了不影响对钠的颜色和光泽的观察,在切割之前要用滤纸吸干其表面的煤油,钠的切面要尽量大一些,切开之后要及时观察
4.实验中用到的镊子、小刀和滤纸等都必须是干燥的
5.取金属钠时,一般取约绿豆粒大小即可,不能太大,以免发生危险
实验探究钠的性质
实验现象 结论或解释
钠浮在水面上 钠的密度比水小
钠熔化成小球 钠熔点低,反应放热
小球在水面上迅速游动 反应产生的氢气推动小球运动
与水反应发出“嘶嘶”声,逐渐变小,最后消失 钠与水剧烈反应,产生气体
反应后溶液的颜色逐渐变红 有碱性物质(氢氧化钠)生成
化学方程式:2Na+2H2O=2NaOH+H2↑ 钠和盐溶液的反应的规律
钠与盐溶液反应仍是Na与H2O的反应。因盐中金属离子被水分子包围,使Na不能与之接触。Na与H2O反应生成NaOH,若与盐能生成难溶碱,则盐也会参与反应。
如将Na加入CuSO4溶液中,反应的第一步为:2Na+2H2O=2NaOH+H2↑
第二步为:2NaOH+CuSO4=Cu(OH)2↓+Na2SO4
合并为:2Na+CuSO4+2H2O=Cu(OH)2↓+Na2SO4+H2↑
因此钠不能从盐溶液中置换出金属。
钠的制备和用途
工业上通常采用电解熔融氯化钠的方法制取单质钠。
金属钠的用途广泛。充有钠蒸气的高压钠灯发出的黄光射程远,透雾能力强,常用于道路和广场的照明。钠和钾形成的合金熔点低,常温下呈液态,导热性好,可用作快中子反应堆的热交换剂。利用钠的强还原性,在一定条件下还可以将钛、锆、铌等稀有金属从其氯化物中置换出来,例如:
戴维用电解法发现新元素
1799年,意大利物理学家伏打发明了伏打电池。次年,英国化学家尼科尔森利用伏打电池成功地分解了水。从此,电在化学研究中的应用引起了科学家的广泛关注。1806年,英国化学家戴维对前人有关电在化学反应中的研究进行了总结,预言这种手段除可以把水分解为氢气和氧气外,还可能分解其他物质,这一想法把电与物质组成联系起来,从而推动了一系列新元素的发现。
为了确定强碱物质的元素组成,戴维最初用氢氧化钾或氢氧化钠的饱和溶液进行了电解实验,实验结果发现,碱没有变化,产物和水的电解结果一样。通过分析,他认为应该排除水这个干扰因素,于是改用熔融氢氧化钾,结果发现阴极周围出现了剧烈燃烧的火焰,分解出的产物被燃烧了。后来他换用碳酸钾并通以强电流进行实验,但阴极上出现的金属颗粒也很快被燃烧掉了。经过总结和反思,戴维尝试在密闭坩埚内电解熔融氢氧化钾,成功得到了一种银白色金属,这种金属在水中能发生剧烈反应并产生淡紫色火焰。由此,戴维判断这是一种新金属,取名为钾。不久,他又从熔融态的碳酸钠中电解出了金属钠。
戴维用电解法发现新元素
次年,戴维用同样的电解方法,从苦土(主要成分为氧化镁)、石灰、菱锶矿(主要成分为碳酸锶)和重晶石(主要成分为硫酸钡)中又分别发现了新元素镁、钙、锶和钡。
戴维由金属钾可从水中置换出氢气受到启发,认为钾在一定的条件下也应该能置换出其他物质。1808年,他将钾与无水硼酸混合,在铜管中加热,得到了青灰色的非金属硼。 这样,在不到两年的时间里,戴维就发现了7种新元素,如果加上他1810年和1813年确定的氯元素和碘元素,戴维一生发现和确认的元素就有9种,奠定了他在元素发现史上无人能比的地位。
汉弗莱·戴维
02
氧化钠和过氧化钠
氧化钠的性质
(1)氧化钠是一种白色的碱性氧化物,能与水、酸、酸性氧化物等发生反应。
(2)氧化钠的化学性质:
①氧化钠与水反应:Na2O+H2O=2NaOH;
②氧化钠溶于盐酸:Na2O+2HCl=2NaCl+H2O;
③氧化钠与CO2反应:Na2O+CO2=Na2CO3。
过氧化钠的化学性质
(1)过氧化钠与水反应的化学方程式是
2Na2O2+2H2O=4NaOH+O2↑。
氧化剂是过氧化钠,还原剂是过氧化钠。
(2)过氧化钠与二氧化碳反应的化学方程式是
2Na2O2+2CO2=2Na2CO3+O2,可用于呼吸面具或潜水艇中作为O2的来源。
氧化钠与过氧化钠的比较
名称 氧化钠 过氧化钠
化学式 Na2O Na2O2
氧的价态 -2 -1
颜色状态 白色固体 淡黄色固体
化学性质 相同点 都能与水反应生成氢氧化钠,都能与CO2反应生成Na2CO3 不同点 过氧化钠与水、二氧化碳反应有氧气产生,具有强氧化性,而Na2O不具有强氧化性 03
课堂小结
04
课堂练习
1.下列有关钠的存在、保存及取用方法的描述正确的是( )
A.钠在自然界中主要以化合态的形式存在,少量以游离态的形式存在
B.钠需要密封保存在煤油或石蜡油中
C.实验室中可直接用药匙取用钠
D.实验室中取用后剩余的钠不能放回原试剂瓶中
B
2.下列关于钠的叙述错误的是( )
A.钠在自然界中可以以游离态存在
B.钠在燃烧时发出黄色火焰
C.钠元素主要以Na+的形式存在于海水中
D.钠在空气中燃烧生成过氧化钠
A
3.取一小块金属钠,放在燃烧匙里加热,下列实验现象中,正确的描述是( )
①钠先熔化 ②在空气中燃烧,放出黄色火花 ③燃烧后得到白色固体 ④燃烧时火焰为黄色 ⑤燃烧后生成淡黄色固体物质
A.①② B.①②③
C.①④⑤ D.④⑤
C
4.等质量的两块钠,第一块与足量氧气在加热条件下反应,第二块与足量氧气在常温下充分反应,则下列说法正确的是( )
A.第一块钠失去的电子数多
B.两块钠失去的电子数一样多
C.第二块钠的反应产物质量较大
D.生成物均可用于杀菌消毒
B
感谢您的聆听
专题3 从海水中获得的化学物质
第二单元 金属钠及钠的化合物
3.2.1 钠的性质与制备
核心素养目标
科学态度与社会责任:
认识钠的活泼性带来的储存与使用风险,树立实验安全意识,体会化学研究中的严谨态度。
证据推理与模型认知:
运用钠的制备原理和用途,建立 “物质性质 — 工业制备 — 实际应用” 的分析模型。
证据推理与模型认知:
通过设计 “钠与硫酸铜溶液反应” 实验,经历 “提出假设 — 实验验证 — 误差分析” 的探究过程,理解钠与盐溶液反应的本质。
教学重难点
重点
钠与氧气、水的反应现象及方程式,钠与盐溶液反应的特点。
Na O 与水、CO 反应的方程式,以及其作为供氧剂的应用原理。
工业电解熔融 NaCl 制钠,钠在核反应堆、高压钠灯等场景的应用。
难点
Na O 与水、CO 反应中自身的歧化反应,电子转移方向和数目。
钠与水反应 “浮、熔、游、响、红” 现象对应的原因。
将钠的性质迁移至其他活泼金属的反应分析,理解同类物质的性质规律。
课前导入
在科幻电影中常出现 “钠与水爆炸” 的惊险场景,而现实中钠金属的保存瓶里总是浸泡在煤油中 —— 这种 “水火不容” 却又 “依赖煤油” 的金属,究竟有何特殊性质?1807 年,英国化学家戴维通过电解熔融苛性钠首次制得金属钠,揭开了这种活泼金属的神秘面纱。今天,我们将通过 “切、熔、浮、响” 的实验现象,探索钠原子的电子结构秘密,解密过氧化钠 “变废为氧” 的化学魔法,并揭开工业制钠与钠应用的神秘面纱。让我们像戴维一样,用科学的钥匙打开碱金属世界的大门!
01
金属钠的性质
钠的原子结构
钠原子的最外电子层只有一个电子,在与其他物质反应时,钠原子很容易失去最外层的一个电子,形成具有稳定电子层结构的钠离子。
因此,钠的化学性质很活泼,能与许多物质发生化学反应,生成钠的化合物。
实验探究钠的性质
实验步骤 用镊子取一小块钠,用滤纸吸干表面的煤油 在玻璃片上用小刀切去一段的表层
实验现象 钠块表面呈暗灰色 新切开的钠表面呈银白色,具有金属光泽
钠的物理性质 颜色 状态 光泽 硬度 导电、导热性 延展性 密度 熔点 沸点
银白色 固态 金属光泽 小(质软) 良好 良好 0.97g·cm-3 97.8°C 883°C
实验探究钠的性质
钠放置在空气中 在空气中加热钠
实验现象 新切开的钠具有银白色的金属光泽,在空气中很快变暗 钠先熔化成小球,然后剧烈燃烧,火焰呈黄色,生成淡黄色固体
化学方程式 4Na+O2=2Na2O 2Na+O2Na2O2
钠是非常活泼的金属,与O2反应的条件不同时,反应现象不同,产物也不同,常温时生成Na2O,加热或点燃条件下生成Na2O2
取用金属钠的注意事项
1.取用钠必须用镊子,切不可用手直接接触,否则皮肤会被腐蚀
2.切下来未用的钠要及时放回盛放钠的试剂瓶中,切不可随意丢弃,也不可放入废液缸或自来水池中
3.为了不影响对钠的颜色和光泽的观察,在切割之前要用滤纸吸干其表面的煤油,钠的切面要尽量大一些,切开之后要及时观察
4.实验中用到的镊子、小刀和滤纸等都必须是干燥的
5.取金属钠时,一般取约绿豆粒大小即可,不能太大,以免发生危险
实验探究钠的性质
实验现象 结论或解释
钠浮在水面上 钠的密度比水小
钠熔化成小球 钠熔点低,反应放热
小球在水面上迅速游动 反应产生的氢气推动小球运动
与水反应发出“嘶嘶”声,逐渐变小,最后消失 钠与水剧烈反应,产生气体
反应后溶液的颜色逐渐变红 有碱性物质(氢氧化钠)生成
化学方程式:2Na+2H2O=2NaOH+H2↑ 钠和盐溶液的反应的规律
钠与盐溶液反应仍是Na与H2O的反应。因盐中金属离子被水分子包围,使Na不能与之接触。Na与H2O反应生成NaOH,若与盐能生成难溶碱,则盐也会参与反应。
如将Na加入CuSO4溶液中,反应的第一步为:2Na+2H2O=2NaOH+H2↑
第二步为:2NaOH+CuSO4=Cu(OH)2↓+Na2SO4
合并为:2Na+CuSO4+2H2O=Cu(OH)2↓+Na2SO4+H2↑
因此钠不能从盐溶液中置换出金属。
钠的制备和用途
工业上通常采用电解熔融氯化钠的方法制取单质钠。
金属钠的用途广泛。充有钠蒸气的高压钠灯发出的黄光射程远,透雾能力强,常用于道路和广场的照明。钠和钾形成的合金熔点低,常温下呈液态,导热性好,可用作快中子反应堆的热交换剂。利用钠的强还原性,在一定条件下还可以将钛、锆、铌等稀有金属从其氯化物中置换出来,例如:
戴维用电解法发现新元素
1799年,意大利物理学家伏打发明了伏打电池。次年,英国化学家尼科尔森利用伏打电池成功地分解了水。从此,电在化学研究中的应用引起了科学家的广泛关注。1806年,英国化学家戴维对前人有关电在化学反应中的研究进行了总结,预言这种手段除可以把水分解为氢气和氧气外,还可能分解其他物质,这一想法把电与物质组成联系起来,从而推动了一系列新元素的发现。
为了确定强碱物质的元素组成,戴维最初用氢氧化钾或氢氧化钠的饱和溶液进行了电解实验,实验结果发现,碱没有变化,产物和水的电解结果一样。通过分析,他认为应该排除水这个干扰因素,于是改用熔融氢氧化钾,结果发现阴极周围出现了剧烈燃烧的火焰,分解出的产物被燃烧了。后来他换用碳酸钾并通以强电流进行实验,但阴极上出现的金属颗粒也很快被燃烧掉了。经过总结和反思,戴维尝试在密闭坩埚内电解熔融氢氧化钾,成功得到了一种银白色金属,这种金属在水中能发生剧烈反应并产生淡紫色火焰。由此,戴维判断这是一种新金属,取名为钾。不久,他又从熔融态的碳酸钠中电解出了金属钠。
戴维用电解法发现新元素
次年,戴维用同样的电解方法,从苦土(主要成分为氧化镁)、石灰、菱锶矿(主要成分为碳酸锶)和重晶石(主要成分为硫酸钡)中又分别发现了新元素镁、钙、锶和钡。
戴维由金属钾可从水中置换出氢气受到启发,认为钾在一定的条件下也应该能置换出其他物质。1808年,他将钾与无水硼酸混合,在铜管中加热,得到了青灰色的非金属硼。 这样,在不到两年的时间里,戴维就发现了7种新元素,如果加上他1810年和1813年确定的氯元素和碘元素,戴维一生发现和确认的元素就有9种,奠定了他在元素发现史上无人能比的地位。
汉弗莱·戴维
02
氧化钠和过氧化钠
氧化钠的性质
(1)氧化钠是一种白色的碱性氧化物,能与水、酸、酸性氧化物等发生反应。
(2)氧化钠的化学性质:
①氧化钠与水反应:Na2O+H2O=2NaOH;
②氧化钠溶于盐酸:Na2O+2HCl=2NaCl+H2O;
③氧化钠与CO2反应:Na2O+CO2=Na2CO3。
过氧化钠的化学性质
(1)过氧化钠与水反应的化学方程式是
2Na2O2+2H2O=4NaOH+O2↑。
氧化剂是过氧化钠,还原剂是过氧化钠。
(2)过氧化钠与二氧化碳反应的化学方程式是
2Na2O2+2CO2=2Na2CO3+O2,可用于呼吸面具或潜水艇中作为O2的来源。
氧化钠与过氧化钠的比较
名称 氧化钠 过氧化钠
化学式 Na2O Na2O2
氧的价态 -2 -1
颜色状态 白色固体 淡黄色固体
化学性质 相同点 都能与水反应生成氢氧化钠,都能与CO2反应生成Na2CO3 不同点 过氧化钠与水、二氧化碳反应有氧气产生,具有强氧化性,而Na2O不具有强氧化性 03
课堂小结
04
课堂练习
1.下列有关钠的存在、保存及取用方法的描述正确的是( )
A.钠在自然界中主要以化合态的形式存在,少量以游离态的形式存在
B.钠需要密封保存在煤油或石蜡油中
C.实验室中可直接用药匙取用钠
D.实验室中取用后剩余的钠不能放回原试剂瓶中
B
2.下列关于钠的叙述错误的是( )
A.钠在自然界中可以以游离态存在
B.钠在燃烧时发出黄色火焰
C.钠元素主要以Na+的形式存在于海水中
D.钠在空气中燃烧生成过氧化钠
A
3.取一小块金属钠,放在燃烧匙里加热,下列实验现象中,正确的描述是( )
①钠先熔化 ②在空气中燃烧,放出黄色火花 ③燃烧后得到白色固体 ④燃烧时火焰为黄色 ⑤燃烧后生成淡黄色固体物质
A.①② B.①②③
C.①④⑤ D.④⑤
C
4.等质量的两块钠,第一块与足量氧气在加热条件下反应,第二块与足量氧气在常温下充分反应,则下列说法正确的是( )
A.第一块钠失去的电子数多
B.两块钠失去的电子数一样多
C.第二块钠的反应产物质量较大
D.生成物均可用于杀菌消毒
B
感谢您的聆听
