4.2含硫化合物的性质 教学课件(共28张PPT)高中化学苏教版(2019)必修一
文档属性
| 名称 | 4.2含硫化合物的性质 教学课件(共28张PPT)高中化学苏教版(2019)必修一 |  | |
| 格式 | pptx | ||
| 文件大小 | 28.8MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 苏教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2025-07-02 09:51:48 | ||
图片预览







文档简介
(共28张PPT)
专题4 硫与环境保护
第二单元 硫及其化合物的相互转化
4.2含硫物质之间的转化
氧化还原反应方程式的配平
核心素养目标
科学态度与社会责任:
通过 “古代炼石胆取硫酸” 的历史情境,感受化学在人类文明进程中的重要作用,增强学习化学的兴趣和责任感。
证据推理与模型认知:
通过分析硫及其化合物的连续氧化反应,归纳 “低价态→中间价态→高价态” 的氧化路径模型,并能运用该模型预测类似元素的转化规律。
宏观辨识与微观探析:
能从硫元素化合价的微观角度,分析含硫物质的氧化还原性质,理解不同价态硫元素的转化规律。
教学重难点
重点
同一价态硫的转化(通过酸、碱反应实现,如 H SO 与 NaOH、Na SO 与 H SO 的反应)。
不同价态硫的转化(通过氧化还原反应实现,如 H S→S→SO →SO 的价态升降)。
能根据硫元素的化合价和物质类别,分析物质性质并设计转化路径。
难点
理解硫元素价态 “台阶式升降” 规律。
复杂反应中氧化剂与还原剂的判断。
通过实验验证含硫物质的性质,并解释实验现象背后的化学原理。
课前导入
在古代中国,人们就已经通过智慧制备出了一种重要的化学物质 ——“绿矾油”,它其实就是稀硫酸。在《黄帝九鼎神丹经诀》中记载着 “炼石胆取精华法”,这里的石胆指的就是胆矾(CuSO 5H O)或绿矾(FeSO 7H O)。实验室模拟干馏绿矾的过程如下:强热 FeSO 7H O 时,会发生反应生成 Fe O 、SO 、SO 和 H O,其中 SO 与水反应就能得到硫酸。
在这个反应里,硫元素的化合价发生了怎样的变化?
希望同学们通过这节课的学习,能够像古代化学家探索 “绿矾油” 一样,积极思考、勇于探究,揭开含硫物质转化的神秘面纱!
01
含硫物质间的转化
含硫物质之间的转化
不同价态含硫化合物 含硫物质 H2S、Na2S S SO2、H2SO3、Na2SO3 SO3、H2SO4、Na2SO4
硫元素化合价 -2 0 +4 +6
通过氧化还原反应,可以实现不同价态含硫物质之间的转化。
通过非氧化还原反应,可以实现相同价态含硫物质之间的转化。
例如,含有+4价硫的二氧化硫、亚硫酸和亚硫酸盐之间可以通过非氧化还原反应相互转化。
学以致用
请写出下列含硫物质之间发生转化的化学方程式。
(1)在一定条件下,硫单质能与许多金属单质化合。汞与硫黄在常温下化合生成硫化汞(HgS),因此,实验室常将硫黄撒在汞的表面,以除去不慎洒落的汞。
(2) 长期暴露在空气中的亚硫酸钠会被空气中的氧气氧化成硫酸钠。
(3)实验室常用过量的氢氧化钠溶液吸收二氧化硫尾气。
S + Hg =HgS
2Na2SO3 + O2=2Na2SO4
2NaOH + SO2 = Na2SO3 + H2O
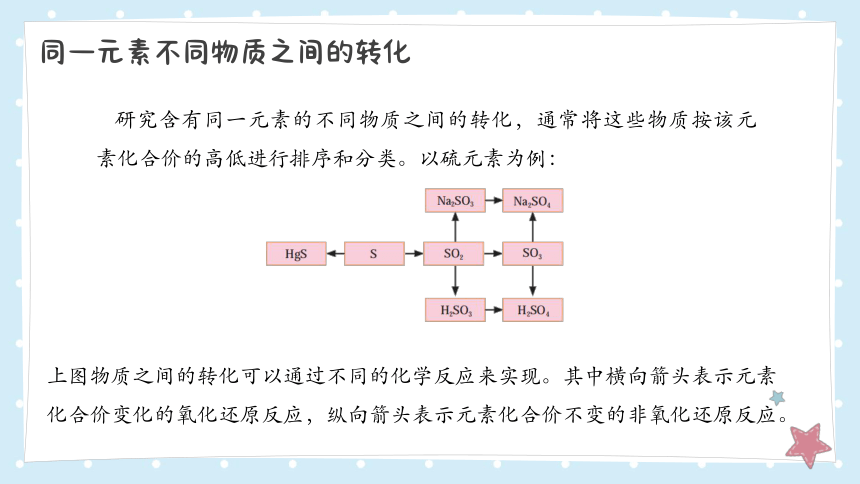
同一元素不同物质之间的转化
研究含有同一元素的不同物质之间的转化,通常将这些物质按该元素化合价的高低进行排序和分类。以硫元素为例:
上图物质之间的转化可以通过不同的化学反应来实现。其中横向箭头表示元素化合价变化的氧化还原反应,纵向箭头表示元素化合价不变的非氧化还原反应。
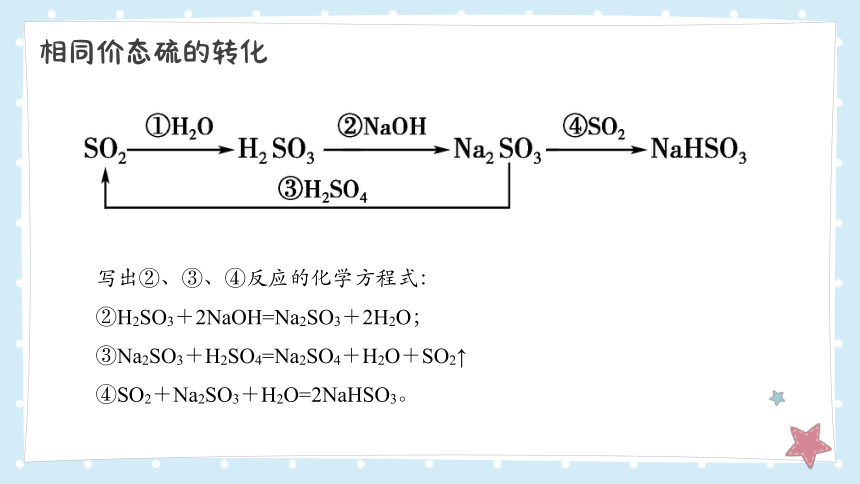
相同价态硫的转化
写出②、③、④反应的化学方程式:
②H2SO3+2NaOH=Na2SO3+2H2O;
③Na2SO3+H2SO4=Na2SO4+H2O+SO2↑
④SO2+Na2SO3+H2O=2NaHSO3。
不同价态硫的转化
含硫物质的连续氧化:
2H2S+2O2(少量)2S+2H2O
S+O2SO2
硫及其化合物间的转化规律
(1)在硫元素的不同价态中,-2价是硫元素的最低价态,只有还原性;+6价是硫元素的最高价态,只有氧化性;+4价是硫元素的中间价态,既有氧化性又有还原性。
(2)当硫元素的化合价升高或降低时,一般升高或降低到其相邻的价态。
(3)当遇到强氧化剂或强还原剂时,硫元素的化合价可能发生“跳位”变化。
例如:
H2S+3H2SO4(浓)4SO2↑+4H2O,
8HI+H2SO4(浓)=H2S↑+4I2+4H2O。
(4)硫元素的相邻价态之间一般不会发生氧化还原反应,如S和H2S、S和SO2、SO2和H2SO4,所以可用浓硫酸干燥SO2气体。
02
氧化还原反应方程式的配平
氧化还原反应方程式的配平
氧化还原反应中都有哪些守恒?如何配平陌生的氧化还原反应方程式?
1.得失电子守恒,氧化剂得电子总数等于还原剂失电子总数等于转移电子总数。(本质)
2.化合价升降守恒,化合价降低总数和化合价升高总数相等。(特征)
3.质量守恒,反应前后原子的种类和数目不变。
4.电荷守恒,对于离子反应,方程式两端阴、阳离子所带电荷总数相等
氧化还原反应方程式的配平
一、氧化还原反应方程式的配平依据:得失电子数相等。
二、氧化还原反应的配平步骤:(以C与浓硫酸反应为例)
0
+6
+4
+4
(1)标变价:写出反应物、生成物的化学式,并标明化合价发生变化的元素化合价。
C+H2SO4(浓)——CO2+SO2+H2O
氧化还原反应方程式的配平
(2)列变化:标出电子转移方向和数目。
(3)求总数:得失电子数目相等。
氧化还原反应方程式的配平
(4)配平系数:根据质量守恒配平其他物质的计量数,添加气体、沉淀符号,注明条件,将单线改为双线。
(5)查守恒:检查质量、电荷、得失电子是否守恒。
氧化还原反应方程式的配平技巧
→正向配平:
(1)氧化剂、还原剂中某元素化合价全变的,以反应物为基准从左边配平。
(2)归中反应(变价元素只有一种,“高价+低价→中间价”)以反应物为基准从左边配平。
→逆向配平:
(1)适用对象:氧化剂、还原剂中某元素化合价部分变的;自身氧化还原反应;歧化反应(变价元素只有一种,中间价→高价+低价)。
(2)方法:从右边生成物着手配平,即:选择氧化产物、还原产物为基准物质
氧化还原反应方程式的配平技巧
→缺项配平:
缺项方程式:某些反应物或生成物的分子式未写出(缺项),它们一般为水、酸、碱。
(1)先根据化合价变化找出氧化剂、还原剂及还原产物、氧化产物;
(2)再根据质量守恒、电荷守恒确定所缺的物质的化学式(分子或离子),若反应物缺正电荷,一般加H+,生成物加水;若反应物缺负电荷,一般加OH-,生成物加水。
(3)最后观察配平其他物质系数。
典例解析
(1)焦亚硫酸钠(Na2S2O5)在医药、橡胶、印染、食品等方面应用广泛。回答下列问题:生产Na2S2O5,通常是由NaHSO3过饱和溶液经结晶脱水制得。写出该过程的化学方程式:______________________________________________。
(2)NO被H2O2氧化为的离子方程式是_________________________________。
(3)H2SO4的酸性环境中ClO2与碘化钾反应的离子方程式为___________________________________________。
2NaHSO3=Na2S2O5+H2O
2NO+3H2O2=2H++2+2H2O
2ClO2+10I-+8H+=2Cl-+5I2+4H2O
信息型氧化还原反应方程式的书写步骤
→一判:
据题给信息,联想所学知识,判断主要的反应物、生成物。若反应物、生成物中主要元素化合价不一致的,要考虑是否为氧化还原反应,就要写出氧化剂、还原剂、氧化产物、还原产物。
→二平:
据质量守恒定律和氧化还原反应规律配平主要物质的化学计量数。
→三补:
根据溶液的介质条件以及电荷守恒补足反应物或生成物,一般酸性环境可以消耗或生成酸,碱性环境可以消耗或生成碱。
03
课堂小结
04
课堂练习
1.下列物质能与SO2在一定条件下发生反应的是( )
①NaOH ②氯气 ③空气 ④氢硫酸 ⑤Na2SO3 ⑥Na2CO3
A.①②④⑤ B.②③⑤⑥
C.② D.①②③④⑤⑥
D
D
2.有关下列三个反应的叙述正确的是( )
①2H2S+SO2=3S↓+2H2O
②S+2H2SO4(浓)3SO2↑+2H2O
③3S+6KOH2K2S+K2SO3+3H2O
A.反应①说明SO2能与酸反应,具有碱性氧化物的性质
B.反应②改用稀硫酸,则能放出氢气
C.反应②和③说明S具有两性元素的性质
D.反应③中被氧化的硫元素与被还原的硫元素的质量之比为1∶2
3.已知常温下在溶液中可发生如下两个离子反应:
Ce4++Fe2+=Fe3++Ce3+
Sn2++2Fe3+=2Fe2++Sn4+
由此可以确定Fe2+、Ce3+、Sn2+三种离子的还原性由强到弱的顺序是( )
A.Sn2+、Fe2+、Ce3+ B.Sn2+、Ce3+、Fe2+
C.Ce3+、Fe2+、Sn2+ D.Fe2+、Sn2+、Ce3+
A
C
4.高锰酸钾溶液在酸性条件下可以与硫酸亚铁反应,离子方程式如下(未配平):
+___Fe2++___H+=___Mn2++___Fe3++___H2O
下列说法正确的是( )
A.是氧化剂,Fe3+是还原产物
B.Mn2+的还原性强于Fe2+
C.离子方程式中按物质顺序的化学计量数是1、5、8、1、5、4
D.生成1 mol 水时,转移2.5 mol电子
感谢您的聆听
专题4 硫与环境保护
第二单元 硫及其化合物的相互转化
4.2含硫物质之间的转化
氧化还原反应方程式的配平
核心素养目标
科学态度与社会责任:
通过 “古代炼石胆取硫酸” 的历史情境,感受化学在人类文明进程中的重要作用,增强学习化学的兴趣和责任感。
证据推理与模型认知:
通过分析硫及其化合物的连续氧化反应,归纳 “低价态→中间价态→高价态” 的氧化路径模型,并能运用该模型预测类似元素的转化规律。
宏观辨识与微观探析:
能从硫元素化合价的微观角度,分析含硫物质的氧化还原性质,理解不同价态硫元素的转化规律。
教学重难点
重点
同一价态硫的转化(通过酸、碱反应实现,如 H SO 与 NaOH、Na SO 与 H SO 的反应)。
不同价态硫的转化(通过氧化还原反应实现,如 H S→S→SO →SO 的价态升降)。
能根据硫元素的化合价和物质类别,分析物质性质并设计转化路径。
难点
理解硫元素价态 “台阶式升降” 规律。
复杂反应中氧化剂与还原剂的判断。
通过实验验证含硫物质的性质,并解释实验现象背后的化学原理。
课前导入
在古代中国,人们就已经通过智慧制备出了一种重要的化学物质 ——“绿矾油”,它其实就是稀硫酸。在《黄帝九鼎神丹经诀》中记载着 “炼石胆取精华法”,这里的石胆指的就是胆矾(CuSO 5H O)或绿矾(FeSO 7H O)。实验室模拟干馏绿矾的过程如下:强热 FeSO 7H O 时,会发生反应生成 Fe O 、SO 、SO 和 H O,其中 SO 与水反应就能得到硫酸。
在这个反应里,硫元素的化合价发生了怎样的变化?
希望同学们通过这节课的学习,能够像古代化学家探索 “绿矾油” 一样,积极思考、勇于探究,揭开含硫物质转化的神秘面纱!
01
含硫物质间的转化
含硫物质之间的转化
不同价态含硫化合物 含硫物质 H2S、Na2S S SO2、H2SO3、Na2SO3 SO3、H2SO4、Na2SO4
硫元素化合价 -2 0 +4 +6
通过氧化还原反应,可以实现不同价态含硫物质之间的转化。
通过非氧化还原反应,可以实现相同价态含硫物质之间的转化。
例如,含有+4价硫的二氧化硫、亚硫酸和亚硫酸盐之间可以通过非氧化还原反应相互转化。
学以致用
请写出下列含硫物质之间发生转化的化学方程式。
(1)在一定条件下,硫单质能与许多金属单质化合。汞与硫黄在常温下化合生成硫化汞(HgS),因此,实验室常将硫黄撒在汞的表面,以除去不慎洒落的汞。
(2) 长期暴露在空气中的亚硫酸钠会被空气中的氧气氧化成硫酸钠。
(3)实验室常用过量的氢氧化钠溶液吸收二氧化硫尾气。
S + Hg =HgS
2Na2SO3 + O2=2Na2SO4
2NaOH + SO2 = Na2SO3 + H2O
同一元素不同物质之间的转化
研究含有同一元素的不同物质之间的转化,通常将这些物质按该元素化合价的高低进行排序和分类。以硫元素为例:
上图物质之间的转化可以通过不同的化学反应来实现。其中横向箭头表示元素化合价变化的氧化还原反应,纵向箭头表示元素化合价不变的非氧化还原反应。
相同价态硫的转化
写出②、③、④反应的化学方程式:
②H2SO3+2NaOH=Na2SO3+2H2O;
③Na2SO3+H2SO4=Na2SO4+H2O+SO2↑
④SO2+Na2SO3+H2O=2NaHSO3。
不同价态硫的转化
含硫物质的连续氧化:
2H2S+2O2(少量)2S+2H2O
S+O2SO2
硫及其化合物间的转化规律
(1)在硫元素的不同价态中,-2价是硫元素的最低价态,只有还原性;+6价是硫元素的最高价态,只有氧化性;+4价是硫元素的中间价态,既有氧化性又有还原性。
(2)当硫元素的化合价升高或降低时,一般升高或降低到其相邻的价态。
(3)当遇到强氧化剂或强还原剂时,硫元素的化合价可能发生“跳位”变化。
例如:
H2S+3H2SO4(浓)4SO2↑+4H2O,
8HI+H2SO4(浓)=H2S↑+4I2+4H2O。
(4)硫元素的相邻价态之间一般不会发生氧化还原反应,如S和H2S、S和SO2、SO2和H2SO4,所以可用浓硫酸干燥SO2气体。
02
氧化还原反应方程式的配平
氧化还原反应方程式的配平
氧化还原反应中都有哪些守恒?如何配平陌生的氧化还原反应方程式?
1.得失电子守恒,氧化剂得电子总数等于还原剂失电子总数等于转移电子总数。(本质)
2.化合价升降守恒,化合价降低总数和化合价升高总数相等。(特征)
3.质量守恒,反应前后原子的种类和数目不变。
4.电荷守恒,对于离子反应,方程式两端阴、阳离子所带电荷总数相等
氧化还原反应方程式的配平
一、氧化还原反应方程式的配平依据:得失电子数相等。
二、氧化还原反应的配平步骤:(以C与浓硫酸反应为例)
0
+6
+4
+4
(1)标变价:写出反应物、生成物的化学式,并标明化合价发生变化的元素化合价。
C+H2SO4(浓)——CO2+SO2+H2O
氧化还原反应方程式的配平
(2)列变化:标出电子转移方向和数目。
(3)求总数:得失电子数目相等。
氧化还原反应方程式的配平
(4)配平系数:根据质量守恒配平其他物质的计量数,添加气体、沉淀符号,注明条件,将单线改为双线。
(5)查守恒:检查质量、电荷、得失电子是否守恒。
氧化还原反应方程式的配平技巧
→正向配平:
(1)氧化剂、还原剂中某元素化合价全变的,以反应物为基准从左边配平。
(2)归中反应(变价元素只有一种,“高价+低价→中间价”)以反应物为基准从左边配平。
→逆向配平:
(1)适用对象:氧化剂、还原剂中某元素化合价部分变的;自身氧化还原反应;歧化反应(变价元素只有一种,中间价→高价+低价)。
(2)方法:从右边生成物着手配平,即:选择氧化产物、还原产物为基准物质
氧化还原反应方程式的配平技巧
→缺项配平:
缺项方程式:某些反应物或生成物的分子式未写出(缺项),它们一般为水、酸、碱。
(1)先根据化合价变化找出氧化剂、还原剂及还原产物、氧化产物;
(2)再根据质量守恒、电荷守恒确定所缺的物质的化学式(分子或离子),若反应物缺正电荷,一般加H+,生成物加水;若反应物缺负电荷,一般加OH-,生成物加水。
(3)最后观察配平其他物质系数。
典例解析
(1)焦亚硫酸钠(Na2S2O5)在医药、橡胶、印染、食品等方面应用广泛。回答下列问题:生产Na2S2O5,通常是由NaHSO3过饱和溶液经结晶脱水制得。写出该过程的化学方程式:______________________________________________。
(2)NO被H2O2氧化为的离子方程式是_________________________________。
(3)H2SO4的酸性环境中ClO2与碘化钾反应的离子方程式为___________________________________________。
2NaHSO3=Na2S2O5+H2O
2NO+3H2O2=2H++2+2H2O
2ClO2+10I-+8H+=2Cl-+5I2+4H2O
信息型氧化还原反应方程式的书写步骤
→一判:
据题给信息,联想所学知识,判断主要的反应物、生成物。若反应物、生成物中主要元素化合价不一致的,要考虑是否为氧化还原反应,就要写出氧化剂、还原剂、氧化产物、还原产物。
→二平:
据质量守恒定律和氧化还原反应规律配平主要物质的化学计量数。
→三补:
根据溶液的介质条件以及电荷守恒补足反应物或生成物,一般酸性环境可以消耗或生成酸,碱性环境可以消耗或生成碱。
03
课堂小结
04
课堂练习
1.下列物质能与SO2在一定条件下发生反应的是( )
①NaOH ②氯气 ③空气 ④氢硫酸 ⑤Na2SO3 ⑥Na2CO3
A.①②④⑤ B.②③⑤⑥
C.② D.①②③④⑤⑥
D
D
2.有关下列三个反应的叙述正确的是( )
①2H2S+SO2=3S↓+2H2O
②S+2H2SO4(浓)3SO2↑+2H2O
③3S+6KOH2K2S+K2SO3+3H2O
A.反应①说明SO2能与酸反应,具有碱性氧化物的性质
B.反应②改用稀硫酸,则能放出氢气
C.反应②和③说明S具有两性元素的性质
D.反应③中被氧化的硫元素与被还原的硫元素的质量之比为1∶2
3.已知常温下在溶液中可发生如下两个离子反应:
Ce4++Fe2+=Fe3++Ce3+
Sn2++2Fe3+=2Fe2++Sn4+
由此可以确定Fe2+、Ce3+、Sn2+三种离子的还原性由强到弱的顺序是( )
A.Sn2+、Fe2+、Ce3+ B.Sn2+、Ce3+、Fe2+
C.Ce3+、Fe2+、Sn2+ D.Fe2+、Sn2+、Ce3+
A
C
4.高锰酸钾溶液在酸性条件下可以与硫酸亚铁反应,离子方程式如下(未配平):
+___Fe2++___H+=___Mn2++___Fe3++___H2O
下列说法正确的是( )
A.是氧化剂,Fe3+是还原产物
B.Mn2+的还原性强于Fe2+
C.离子方程式中按物质顺序的化学计量数是1、5、8、1、5、4
D.生成1 mol 水时,转移2.5 mol电子
感谢您的聆听
