2.3.1人类对原子结构的认识 教学课件(共28张PPT)高中化学苏教版(2019)必修一
文档属性
| 名称 | 2.3.1人类对原子结构的认识 教学课件(共28张PPT)高中化学苏教版(2019)必修一 |  | |
| 格式 | pptx | ||
| 文件大小 | 42.2MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 苏教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2025-07-02 09:54:18 | ||
图片预览








文档简介
(共28张PPT)
专题2 研究物质的基本方法
第三单元 人类对原子结构的认识
2.3.1人类对原子结构的认识
核心素养目标
科学态度与社会责任:
了解同位素在能源、医疗、考古等领域的应用,认识化学科学对社会发展的重要贡献,增强社会责任感。
证据推理与模型认知:
依据原子结构模型演变的科学史实和实验证据,推理原子的核式结构模型,构建 “实验证据 — 理论模型 — 修正完善” 的科学认知模式。
宏观辨识与微观探析:
通过对核素、同位素等概念的学习,从微观角度理解质子数、中子数的差异对原子性质和应用的影响,能从宏观和微观结合的视角分析相关化学问题。
教学重难点
重点
原子结构模型的演变历程,包括道尔顿、汤姆生、卢瑟福、玻尔等科学家提出的模型的核心观点及对应的实验依据。
原子核的构成,质量数、质子数、中子数的关系,核素、同位素的概念及表示方法.
有关质量数、质子数、中子数、核外电子数的计算,能根据核素符号进行微观粒子数量的相互换算。
难点
对核素、同位素概念的准确理解和辨析,明确同位素的化学性质相似性及物理性质差异的原因。
从卢瑟福 α 粒子散射实验现象推理原子的核式结构,理解实验现象与结论之间的逻辑关系。
质量数与相对原子质量的区别,以及在实际问题中对微观粒子数量关系的灵活运用。
课前导入
核武器主要包括裂变武器(第一代核武器,通常称为原子弹)和聚变武器(亦称为氢弹,分为两级式和三级式)。利用铀235或钚239等重原子核的裂变链式反应原理制成的裂变武器,通常称为原子弹;利用重氢或超重氢等轻原子核的热核反应原理制成的热核武器或聚变武器,通常称为氢弹。你知道重氢和超重氢的结构组成及相互关系吗
01
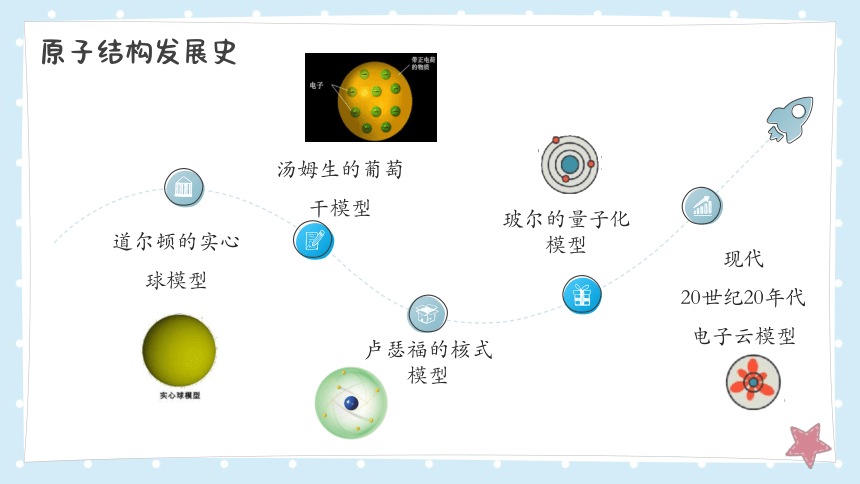
人类认识原子结构的历程
玻尔的量子化模型
汤姆生的葡萄干模型
道尔顿的实心球模型
卢瑟福的核式模型
现代
20世纪20年代
电子云模型
原子结构发展史
道尔顿的原子学说
→时间:
19世纪初
→原子学说或原子结构模型:
英国科学家道尔顿提出了原子学说
→主要理论依据或技术手段:
一些元素形成化合物时的质量比例关系
→原子学说或原子结构模型的主要论点:
他认为物质由原子组成,原子不能被创造,也能被毁灭,它们在化学变化中不可再分割。
道尔顿和他的原子
结构模型
汤姆生的原子结构模型
→时间:
1897年
→原子学说或原子结构模型:
英国物理学家汤姆生出了“葡萄干面包式”的原子结构模型
→原子学说或原子结构模型的主要论点:
原子中存在电子,为氢原子质量的1/1836;
原子是由一个云状的带正电荷的球体,以及均匀地镶嵌在球体中的许多电子组成的。
汤姆生发现电子
提出原子结构模型
卢瑟福的原子结构模型
→时间:1911年
→原子学说或原子结构模型:
英国物理学家卢瑟福提出了带核的原子结构模型
→主要理论依据或技术手段:α粒子散射现象
→原子学说或原子结构模型的主要论点:
原子的内部结构并不是均匀的,而是存在一个中心的“核”,称为原子核。原子核带正电,电子在其周围高速运动,就像行星围绕太阳运转一样。
卢瑟福根据α粒子散射现象,
提出带核的原子结构模型
玻尔的轨道原子结构模型
→时间:1913年
→原子学说或原子结构模型:
丹麦物理学家玻尔提出新的原子结构模型
→主要理论依据或技术手段:
引入量子论观点,揭示了氢原子的结构
→原子学说或原子结构模型的主要论点:
原子核外,电子在一系列稳定的轨道上运动,每个轨道都具有一个确定的能量值;核外电子在这些稳定的轨道上运动时,既不放出能量,也不吸收能量。
玻尔研究氢原子光谱,
提出新的原子结构模型
电子云模型
从上述对原子结构认识的发展历程可知,20世纪初人们才算真正意义上揭开了原子结 构的神秘面纱,对微观世界的认识也越来越清晰,并仍然在逐步深化中。到了20世纪末和 21世纪初,原子结构理论进入了新的发展期。20世纪初,科学家提出,原子核外电子的运动不遵循经典力学的原理,必须用量子力学模型描述核外电子的运动。即现代量子力学模型(电子云模型)。
模型建构
模型本质上是科学家描述事物的原型,解释和预测未知现象的一种思维方式,广泛应用于科学发现和发明的过程中。从原子结构模型的发展历程可以看出,科学家通过不同的实验收集各种证据,从而提出原子结构模型,并不断修正模型。科学家在一定时期建构的模型不是绝对的、一成不变的,而是依据知识的积累、方法和技术的更新、实验证据的不断完善而动态发展的。
02
原子核的构成
课前导入
原子是由原子核和核外电子构成的,原子的质量几乎都集中在原子核上。绝大多数原子核由带正电荷的质子和不带电荷的中子构成。一个原子的核内质子数和核外电子数相等,所以原子是电中性的。
质子、中子和电子的质量和带电荷量 微粒 质量/kg 带电荷量/C
质子 1.673×10-27 1.602×10-19
中子 1.675×10-27 0
电子 9.109×10-31 -1.602×10-19
核素与质量数的概念
一种元素的原子具有相同的质子数,但中子数不一定相同。如氢元素在自然界中存在氕(,)、氘(,)、氚(,)三种原子,它们的原子核内部都含有1个质子,中子数分别为0、1、2。其中氘称为重氢(D),氚称为超重氢(T),它们是制造氢弹的原料。又如,碳元素在自然界中存在三种原子,它们的质子数都是6,中子数分别为6、7、8,可分别表示为、、,12C原子就是指质子数和中子数都是6的碳原子。人们把具有一定质子数和一定中子数的一种原子称为一种核素。将原子核内所有的质子和中子的相对质量取整数,加起来所得到的数值称为质量数(用符号A表示),常用质子数(Z)与中子数(N)之和表示。
氢元素三种核素的原子结构模型
原子结构的表示方法
质量数
质子数
元素符号
原子核中质子数和中子数之和称为质量数
质子数(Z) + 中子数(N)= 质量数(A)
例如表示质量数为14,质子数为6的碳原子
构成原子的有关微粒之间的关系可表示为
同位素
→定义:质子数相同而中子数不同的同一种元素的不同核素互为同位素。
→分类:同位素分为稳定同位素和放射性同位素。
→位置:因质子数相同,故元素符号相同,在元素周期表中占据同一位置(即同位)
→结构:质子数相同,中子数不同
→性质:化学性质几乎完全相同,物理性质略有差距
→存在:天然存在的同位素在自然里的丰都是固定不变的
同位素的应用
2H、3H→制造氢弹
235U→核反应堆的原料
12C→计算其他原子的相对原子质量的标准
14C→测定文物的存在年代
放射性同位素→放射性同位素最常见的应用是进行同位素示踪和用作放射源。例如,追踪植物中放射性32P发出的射线,能够确定磷在植物中的作用部位;应用放射性同位素发出的射线,可以进行金属制品探伤、人体疾病诊断和肿瘤治疗等
夸克
原子由质子、中子、电子等基本粒子构成。那么,基本粒子可不可以再分呢?1964年,美国科学家盖尔曼提出质子、中子由更小的夸克构成,建构了夸克模型。该模型能解释许多事实,引起了人们的普遍关注。1967年,以弗里德曼、肯达尔、泰勒为核心的研究小组,在美国斯坦福大学直线加速器中心进行实验,证明了夸克的存在。这三位科学家因此获得了1990年诺贝尔物理学奖。
但迄今为止,人们尚未能分离出单个的夸克。美国科学家戴维 · 格罗斯、戴维 · 波利策和弗兰克·维尔切克发现当夸克相距很近时相互作用力很小,但当距离增大时相互作用力急剧增大。这解释了人们在寻找单个夸克时遭遇的困境。这三位科学家因此获得了2004年诺贝尔物理学奖。
构成物质的
微粒示意图
同位素在考古中的应用
考古学家们挖掘出生物化石,如何较准确地测定其年代呢?同位素在考古断代上功不可没。生物化石中含有14C。在生物死亡前,由于生命活动伴随体内含碳元素物质与自然界中碳元素的交换,生物体中14C所占碳原子的比例和大气中14C所占碳原子的比例相同。大气中14C所占碳原子的比例是恒定的。但当生物体死亡后,其体内的14C和大气中的14C停止交换,生物体内的14C所占碳原子比例因衰变而减少,每5 730年14C就减少一半。因此,测定出土文物或化石中14C所占碳原子比例,与大气中的恒定值进行比较,就可以测算出其死亡的年代。
03
课堂小结
04
课堂练习
1.下列说法正确的是( )
A.道尔顿根据一些元素化合时的质量比例关系,提出了原子学说
B.汤姆生通过阴极射线发现电子后,提出了“行星模型”
C.卢瑟福根据α粒子散射现象,提出了“葡萄干面包式”的原子结构模型
D.泰勒根据氢原子光谱,引入量子论观点,提出了“原子轨道模型”
A
2.重水(D2O)是重要的核工业原料,下列说法错误的是( )
A.氘(D)原子核外有1个电子
B.1H与D互为同位素
C.H2O与D2O相对分子质量相同
D.1H218O与D216O的相对分子质量相同
C
3.医学界通过用放射性14C标记C60,发现一种C60的羧酸衍生物在特定条件下可通过断裂DNA杀死细胞,从而抑制艾滋病(AIDS)。下列有关14C的叙述正确的是( )。
A.14C和12C的化学性质相同
B.14C与14N含的中子数相同
C.14C是一种新的元素
D.14C与C60互为同位素
A
4.下列叙述正确的是( )
A.40K和40Ca原子中质子数和中子数都不相等
B.金刚石和石墨的性质相同
C.H2和D2互为同位素
D.某物质只含一种元素,该物质一定是纯净物
A
感谢您的聆听
专题2 研究物质的基本方法
第三单元 人类对原子结构的认识
2.3.1人类对原子结构的认识
核心素养目标
科学态度与社会责任:
了解同位素在能源、医疗、考古等领域的应用,认识化学科学对社会发展的重要贡献,增强社会责任感。
证据推理与模型认知:
依据原子结构模型演变的科学史实和实验证据,推理原子的核式结构模型,构建 “实验证据 — 理论模型 — 修正完善” 的科学认知模式。
宏观辨识与微观探析:
通过对核素、同位素等概念的学习,从微观角度理解质子数、中子数的差异对原子性质和应用的影响,能从宏观和微观结合的视角分析相关化学问题。
教学重难点
重点
原子结构模型的演变历程,包括道尔顿、汤姆生、卢瑟福、玻尔等科学家提出的模型的核心观点及对应的实验依据。
原子核的构成,质量数、质子数、中子数的关系,核素、同位素的概念及表示方法.
有关质量数、质子数、中子数、核外电子数的计算,能根据核素符号进行微观粒子数量的相互换算。
难点
对核素、同位素概念的准确理解和辨析,明确同位素的化学性质相似性及物理性质差异的原因。
从卢瑟福 α 粒子散射实验现象推理原子的核式结构,理解实验现象与结论之间的逻辑关系。
质量数与相对原子质量的区别,以及在实际问题中对微观粒子数量关系的灵活运用。
课前导入
核武器主要包括裂变武器(第一代核武器,通常称为原子弹)和聚变武器(亦称为氢弹,分为两级式和三级式)。利用铀235或钚239等重原子核的裂变链式反应原理制成的裂变武器,通常称为原子弹;利用重氢或超重氢等轻原子核的热核反应原理制成的热核武器或聚变武器,通常称为氢弹。你知道重氢和超重氢的结构组成及相互关系吗
01
人类认识原子结构的历程
玻尔的量子化模型
汤姆生的葡萄干模型
道尔顿的实心球模型
卢瑟福的核式模型
现代
20世纪20年代
电子云模型
原子结构发展史
道尔顿的原子学说
→时间:
19世纪初
→原子学说或原子结构模型:
英国科学家道尔顿提出了原子学说
→主要理论依据或技术手段:
一些元素形成化合物时的质量比例关系
→原子学说或原子结构模型的主要论点:
他认为物质由原子组成,原子不能被创造,也能被毁灭,它们在化学变化中不可再分割。
道尔顿和他的原子
结构模型
汤姆生的原子结构模型
→时间:
1897年
→原子学说或原子结构模型:
英国物理学家汤姆生出了“葡萄干面包式”的原子结构模型
→原子学说或原子结构模型的主要论点:
原子中存在电子,为氢原子质量的1/1836;
原子是由一个云状的带正电荷的球体,以及均匀地镶嵌在球体中的许多电子组成的。
汤姆生发现电子
提出原子结构模型
卢瑟福的原子结构模型
→时间:1911年
→原子学说或原子结构模型:
英国物理学家卢瑟福提出了带核的原子结构模型
→主要理论依据或技术手段:α粒子散射现象
→原子学说或原子结构模型的主要论点:
原子的内部结构并不是均匀的,而是存在一个中心的“核”,称为原子核。原子核带正电,电子在其周围高速运动,就像行星围绕太阳运转一样。
卢瑟福根据α粒子散射现象,
提出带核的原子结构模型
玻尔的轨道原子结构模型
→时间:1913年
→原子学说或原子结构模型:
丹麦物理学家玻尔提出新的原子结构模型
→主要理论依据或技术手段:
引入量子论观点,揭示了氢原子的结构
→原子学说或原子结构模型的主要论点:
原子核外,电子在一系列稳定的轨道上运动,每个轨道都具有一个确定的能量值;核外电子在这些稳定的轨道上运动时,既不放出能量,也不吸收能量。
玻尔研究氢原子光谱,
提出新的原子结构模型
电子云模型
从上述对原子结构认识的发展历程可知,20世纪初人们才算真正意义上揭开了原子结 构的神秘面纱,对微观世界的认识也越来越清晰,并仍然在逐步深化中。到了20世纪末和 21世纪初,原子结构理论进入了新的发展期。20世纪初,科学家提出,原子核外电子的运动不遵循经典力学的原理,必须用量子力学模型描述核外电子的运动。即现代量子力学模型(电子云模型)。
模型建构
模型本质上是科学家描述事物的原型,解释和预测未知现象的一种思维方式,广泛应用于科学发现和发明的过程中。从原子结构模型的发展历程可以看出,科学家通过不同的实验收集各种证据,从而提出原子结构模型,并不断修正模型。科学家在一定时期建构的模型不是绝对的、一成不变的,而是依据知识的积累、方法和技术的更新、实验证据的不断完善而动态发展的。
02
原子核的构成
课前导入
原子是由原子核和核外电子构成的,原子的质量几乎都集中在原子核上。绝大多数原子核由带正电荷的质子和不带电荷的中子构成。一个原子的核内质子数和核外电子数相等,所以原子是电中性的。
质子、中子和电子的质量和带电荷量 微粒 质量/kg 带电荷量/C
质子 1.673×10-27 1.602×10-19
中子 1.675×10-27 0
电子 9.109×10-31 -1.602×10-19
核素与质量数的概念
一种元素的原子具有相同的质子数,但中子数不一定相同。如氢元素在自然界中存在氕(,)、氘(,)、氚(,)三种原子,它们的原子核内部都含有1个质子,中子数分别为0、1、2。其中氘称为重氢(D),氚称为超重氢(T),它们是制造氢弹的原料。又如,碳元素在自然界中存在三种原子,它们的质子数都是6,中子数分别为6、7、8,可分别表示为、、,12C原子就是指质子数和中子数都是6的碳原子。人们把具有一定质子数和一定中子数的一种原子称为一种核素。将原子核内所有的质子和中子的相对质量取整数,加起来所得到的数值称为质量数(用符号A表示),常用质子数(Z)与中子数(N)之和表示。
氢元素三种核素的原子结构模型
原子结构的表示方法
质量数
质子数
元素符号
原子核中质子数和中子数之和称为质量数
质子数(Z) + 中子数(N)= 质量数(A)
例如表示质量数为14,质子数为6的碳原子
构成原子的有关微粒之间的关系可表示为
同位素
→定义:质子数相同而中子数不同的同一种元素的不同核素互为同位素。
→分类:同位素分为稳定同位素和放射性同位素。
→位置:因质子数相同,故元素符号相同,在元素周期表中占据同一位置(即同位)
→结构:质子数相同,中子数不同
→性质:化学性质几乎完全相同,物理性质略有差距
→存在:天然存在的同位素在自然里的丰都是固定不变的
同位素的应用
2H、3H→制造氢弹
235U→核反应堆的原料
12C→计算其他原子的相对原子质量的标准
14C→测定文物的存在年代
放射性同位素→放射性同位素最常见的应用是进行同位素示踪和用作放射源。例如,追踪植物中放射性32P发出的射线,能够确定磷在植物中的作用部位;应用放射性同位素发出的射线,可以进行金属制品探伤、人体疾病诊断和肿瘤治疗等
夸克
原子由质子、中子、电子等基本粒子构成。那么,基本粒子可不可以再分呢?1964年,美国科学家盖尔曼提出质子、中子由更小的夸克构成,建构了夸克模型。该模型能解释许多事实,引起了人们的普遍关注。1967年,以弗里德曼、肯达尔、泰勒为核心的研究小组,在美国斯坦福大学直线加速器中心进行实验,证明了夸克的存在。这三位科学家因此获得了1990年诺贝尔物理学奖。
但迄今为止,人们尚未能分离出单个的夸克。美国科学家戴维 · 格罗斯、戴维 · 波利策和弗兰克·维尔切克发现当夸克相距很近时相互作用力很小,但当距离增大时相互作用力急剧增大。这解释了人们在寻找单个夸克时遭遇的困境。这三位科学家因此获得了2004年诺贝尔物理学奖。
构成物质的
微粒示意图
同位素在考古中的应用
考古学家们挖掘出生物化石,如何较准确地测定其年代呢?同位素在考古断代上功不可没。生物化石中含有14C。在生物死亡前,由于生命活动伴随体内含碳元素物质与自然界中碳元素的交换,生物体中14C所占碳原子的比例和大气中14C所占碳原子的比例相同。大气中14C所占碳原子的比例是恒定的。但当生物体死亡后,其体内的14C和大气中的14C停止交换,生物体内的14C所占碳原子比例因衰变而减少,每5 730年14C就减少一半。因此,测定出土文物或化石中14C所占碳原子比例,与大气中的恒定值进行比较,就可以测算出其死亡的年代。
03
课堂小结
04
课堂练习
1.下列说法正确的是( )
A.道尔顿根据一些元素化合时的质量比例关系,提出了原子学说
B.汤姆生通过阴极射线发现电子后,提出了“行星模型”
C.卢瑟福根据α粒子散射现象,提出了“葡萄干面包式”的原子结构模型
D.泰勒根据氢原子光谱,引入量子论观点,提出了“原子轨道模型”
A
2.重水(D2O)是重要的核工业原料,下列说法错误的是( )
A.氘(D)原子核外有1个电子
B.1H与D互为同位素
C.H2O与D2O相对分子质量相同
D.1H218O与D216O的相对分子质量相同
C
3.医学界通过用放射性14C标记C60,发现一种C60的羧酸衍生物在特定条件下可通过断裂DNA杀死细胞,从而抑制艾滋病(AIDS)。下列有关14C的叙述正确的是( )。
A.14C和12C的化学性质相同
B.14C与14N含的中子数相同
C.14C是一种新的元素
D.14C与C60互为同位素
A
4.下列叙述正确的是( )
A.40K和40Ca原子中质子数和中子数都不相等
B.金刚石和石墨的性质相同
C.H2和D2互为同位素
D.某物质只含一种元素,该物质一定是纯净物
A
感谢您的聆听
