2.3.2人类对原子结构的认识 教学课件(共29张PPT)高中化学苏教版(2019)必修一
文档属性
| 名称 | 2.3.2人类对原子结构的认识 教学课件(共29张PPT)高中化学苏教版(2019)必修一 |  | |
| 格式 | pptx | ||
| 文件大小 | 28.8MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 苏教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2025-07-02 09:54:33 | ||
图片预览








文档简介
(共29张PPT)
专题2 研究物质的基本方法
第三单元 人类对原子结构的认识
2.3.2 原子核外电子排布
核心素养目标
科学态度与社会责任:
了解核外电子排布知识在化学研究、材料科学等领域的应用,体会化学知识的社会价值,增强社会责任感。
证据推理与模型认知:
运用核外电子排布规律,解释离子的形成过程及结构特点,能根据原子或离子的结构特征进行相关推理和判断。
宏观辨识与微观探析:
通过原子结构示意图等宏观表征,理解微观电子层能量高低、电子排布对原子得失电子能力的影响。
教学重难点
重点
核外电子排布的规律,包括电子层的能量高低顺序、各电子层最多容纳的电子数、最外层电子数限制等。
1~18 号元素原子结构示意图的正确书写,以及根据原子结构示意图分析元素的化学性质和化合价。
难点
对核外电子排布规律的理解和灵活运用,尤其是在具体情境中综合运用各条规律推测原子的电子层结构。
从核外电子排布的角度理解元素化学性质的本质,如金属元素、非金属元素在化学反应中得失电子的规律。
课前导入
我们已经知道,原子是由原子核和核外电子构成的,核外电子在原子核外高速运动。那么,这些电子在原子核外是如何排布的呢?它们的排布又遵循着怎样的规律?这些规律又如何影响着元素的化学性质和化合价呢?
今天,我们就来学习原子核外电子排布的知识,一起探索这些问题的答案。通过本节课的学习,我们将能够用核外电子排布的规律来解释元素的化学性质和化合价,为后续学习元素周期律等知识打下坚实的基础。大家可以先思考一个问题:如果把核外电子看作是在不同楼层居住的居民,那么这些 “居民” 在 “楼层” 中的分布会有什么规律呢?让我们带着这个问题开始今天的学习。
01
原子核外电子排布
电子层
概念:
现代物质结构理论认为,在含有多个电子的原子里,能量低的电子通常在离核较近的区域内运动,能量高的电子通常在离核较远的区域内运动。为了研究问题的方便,科学家认为电子是在原子核外离核由近及远、能量由低到高的不同电子层上分层排布的。
电子层
电子层序数 1 2 3 4 5 6 7
电子层符号 K L M N O P Q
离核距离 电子能量 原子核外电子的排布规律
→能量规律:
原子核外电子总是尽可能先排布在能量较低的电子层上,然后由内向外依次排布在能量逐渐升高的电子层上
→数量规律:
每个电子层最多能容纳 2n2(n 代表电子层数)个电子
最外层所能容纳的电子则不超过 8 个(第一层为最外层时不超过 2 个)
次外层电子不超过18个
倒数第三层电子不超过32个
原子结构示意图
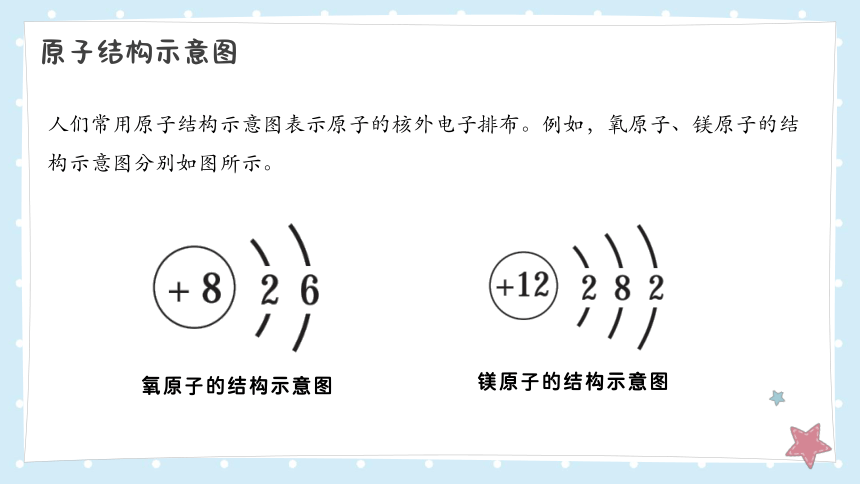
人们常用原子结构示意图表示原子的核外电子排布。例如,氧原子、镁原子的结构示意图分别如图所示。
氧原子的结构示意图
镁原子的结构示意图
原子结构示意图
原子结构示意图中,圆圈表示原子核并标明核电荷数,圆圈外的每一段弧线代表不同的电子层,数字代表该电子层中的电子数。例如,钠原子的结构示意图如图所示
离子结构示意图
当主族中的金属元素原子失去最外层所有电子变为离子时,电子层数减少一层,形成与上一周期稀有气体元素原子相同的电子层结构(电子层数相同,每层上所排布的电子数也相同)。
离子结构示意图
非金属元素的原子得电子形成简单离子时,形成和同周期稀有气体元素原子相同的电子层结构
氯化镁的形成示意图
02
原子结构与元素性质的关系
稀有气体元素
最外层电子数:8(He为2)
稳定性:稳定
原子得失电子能力:既不容易获得电子,也不容易失去电子
化合价:通常表现为0价
金属元素
最外层电子数:一般小于4
稳定性:不稳定
原子得失电子能力:容易失去电子形成阳离子
化合价:在化合物中通常表现为正价
如钠原子的最外层只有 1 个电子,原子容易失去 1 个电子形成 Na+ 而达到稳定结构,因此钠元素在化合物中呈 +1 价
原子最外层的电子小于4的元素不一定是金属元素。如H、He、B。
非金属元素
最外层电子数:一般大于或者等于4
稳定性:不稳定
原子得失电子能力:容易获得电子形成阴离子
化合价:在化合物中通常表现为负价(除F外,其他非金属元素也有正化合价)
如氯原子的最外层有 7 个电子,原子容易获得 1 个电子形成 Cl-而达到稳定结构,因此氯元素在氯化钠、氯化镁等氯化物中呈 -1 价。
原子最外层电子数大于4的元素不一定是非金属元素,如Bi(铋)
核电荷数为1~20的原子或离子的结构特点
(1)没有中子的原子是1H
(2)最外层电子数为1的原子有H、Li、Na、K
(3)最外层电子数为2的原子有He、Be、Mg、Ca。
(4)原子最外层电子数与次外层电子数存在倍数关系:
①最外层电子数与次外层电子数相等的原子有Be、Ar
②最外层电子数是次外层电子数2倍的原子是C
③最外层电子数是次外层电子数3倍的原子是O
④最外层电子数是次外层电子数4倍的原子是Ne
⑤次外层电子数是最外层电子数2倍的原子有Li、Si
核电荷数为1~20的原子或离子的结构特点
(5)原子最外层电子数与电子层数存在倍数关系:
①电子层数与最外层电子数相等的原子有H、Be、Al
②电子层数是最外层电子数2倍的原子有Li、Ca。
③电子层数是最外层电子数3倍的原子是Na。
④最外层电子数是电子层数2倍的原子有He、C、S
⑤最外层电子数是电子层数3倍的原子是O
(6)内层电子总数是最外层电子数2倍的原子有Li、P
(7)最外层电子数与最内层电子数相等的原子有Be、Mg、Ca。
常见的10电子微粒
Ar
(出发点)
K+
Ca2+
F2、H2O2、N2H4、CH3OH、CH3F、NH2OH
HCl
H2S
PH3
SiH4
PH4+
N3-
HS-
S2-
Cl-
常见的18电子微粒
Ne
(出发点)
Na+
Mg2+
Al3+
HF
H2O
NH3
CH4
NH4+
N3-
OH-
O2-
H3O+
F-
03
课堂小结
04
课堂练习
1.在多电子的原子里,电子在不同的能量区域内运动。我们把不同的能量区域简化为电子层,下列有关电子层的叙述错误的是( )
A.离核较近的电子层能量较低
B.离核越近,最多能填充的电子越多
C.第3层的符号为M
D.第N层最多能填充的电子数为32
B
2.下列叙述正确的是( )
A.电子的能量越低,运动区域离核越远
B.核外电子的分层排布即核外电子的分层运动
C.稀有气体元素原子的最外层都排有8个电子
D.当M层是最外层时,最多可排布18个电子
B
3.下列关于原子核外电子排布规律的说法错误的是( )
A.K层是能量最低的电子层
B.原子失电子时先失去能量高的电子
C.核外电子总是优先排布在能量较低的电子层上
D.N层为次外层时,最多可容纳的电子数为32
D
4.下列说法中肯定错误的是( )
A.某原子K层上只有1个电子
B.某原子M层上电子数为L层电子数的4倍
C.某离子M层上和L层上的电子数均为K层的4倍
D.某离子的核电荷数与最外层电子数相等
B
感谢您的聆听
专题2 研究物质的基本方法
第三单元 人类对原子结构的认识
2.3.2 原子核外电子排布
核心素养目标
科学态度与社会责任:
了解核外电子排布知识在化学研究、材料科学等领域的应用,体会化学知识的社会价值,增强社会责任感。
证据推理与模型认知:
运用核外电子排布规律,解释离子的形成过程及结构特点,能根据原子或离子的结构特征进行相关推理和判断。
宏观辨识与微观探析:
通过原子结构示意图等宏观表征,理解微观电子层能量高低、电子排布对原子得失电子能力的影响。
教学重难点
重点
核外电子排布的规律,包括电子层的能量高低顺序、各电子层最多容纳的电子数、最外层电子数限制等。
1~18 号元素原子结构示意图的正确书写,以及根据原子结构示意图分析元素的化学性质和化合价。
难点
对核外电子排布规律的理解和灵活运用,尤其是在具体情境中综合运用各条规律推测原子的电子层结构。
从核外电子排布的角度理解元素化学性质的本质,如金属元素、非金属元素在化学反应中得失电子的规律。
课前导入
我们已经知道,原子是由原子核和核外电子构成的,核外电子在原子核外高速运动。那么,这些电子在原子核外是如何排布的呢?它们的排布又遵循着怎样的规律?这些规律又如何影响着元素的化学性质和化合价呢?
今天,我们就来学习原子核外电子排布的知识,一起探索这些问题的答案。通过本节课的学习,我们将能够用核外电子排布的规律来解释元素的化学性质和化合价,为后续学习元素周期律等知识打下坚实的基础。大家可以先思考一个问题:如果把核外电子看作是在不同楼层居住的居民,那么这些 “居民” 在 “楼层” 中的分布会有什么规律呢?让我们带着这个问题开始今天的学习。
01
原子核外电子排布
电子层
概念:
现代物质结构理论认为,在含有多个电子的原子里,能量低的电子通常在离核较近的区域内运动,能量高的电子通常在离核较远的区域内运动。为了研究问题的方便,科学家认为电子是在原子核外离核由近及远、能量由低到高的不同电子层上分层排布的。
电子层
电子层序数 1 2 3 4 5 6 7
电子层符号 K L M N O P Q
离核距离 电子能量 原子核外电子的排布规律
→能量规律:
原子核外电子总是尽可能先排布在能量较低的电子层上,然后由内向外依次排布在能量逐渐升高的电子层上
→数量规律:
每个电子层最多能容纳 2n2(n 代表电子层数)个电子
最外层所能容纳的电子则不超过 8 个(第一层为最外层时不超过 2 个)
次外层电子不超过18个
倒数第三层电子不超过32个
原子结构示意图
人们常用原子结构示意图表示原子的核外电子排布。例如,氧原子、镁原子的结构示意图分别如图所示。
氧原子的结构示意图
镁原子的结构示意图
原子结构示意图
原子结构示意图中,圆圈表示原子核并标明核电荷数,圆圈外的每一段弧线代表不同的电子层,数字代表该电子层中的电子数。例如,钠原子的结构示意图如图所示
离子结构示意图
当主族中的金属元素原子失去最外层所有电子变为离子时,电子层数减少一层,形成与上一周期稀有气体元素原子相同的电子层结构(电子层数相同,每层上所排布的电子数也相同)。
离子结构示意图
非金属元素的原子得电子形成简单离子时,形成和同周期稀有气体元素原子相同的电子层结构
氯化镁的形成示意图
02
原子结构与元素性质的关系
稀有气体元素
最外层电子数:8(He为2)
稳定性:稳定
原子得失电子能力:既不容易获得电子,也不容易失去电子
化合价:通常表现为0价
金属元素
最外层电子数:一般小于4
稳定性:不稳定
原子得失电子能力:容易失去电子形成阳离子
化合价:在化合物中通常表现为正价
如钠原子的最外层只有 1 个电子,原子容易失去 1 个电子形成 Na+ 而达到稳定结构,因此钠元素在化合物中呈 +1 价
原子最外层的电子小于4的元素不一定是金属元素。如H、He、B。
非金属元素
最外层电子数:一般大于或者等于4
稳定性:不稳定
原子得失电子能力:容易获得电子形成阴离子
化合价:在化合物中通常表现为负价(除F外,其他非金属元素也有正化合价)
如氯原子的最外层有 7 个电子,原子容易获得 1 个电子形成 Cl-而达到稳定结构,因此氯元素在氯化钠、氯化镁等氯化物中呈 -1 价。
原子最外层电子数大于4的元素不一定是非金属元素,如Bi(铋)
核电荷数为1~20的原子或离子的结构特点
(1)没有中子的原子是1H
(2)最外层电子数为1的原子有H、Li、Na、K
(3)最外层电子数为2的原子有He、Be、Mg、Ca。
(4)原子最外层电子数与次外层电子数存在倍数关系:
①最外层电子数与次外层电子数相等的原子有Be、Ar
②最外层电子数是次外层电子数2倍的原子是C
③最外层电子数是次外层电子数3倍的原子是O
④最外层电子数是次外层电子数4倍的原子是Ne
⑤次外层电子数是最外层电子数2倍的原子有Li、Si
核电荷数为1~20的原子或离子的结构特点
(5)原子最外层电子数与电子层数存在倍数关系:
①电子层数与最外层电子数相等的原子有H、Be、Al
②电子层数是最外层电子数2倍的原子有Li、Ca。
③电子层数是最外层电子数3倍的原子是Na。
④最外层电子数是电子层数2倍的原子有He、C、S
⑤最外层电子数是电子层数3倍的原子是O
(6)内层电子总数是最外层电子数2倍的原子有Li、P
(7)最外层电子数与最内层电子数相等的原子有Be、Mg、Ca。
常见的10电子微粒
Ar
(出发点)
K+
Ca2+
F2、H2O2、N2H4、CH3OH、CH3F、NH2OH
HCl
H2S
PH3
SiH4
PH4+
N3-
HS-
S2-
Cl-
常见的18电子微粒
Ne
(出发点)
Na+
Mg2+
Al3+
HF
H2O
NH3
CH4
NH4+
N3-
OH-
O2-
H3O+
F-
03
课堂小结
04
课堂练习
1.在多电子的原子里,电子在不同的能量区域内运动。我们把不同的能量区域简化为电子层,下列有关电子层的叙述错误的是( )
A.离核较近的电子层能量较低
B.离核越近,最多能填充的电子越多
C.第3层的符号为M
D.第N层最多能填充的电子数为32
B
2.下列叙述正确的是( )
A.电子的能量越低,运动区域离核越远
B.核外电子的分层排布即核外电子的分层运动
C.稀有气体元素原子的最外层都排有8个电子
D.当M层是最外层时,最多可排布18个电子
B
3.下列关于原子核外电子排布规律的说法错误的是( )
A.K层是能量最低的电子层
B.原子失电子时先失去能量高的电子
C.核外电子总是优先排布在能量较低的电子层上
D.N层为次外层时,最多可容纳的电子数为32
D
4.下列说法中肯定错误的是( )
A.某原子K层上只有1个电子
B.某原子M层上电子数为L层电子数的4倍
C.某离子M层上和L层上的电子数均为K层的4倍
D.某离子的核电荷数与最外层电子数相等
B
感谢您的聆听
