1.2 反应热的计算 学案(含答案) 2025-2026学年高二化学人教版(2019)选择性必修第一册
文档属性
| 名称 | 1.2 反应热的计算 学案(含答案) 2025-2026学年高二化学人教版(2019)选择性必修第一册 |  | |
| 格式 | docx | ||
| 文件大小 | 85.1KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2025-07-02 22:30:24 | ||
图片预览


文档简介
第二节 反应热的计算
学习目标
1. 能进行有关反应热的简单计算。
2. 认识盖斯定律,能应用盖斯定律推理化学反应的反应热。
活动方案
1. 25 ℃、101 kPa,乙烷和甲醇[CH3OH(l)]的燃烧热依次是1 559.8 kJ/mol、726.5 kJ/mol。分别写出乙烷和甲醇燃烧的热化学方程式。
2. 一些化学键的键能数据如表所示。
化学键 C—H C—F H—F F—F
键能/(kJ/mol) a 489 565 155
已知反应CH4(g)+4F2(g)===CF4(g)+4HF (g) ΔH=-1940 kJ/mol,则C—H的键能是多少?
3. 298 K、101 kPa时,将4.0 g硫粉在O2中完全燃烧生成SO2,放出37 kJ热量,计算S的燃烧热。
4. 已知:C(s)+O2(g)===CO2(g) ΔH=-393.5 kJ/mol;
CaCO3(s)===CaO(s)+CO2(g) ΔH=+178.2 kJ/mol。
若要将1 t 碳酸钙煅烧成生石灰,理论上需用多少千克焦炭?
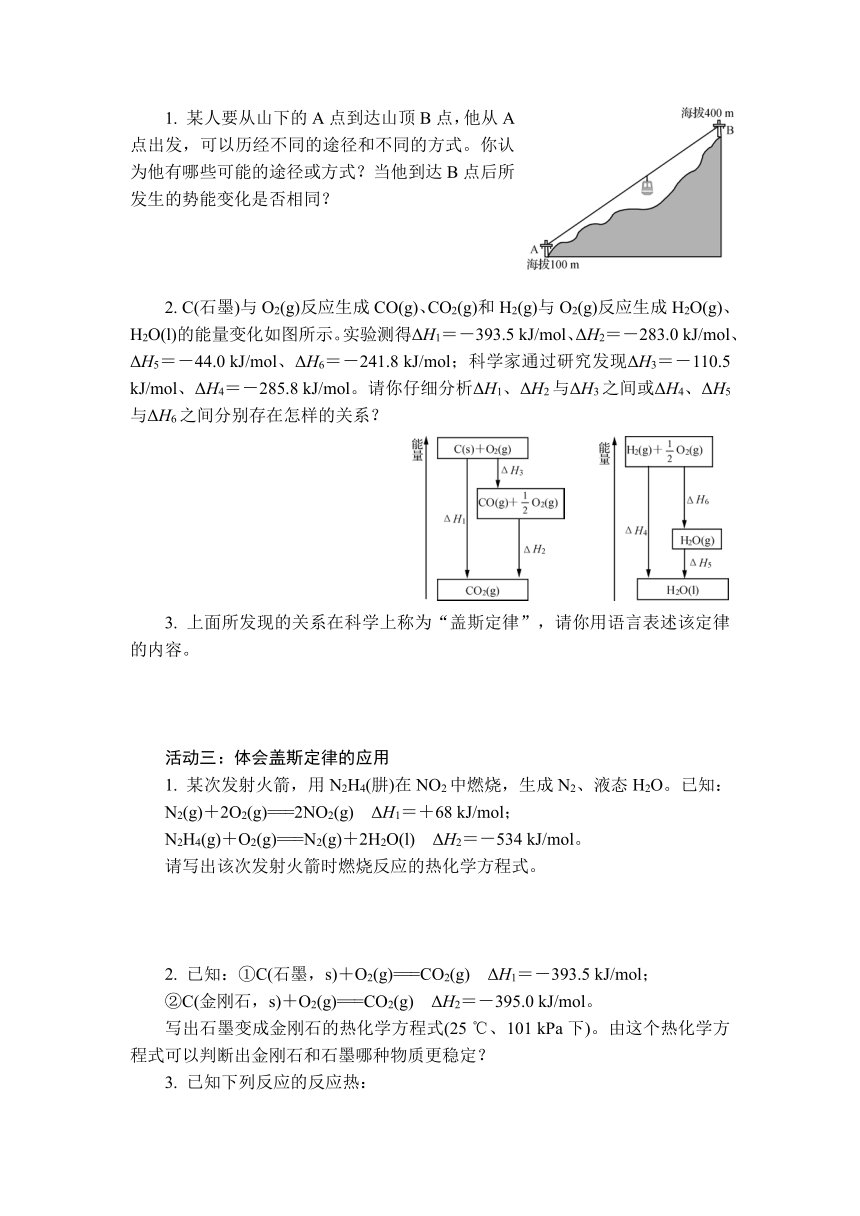
1. 某人要从山下的A点到达山顶B点,他从A点出发,可以历经不同的途径和不同的方式。你认为他有哪些可能的途径或方式?当他到达B点后所发生的势能变化是否相同?
2. C(石墨)与O2(g)反应生成CO(g)、CO2(g)和H2(g)与O2(g)反应生成H2O(g)、H2O(l)的能量变化如图所示。实验测得ΔH1=-393.5 kJ/mol、ΔH2=-283.0 kJ/mol、ΔH5=-44.0 kJ/mol、ΔH6=-241.8 kJ/mol;科学家通过研究发现ΔH3=-110.5 kJ/mol、ΔH4=-285.8 kJ/mol。请你仔细分析ΔH1、ΔH2与ΔH3之间或ΔH4、ΔH5与ΔH6之间分别存在怎样的关系?
3. 上面所发现的关系在科学上称为“盖斯定律”,请你用语言表述该定律的内容。
1. 某次发射火箭,用N2H4(肼)在NO2中燃烧,生成N2、液态H2O。已知:
N2(g)+2O2(g)===2NO2(g) ΔH1=+68 kJ/mol;
N2H4(g)+O2(g)===N2(g)+2H2O(l) ΔH2=-534 kJ/mol。
请写出该次发射火箭时燃烧反应的热化学方程式。
2. 已知:①C(石墨,s)+O2(g)===CO2(g) ΔH1=-393.5 kJ/mol;
②C(金刚石,s)+O2(g)===CO2(g) ΔH2=-395.0 kJ/mol。
写出石墨变成金刚石的热化学方程式(25 ℃、101 kPa下)。由这个热化学方程式可以判断出金刚石和石墨哪种物质更稳定?
3. 已知下列反应的反应热:
(1) CH3COOH(l)+2O2(g)===2CO2(g)+2H2O(l) ΔH1=-870.3 kJ/mol;
(2) C(s)+O2(g)===CO2(g) ΔH2=-393.5 kJ/mol;
(3) H2(g)+O2(g)===H2O(l) ΔH3=-285.8 kJ/mol。
试计算反应2C(s)+2H2(g)+O2(g)===CH3COOH(l)的反应热。
4. 已知H2(g)、C2H4(g)和C2H5OH(l)的燃烧热分别是-285.8 kJ/mol、-1 411.0 kJ/mol和-1 366.8 kJ/mol。计算由C2H4(g)和H2O(l)反应生成C2H5OH(l)的ΔH。
1. 人体内葡萄糖的消耗可用下列热化学方程式表示:C6H12O6(s)+6O2(g)===6CO2(g)+6H2O(l) ΔH=-2 800.6 kJ/mol,如果某人每天消耗12 540 kJ的热量,则他每天至少需摄入葡萄糖的质量为( )
A. 806 g B. 1 000 g C. 1 250 g D. 15 000 g
2. 已知:H2(g)+O2(g)===H2O(l) ΔH=-285.83 kJ/mol;CO(g)+O2(g)===CO2(g) ΔH=-282.9 kJ/mol。若氢气与一氧化碳的混合气体完全燃烧可生成5.4 g H2O(l),并放出114.3 kJ热量,则混合气体中CO的物质的量为 ( )
A. 0.22 mol B. 0.15 mol C. 0.1 mol D. 0.05 mol
3. 已知:①2C(s)+O2(g)===2CO(g) ΔH=-221.0 kJ/mol;
②2H2(g)+O2(g)===2H2O(g) ΔH=-483.6 kJ/mol。
则制备水煤气的反应C(s)+H2O(g)===CO(g)+H2(g)的ΔH为 ( )
A. +262.6 kJ/mol B. -131.3 kJ/mol
C. -352.3 kJ/mol D. +131.3 kJ/mol
4. [鲁科版教材习题]在298 K、100 kPa时,已知:
C(s,石墨)+O2(g)===CO2(g) ΔH1=-393.5 kJ/mol
2H2(g)+O2(g)===2H2O(l) ΔH2=-571.6 kJ/mol
2C2H2(g)+5O2(g)===4CO2(g)+2H2O(l) ΔH3=-2 599 kJ/mol
根据盖斯定律,计算298 K时由C(s,石墨)和H2(g)生成1 mol C2H2(g)的反应焓变。
氨催化氧化是硝酸工业的基础,在某催化剂作用下发生下列两个反应。
4NH3(g)+5O2(g) 4NO(g)+6H2O(g) ΔH=-905 kJ/mol;
4NH3(g)+3O2(g) 2N2(g)+6H2O(g) ΔH=-1 268 kJ/mol。
写出N2氧化为NO的热化学方程式:___________________________________
_____________________________________。
6. 把煤作为燃料可通过下列两种途径:
途径Ⅰ:C(s)+O2(g)===CO2(g) ΔH1<0 ①
途径Ⅱ:先制成水煤气:
C(s)+H2O(g)===CO(g)+H2(g) ΔH2>0 ②
再燃烧水煤气:
2CO(g)+O2(g)===2CO2(g) ΔH3<0 ③
2H2(g)+O2(g)===2H2O(g) ΔH4<0 ④
请回答下列问题。
(1) 途径Ⅰ放出的热量理论上_______(填“>”“<”或“=”)途径Ⅱ放出的热量。
(2) ΔH1、ΔH2、ΔH3、ΔH4的数学关系式是_______________________________。
(3) 已知:
①C(s)+O2(g)===CO2(g) ΔH1=-393.5 kJ/mol;
②2CO(g)+O2(g)===2CO2(g) ΔH2=-566 kJ/mol;
③TiO2(s)+2Cl2(g)===TiCl4(s)+O2(g) ΔH3=+141 kJ/mol。
则TiO2(s)+2Cl2(g)+2C(s)===TiCl4(s)+2CO(g)的ΔH=____________。
第二节 反应热的计算
【活动方案】
活动一:
1 2C2H6(g)+7O2(g)===4CO2(g)+6H2O(l) ΔH=-3119.6 kJ/mol
2CH3OH(l)+3O2(g)===2CO2(g)+4H2O(l) ΔH=-1 453 kJ/mol
2 414 kJ/mol
3 296 kJ/mol
4 54.34 kg
活动二:
1 翻山越岭攀登而上或拾级蜿蜒而上或乘坐索道缆车直奔山顶。势能变化相同。
2 ΔH3=ΔH1-ΔH2或ΔH1=ΔH2+ΔH3
ΔH4=ΔH5+ΔH6或ΔH6=ΔH4-ΔH5
3 一个化学反应,不论是一步完成,还是分几步完成,其总的热效应是完全相同的。或者说一个化学反应的焓变仅与反应的起始状态和反应的最终状态有关,而与反应的途径无关。
活动三:
1 2N2H4(g)+2NO2(g)===3N2(g)+4H2O(l) ΔH=-1 136 kJ/mol
2 ①-②得:C(石墨,s)===C(金刚石,s) ΔH=+1.5 kJ/mol
石墨的能量略低于金刚石的能量;石墨比金刚石稳定。
3 ΔH=2ΔH2+2ΔH3-ΔH1=-488.3 kJ/mol
4 -44.2 kJ/mol
【课堂反馈】
1 A 2 C 3 D
4 2C(s,石墨)+H2(g)===C2H2 (g) ΔH=+226.7 kJ/mol
5 N2(g)+O2(g)===2NO(g) ΔH=+181.5 kJ/mol
6 (1) = (2) ΔH1=ΔH2+
(3) -80 kJ/mol
学习目标
1. 能进行有关反应热的简单计算。
2. 认识盖斯定律,能应用盖斯定律推理化学反应的反应热。
活动方案
1. 25 ℃、101 kPa,乙烷和甲醇[CH3OH(l)]的燃烧热依次是1 559.8 kJ/mol、726.5 kJ/mol。分别写出乙烷和甲醇燃烧的热化学方程式。
2. 一些化学键的键能数据如表所示。
化学键 C—H C—F H—F F—F
键能/(kJ/mol) a 489 565 155
已知反应CH4(g)+4F2(g)===CF4(g)+4HF (g) ΔH=-1940 kJ/mol,则C—H的键能是多少?
3. 298 K、101 kPa时,将4.0 g硫粉在O2中完全燃烧生成SO2,放出37 kJ热量,计算S的燃烧热。
4. 已知:C(s)+O2(g)===CO2(g) ΔH=-393.5 kJ/mol;
CaCO3(s)===CaO(s)+CO2(g) ΔH=+178.2 kJ/mol。
若要将1 t 碳酸钙煅烧成生石灰,理论上需用多少千克焦炭?
1. 某人要从山下的A点到达山顶B点,他从A点出发,可以历经不同的途径和不同的方式。你认为他有哪些可能的途径或方式?当他到达B点后所发生的势能变化是否相同?
2. C(石墨)与O2(g)反应生成CO(g)、CO2(g)和H2(g)与O2(g)反应生成H2O(g)、H2O(l)的能量变化如图所示。实验测得ΔH1=-393.5 kJ/mol、ΔH2=-283.0 kJ/mol、ΔH5=-44.0 kJ/mol、ΔH6=-241.8 kJ/mol;科学家通过研究发现ΔH3=-110.5 kJ/mol、ΔH4=-285.8 kJ/mol。请你仔细分析ΔH1、ΔH2与ΔH3之间或ΔH4、ΔH5与ΔH6之间分别存在怎样的关系?
3. 上面所发现的关系在科学上称为“盖斯定律”,请你用语言表述该定律的内容。
1. 某次发射火箭,用N2H4(肼)在NO2中燃烧,生成N2、液态H2O。已知:
N2(g)+2O2(g)===2NO2(g) ΔH1=+68 kJ/mol;
N2H4(g)+O2(g)===N2(g)+2H2O(l) ΔH2=-534 kJ/mol。
请写出该次发射火箭时燃烧反应的热化学方程式。
2. 已知:①C(石墨,s)+O2(g)===CO2(g) ΔH1=-393.5 kJ/mol;
②C(金刚石,s)+O2(g)===CO2(g) ΔH2=-395.0 kJ/mol。
写出石墨变成金刚石的热化学方程式(25 ℃、101 kPa下)。由这个热化学方程式可以判断出金刚石和石墨哪种物质更稳定?
3. 已知下列反应的反应热:
(1) CH3COOH(l)+2O2(g)===2CO2(g)+2H2O(l) ΔH1=-870.3 kJ/mol;
(2) C(s)+O2(g)===CO2(g) ΔH2=-393.5 kJ/mol;
(3) H2(g)+O2(g)===H2O(l) ΔH3=-285.8 kJ/mol。
试计算反应2C(s)+2H2(g)+O2(g)===CH3COOH(l)的反应热。
4. 已知H2(g)、C2H4(g)和C2H5OH(l)的燃烧热分别是-285.8 kJ/mol、-1 411.0 kJ/mol和-1 366.8 kJ/mol。计算由C2H4(g)和H2O(l)反应生成C2H5OH(l)的ΔH。
1. 人体内葡萄糖的消耗可用下列热化学方程式表示:C6H12O6(s)+6O2(g)===6CO2(g)+6H2O(l) ΔH=-2 800.6 kJ/mol,如果某人每天消耗12 540 kJ的热量,则他每天至少需摄入葡萄糖的质量为( )
A. 806 g B. 1 000 g C. 1 250 g D. 15 000 g
2. 已知:H2(g)+O2(g)===H2O(l) ΔH=-285.83 kJ/mol;CO(g)+O2(g)===CO2(g) ΔH=-282.9 kJ/mol。若氢气与一氧化碳的混合气体完全燃烧可生成5.4 g H2O(l),并放出114.3 kJ热量,则混合气体中CO的物质的量为 ( )
A. 0.22 mol B. 0.15 mol C. 0.1 mol D. 0.05 mol
3. 已知:①2C(s)+O2(g)===2CO(g) ΔH=-221.0 kJ/mol;
②2H2(g)+O2(g)===2H2O(g) ΔH=-483.6 kJ/mol。
则制备水煤气的反应C(s)+H2O(g)===CO(g)+H2(g)的ΔH为 ( )
A. +262.6 kJ/mol B. -131.3 kJ/mol
C. -352.3 kJ/mol D. +131.3 kJ/mol
4. [鲁科版教材习题]在298 K、100 kPa时,已知:
C(s,石墨)+O2(g)===CO2(g) ΔH1=-393.5 kJ/mol
2H2(g)+O2(g)===2H2O(l) ΔH2=-571.6 kJ/mol
2C2H2(g)+5O2(g)===4CO2(g)+2H2O(l) ΔH3=-2 599 kJ/mol
根据盖斯定律,计算298 K时由C(s,石墨)和H2(g)生成1 mol C2H2(g)的反应焓变。
氨催化氧化是硝酸工业的基础,在某催化剂作用下发生下列两个反应。
4NH3(g)+5O2(g) 4NO(g)+6H2O(g) ΔH=-905 kJ/mol;
4NH3(g)+3O2(g) 2N2(g)+6H2O(g) ΔH=-1 268 kJ/mol。
写出N2氧化为NO的热化学方程式:___________________________________
_____________________________________。
6. 把煤作为燃料可通过下列两种途径:
途径Ⅰ:C(s)+O2(g)===CO2(g) ΔH1<0 ①
途径Ⅱ:先制成水煤气:
C(s)+H2O(g)===CO(g)+H2(g) ΔH2>0 ②
再燃烧水煤气:
2CO(g)+O2(g)===2CO2(g) ΔH3<0 ③
2H2(g)+O2(g)===2H2O(g) ΔH4<0 ④
请回答下列问题。
(1) 途径Ⅰ放出的热量理论上_______(填“>”“<”或“=”)途径Ⅱ放出的热量。
(2) ΔH1、ΔH2、ΔH3、ΔH4的数学关系式是_______________________________。
(3) 已知:
①C(s)+O2(g)===CO2(g) ΔH1=-393.5 kJ/mol;
②2CO(g)+O2(g)===2CO2(g) ΔH2=-566 kJ/mol;
③TiO2(s)+2Cl2(g)===TiCl4(s)+O2(g) ΔH3=+141 kJ/mol。
则TiO2(s)+2Cl2(g)+2C(s)===TiCl4(s)+2CO(g)的ΔH=____________。
第二节 反应热的计算
【活动方案】
活动一:
1 2C2H6(g)+7O2(g)===4CO2(g)+6H2O(l) ΔH=-3119.6 kJ/mol
2CH3OH(l)+3O2(g)===2CO2(g)+4H2O(l) ΔH=-1 453 kJ/mol
2 414 kJ/mol
3 296 kJ/mol
4 54.34 kg
活动二:
1 翻山越岭攀登而上或拾级蜿蜒而上或乘坐索道缆车直奔山顶。势能变化相同。
2 ΔH3=ΔH1-ΔH2或ΔH1=ΔH2+ΔH3
ΔH4=ΔH5+ΔH6或ΔH6=ΔH4-ΔH5
3 一个化学反应,不论是一步完成,还是分几步完成,其总的热效应是完全相同的。或者说一个化学反应的焓变仅与反应的起始状态和反应的最终状态有关,而与反应的途径无关。
活动三:
1 2N2H4(g)+2NO2(g)===3N2(g)+4H2O(l) ΔH=-1 136 kJ/mol
2 ①-②得:C(石墨,s)===C(金刚石,s) ΔH=+1.5 kJ/mol
石墨的能量略低于金刚石的能量;石墨比金刚石稳定。
3 ΔH=2ΔH2+2ΔH3-ΔH1=-488.3 kJ/mol
4 -44.2 kJ/mol
【课堂反馈】
1 A 2 C 3 D
4 2C(s,石墨)+H2(g)===C2H2 (g) ΔH=+226.7 kJ/mol
5 N2(g)+O2(g)===2NO(g) ΔH=+181.5 kJ/mol
6 (1) = (2) ΔH1=ΔH2+
(3) -80 kJ/mol
