湖北省宜昌市部分省级示范高中2024_2025学年高二化学上学期期中联考试题(含答案)
文档属性
| 名称 | 湖北省宜昌市部分省级示范高中2024_2025学年高二化学上学期期中联考试题(含答案) |  | |
| 格式 | docx | ||
| 文件大小 | 781.8KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 通用版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2025-07-01 22:48:36 | ||
图片预览



文档简介
考试时间:75分钟 满分:100分
可能用到的相对原子质量:Cl 35.5 O 16 Na 23 S 32 Mn 55 Cu 64 Cr 52
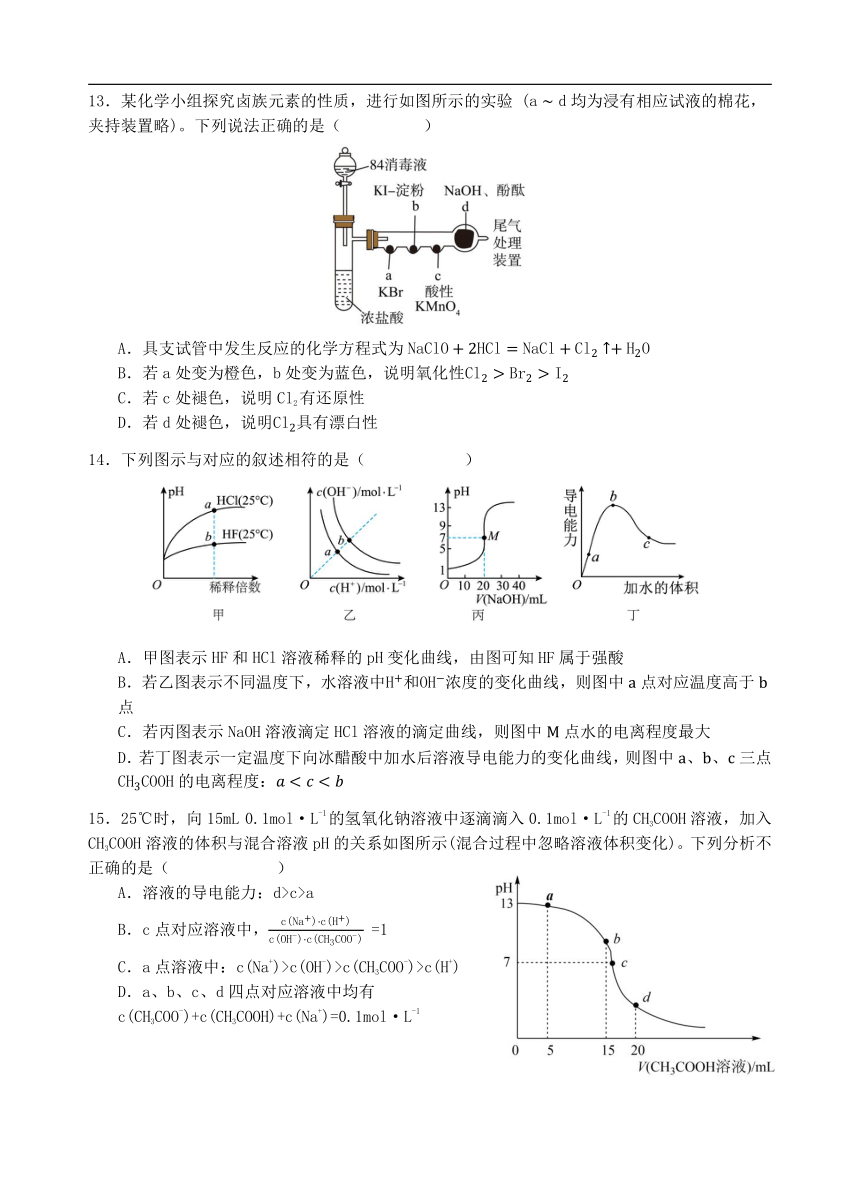
选择题:(本题共15小题,每小题3分,共45分。在每小题给出的四个选项中,只有一项是符合题目要求的)
1.中国古代文物蕴含着瑰丽的中华历史文化,下列文物主要成分属于硅酸盐材料的是( )
A.唐三彩釉陶俑 B.汉《天回医简》竹简 C.商州太阳鸟金饰 D.战国龙凤虎纹丝绸
2.下列事实与盐类水解无关的是( )
A.洗涤油污常用热的纯碱溶液
B.FeCl3溶液腐蚀覆铜板印制电路板
C.配制氯化铁溶液时,先加较浓盐酸溶解氯化铁固体
D.氯化铵溶液中加入镁粉,产生两种气体
3.下列事实不能用平衡移动原理解释的是( )
A.工业合成氨,采用400℃~500℃的高温条件
B.工业制备,加入大量水,同时加热
C.黄色的氯水在光照下颜色变浅
D.25℃~100℃,随温度升高,纯水的减小
4.某实验小组学生用50mL 0.50mol·L-l的盐酸与50mL 0.55mol·L-l的NaOH溶液在如图所示的装置中进行中和反应。通过测定反应过程中所放出的热量计算反应热,下列说法不正确的是( )
A.图中实验装置缺少玻璃搅拌器
B.若分多次加入溶液,测得△H偏高
C.实验中,读取混合溶液不再变化的温度为反应后体系的温度
D.若改用60mL0.50mol·L-l盐酸跟50mL0.55mol·L-l的NaOH溶液进行反应,理论上所求反应热相等
5.已知下列两个反应的热化学方程式,下列说法不正确的是( )
A.1mol液态水与1mol水蒸气所具有的内能不同
B.与反应生成,放出的热量大于285.8KJ
C.常温常压下,等质量的、完全燃烧,放出的热量更多
D.反应的
6.一种高活性有机物中间体分子结构如图。下列有关该物质说法正确的是( )
A.分子式为C10H14O2
B.苯环上的一氯代物有4种
C.含有三种官能团
D.1 mol该有机物与足量金属Na反应可产生H2 22.4 L(标准状况下)
7.常温下,下列各组离子在指定溶液中一定能大量共存的是( )
A.在新制的漂白粉溶液中:、、、
B.的溶液中:、、、
C.由水电离出的的溶液中:、、、
D.的溶液中,、、、
8.下列由实验操作及现象能够得出相应结论的是( )
选项 实验操作及现象 结论
A 密闭容器中发生反应,压缩容器体积,气体颜色变深 增大压强,平衡向逆反应方向移动
B 向等体积浓度均为的溶液中分别滴入溶液和的溶液,的溶液褪色较快 其他条件相同,浓度越大化学速率不一定越快
C 在两组相同的合成氨反应中,其他条件相同,一组加入催化剂,另一组不加催化剂,加入催化剂的一组较快达到平衡状态 催化剂可以增大化学反应速率,降低反应的反应热
D 取溶液,加入几滴溶液,充分反应后,取上层清液滴入KSCN溶液,溶液变成红色 与发生的反应为可逆反应
2
9.在一定体积的密闭容器中给定物质A、B、C的量,在一定条件下发生反应建立的化学平衡:aA(g)+bB(g)xC(g),符合下图所示的关系(C%表示平衡混合气中产物C的百分含量,T表示温度,P表示压强)。在图中Y轴Y轴表示的含义可以是( )
①反应物A的转化率;②平衡混合气中物质B的百分含量;③平衡混合气的密度;
④平衡混合气的平均摩尔质量。
A.①③ B.②③ C.③④ D.①④
10.某食品添加剂的主要成分为WZ(RY4)2 12X2Y。已知X、Y、Z、R、W为原子序数依次增大的前20号主族元素,X、Z的周期序数等于主族序数,Y和R位于同主族,W原子的N层比K层少1个电子。下列说法正确的是( )
A.简单离子半径:W>R>Z>Y
B.Z2Y3既可以与强酸反应,也可以与强碱反应
C.常温下,W单质能与水反应生成能使带火星的木条复燃的气体
D.X2和Y2互为同素异形体
11.醋酸的电离方程式为 时,醋酸的电离常数。下列说法正确的是( )
A.向的醋酸溶液中滴加几滴稀盐酸,醋酸的电离平衡一定逆向移动
B.加水稀释醋酸溶液,增大
C.该温度下,将浓度均为的醋酸与醋酸钠溶液等体积混合,溶液显酸性
D.常温下,溶液加水稀释过程中,变大
12.一定温度下,向2.0L的恒容密闭容器中充入1.6molCO、1.6molNO,发生反应 ,经过一段时间后达平衡。不同时间测得如下表所示。下列说法错误的是( )
0 5 10 15 20
1.6 1.2 0.9 0.8 0.8
A.该温度下,该反应的平衡常数
B.反应在前10s的平均速率为
C.保持其他条件不变,升高温度,达到新平衡时,则反应的
D.相同温度下,起始时向容器中充入,则此时
13.某化学小组探究卤族元素的性质,进行如图所示的实验 (均为浸有相应试液的棉花,夹持装置略)。下列说法正确的是( )
A.具支试管中发生反应的化学方程式为
B.若处变为橙色,处变为蓝色,说明氧化性
C.若c处褪色,说明Cl2有还原性
D.若处褪色,说明具有漂白性
14.下列图示与对应的叙述相符的是( )
A.甲图表示和溶液稀释的变化曲线,由图可知HF属于强酸
B.若乙图表示不同温度下,水溶液中和浓度的变化曲线,则图中点对应温度高于点
C.若丙图表示溶液滴定溶液的滴定曲线,则图中点水的电离程度最大
D.若丁图表示一定温度下向冰醋酸中加水后溶液导电能力的变化曲线,则图中三点的电离程度:
15.25℃时,向15mL 0.1mol·L-1的氢氧化钠溶液中逐滴滴入0.1mol·L-1的CH3COOH溶液,加入CH3COOH溶液的体积与混合溶液pH的关系如图所示(混合过程中忽略溶液体积变化)。下列分析不正确的是( )
A.溶液的导电能力:d>c>a
B.c点对应溶液中, =1
C.a点溶液中:c(Na+)>c(OH-)>c(CH3COO-)>c(H+)
D.a、b、c、d四点对应溶液中均有
c(CH3COO-)+c(CH3COOH)+c(Na+)=0.1mol·L-1
非选择题:(本题共4个小题,共55分)
16.(14分)锑白(Sb2O3,两性氧化物)可用作白色颜料和阻燃剂。一种从含锑工业废渣(主要成分是Sb2O3、Sb2O5,含有CuO、Fe2O3和SiO2等杂质)中制取Sb2O3的工业流程如下图所示。
已知:①“滤液1”的主要阳离子是Sb3+、Sb5+、Fe3+、Cu2+、H+ ;②“滤饼”的成分是SbOCl
回答下列问题:
(1)对含锑废渣进行酸浸时,需多次浸取的目的是 。
(2)“滤渣2”的成分是 。
(3)“稀释水解”主要反应的离子反应方程式为 ;该操作中需要搅拌的原因是 。
(4)“酸洗”后检验沉淀是否洗净的试剂是 。
(5)“转化”时反应的化学方程式为 ;“转化”需控制溶液的pH在7~8,碱性不能过强的原因是 。
17.(14分)无水三氯化铬(CrCl3)为紫色晶体,在工业上主要用作媒染剂和催化剂,某化学小组用Cr2O3和CCl4在加热下制备无水三氯化铬,部分实验装置如图所示。
已知:①CrCl3熔点为83℃,易潮解,易升华,易溶于水但不易水解,高温下易被氧气氧化;②Cr2O3和CCl4在加热下反应的产物为CrCl3和光气(COCl2)。请回答下列问题:
(1)装置A是氮气制备装置,氮气除了排除空气还有的作用是 。
(2)装置B的作用为 ,装置E水槽中盛有 。
(3)装置D中生成CrCl3和光气(COCl2 )的化学方程式为 。
(4)该实验装置有设计不合理的地方,请写出改进方法: 。
(5)产品中CrCl3质量分数的测定:
(i)称取0.3000 g得到的CrCl3样品溶于水并于250mL容量瓶中定容;
(ii)取25.00mL样品溶液于带塞的锥形瓶中,加热至沸腾后加入稍过量的Na2O2,稀释并加热煮沸,再加入过量的H2SO4酸化,将Cr3+氧化为Cr2O72-;再加入过量的KI固体,加塞摇匀,使铬完全以Cr3+形式存在;
(iii)加入指示剂,用0.0250 mol·L-1标准Na2S2O3溶液滴定至终点,平行测定三次,平均消耗标准Na2S2O3溶液21.00mL(已知2Na2S2O3+I2= Na2S4O6+2NaI)。
①加入KI发生反应的离子方程式为 。
②产品中CrCl3质量分数为 %(结果保留到小数点后一位)
18.(13分)(1)①一定温度下,在密闭容器中充入1molN2和3molH2 发生反应:N2(g)+3H2(g)2NH3(g) ΔH<0。若容器容积恒定,达到平衡状态时,气体的总物质的量是原来的,则N2的转化率a1= ;
②若向该容器中再加入3molH2,达到平衡状态时,N2的转化率为 a2,则a2 a1 (填“>”、“<”或“=”)。
(2)对于反应 2NO(g)+O2(g) 2NO2(g)。在其他条件相同时,分别测得NO的平衡转化率在不同压强(P1、P2)下温度变化的曲线(如图)。
①比较 P1、P2 的大小关系:P1 P2(填“>”、“<”或“=”)。
②该反应的平衡常数 K 的表达式为 ,随温度升高,该反应平衡常数变化的趋势是 。(填“增大”、“减小”或“不变”)
③下列措施中能够同时满足增大反应速率和提高NO转化率的是 。(填写相应字母)
使用高效催化剂 B.保持容器体积不变加入惰性气体 C.保持容器体积不变加入O2
D.降低温度 E.压缩容器体积
(3)已知同温同压下,下列反应的焓变和平衡常数分别表示为
①2SO2(g)+O2(g) 2SO3(g) ΔH1=-197 kJ·mol-1 K1=a
②2NO(g)+O2(g) 2NO2(g) ΔH2=-144 kJ·mol-1 K2=b
③NO2(g)+SO2(g) SO3(g)+NO(g) ΔH3=m kJ·mol-1 K3=c
则m的数值为 ,c与a、b之间的关系为c= 。(用含a,b的表达式表示)
19.(14分)部分弱酸的电离平衡常数如表:
弱酸 HCOOH HNO2 H2S H2SO3 H2C2O4
电离平衡常数(25℃) K=1.8×10-4 K=5.1×10-4 K1=9.1×10-8 K2=1×10-12 K1=1.23×10-2 K2=6.6×10-8 K1=5.4×10-2 K2=5.4×10-5
(1)请写出HNO2的电离方程式 。
(2)0.01mol/L的Na2S溶液的pH是 。
(3)上表的5种酸进行比较,酸性最弱的是: ;HCOO-、S2-、 3种离子中,最难结合H+的是 。
(4)在10mL浓度均为0.1mol/L的HCOOH和H2C2O4混合溶液中,逐渐滴入10mL 0.1mol/L的NaOH溶液,写出反应离子方程式: 。
(5)已知HNO2具有强氧化性,弱还原性。将HNO2溶液滴加到H2S溶液中,同时有沉淀和无色气体生成,该气体遇空气立即变为红棕色,试写出两酸之间的化学反应方程式:
。
(6)根据上述信息,下列离子方程式书写正确的是 。
A.HNO2+HS-=+ H2S↑
B.2HCOOH+=2HCOO-+H2O+SO2↑
C.H2SO3+2HCOO-=2HCOOH+
D.H2SO3+=2
E.H2C2O4+=+HNO2
宜昌市部分省级示范高中2024秋季学期高二年级
期中考试化学参考答案
题号 1 2 3 4 5 6 7 8 9 10
答案 A B A C B D C D D B
题号 11 12 13 14 15
答案 C D A C A
二、非选择题:(未标注的空:2分/空)
16.(14分)(1)提高酸浸步骤中锑的浸出率
(2)Fe、Cu (只写“Cu”给1分)
(3)Sb3++Cl-+H2O=SbOC1↓+2H+ (未写“↓”扣1分) 加快反应速率
(4)KSCN溶液、氯水 (写“铁氰化钾溶液”也可给分)
(5)2NH3·H2O+2SbOCl=Sb2O3+2NH4Cl+H2O 碱性过强会造成Sb2O3的溶解损失
17.(14分)(1)吹出产物及尾气
(2)除去氮气中水蒸气 、氨气 (只写“水蒸气”给1分) 冷水
(3)Cr2O3+3CCl42CrCl3+3COCl2 (未写“Δ”条件不给分)
(4)将连接装置D、E的细导管改成粗导管
(5)① Cr2O72-+ 6I-+14H+= 2Cr3++3I2+7H2O
② 92.5 (结果未保留到小数点后一位或多写“%”均不给分)
18. (13分)(1)① 60% ② > (1分)
(2)① < (1分) ② K= 减小 (1分)
③ CE (选不全给1分,错选无分)
(3)-26.5 (掉“-”无分)
19.(14分)(1)HNO2H++ (写“=”无分)
(2)12
(3)H2S
(4)H2C2O4 + OH-= HC2O4-+ H2O (写化学方程式无分)
(5)2HNO2+H2S=2H2O+2NO↑+S↓ (未写“↑”“↓”扣1分)
(6)DE (选不全给1分,错选无分)
可能用到的相对原子质量:Cl 35.5 O 16 Na 23 S 32 Mn 55 Cu 64 Cr 52
选择题:(本题共15小题,每小题3分,共45分。在每小题给出的四个选项中,只有一项是符合题目要求的)
1.中国古代文物蕴含着瑰丽的中华历史文化,下列文物主要成分属于硅酸盐材料的是( )
A.唐三彩釉陶俑 B.汉《天回医简》竹简 C.商州太阳鸟金饰 D.战国龙凤虎纹丝绸
2.下列事实与盐类水解无关的是( )
A.洗涤油污常用热的纯碱溶液
B.FeCl3溶液腐蚀覆铜板印制电路板
C.配制氯化铁溶液时,先加较浓盐酸溶解氯化铁固体
D.氯化铵溶液中加入镁粉,产生两种气体
3.下列事实不能用平衡移动原理解释的是( )
A.工业合成氨,采用400℃~500℃的高温条件
B.工业制备,加入大量水,同时加热
C.黄色的氯水在光照下颜色变浅
D.25℃~100℃,随温度升高,纯水的减小
4.某实验小组学生用50mL 0.50mol·L-l的盐酸与50mL 0.55mol·L-l的NaOH溶液在如图所示的装置中进行中和反应。通过测定反应过程中所放出的热量计算反应热,下列说法不正确的是( )
A.图中实验装置缺少玻璃搅拌器
B.若分多次加入溶液,测得△H偏高
C.实验中,读取混合溶液不再变化的温度为反应后体系的温度
D.若改用60mL0.50mol·L-l盐酸跟50mL0.55mol·L-l的NaOH溶液进行反应,理论上所求反应热相等
5.已知下列两个反应的热化学方程式,下列说法不正确的是( )
A.1mol液态水与1mol水蒸气所具有的内能不同
B.与反应生成,放出的热量大于285.8KJ
C.常温常压下,等质量的、完全燃烧,放出的热量更多
D.反应的
6.一种高活性有机物中间体分子结构如图。下列有关该物质说法正确的是( )
A.分子式为C10H14O2
B.苯环上的一氯代物有4种
C.含有三种官能团
D.1 mol该有机物与足量金属Na反应可产生H2 22.4 L(标准状况下)
7.常温下,下列各组离子在指定溶液中一定能大量共存的是( )
A.在新制的漂白粉溶液中:、、、
B.的溶液中:、、、
C.由水电离出的的溶液中:、、、
D.的溶液中,、、、
8.下列由实验操作及现象能够得出相应结论的是( )
选项 实验操作及现象 结论
A 密闭容器中发生反应,压缩容器体积,气体颜色变深 增大压强,平衡向逆反应方向移动
B 向等体积浓度均为的溶液中分别滴入溶液和的溶液,的溶液褪色较快 其他条件相同,浓度越大化学速率不一定越快
C 在两组相同的合成氨反应中,其他条件相同,一组加入催化剂,另一组不加催化剂,加入催化剂的一组较快达到平衡状态 催化剂可以增大化学反应速率,降低反应的反应热
D 取溶液,加入几滴溶液,充分反应后,取上层清液滴入KSCN溶液,溶液变成红色 与发生的反应为可逆反应
2
9.在一定体积的密闭容器中给定物质A、B、C的量,在一定条件下发生反应建立的化学平衡:aA(g)+bB(g)xC(g),符合下图所示的关系(C%表示平衡混合气中产物C的百分含量,T表示温度,P表示压强)。在图中Y轴Y轴表示的含义可以是( )
①反应物A的转化率;②平衡混合气中物质B的百分含量;③平衡混合气的密度;
④平衡混合气的平均摩尔质量。
A.①③ B.②③ C.③④ D.①④
10.某食品添加剂的主要成分为WZ(RY4)2 12X2Y。已知X、Y、Z、R、W为原子序数依次增大的前20号主族元素,X、Z的周期序数等于主族序数,Y和R位于同主族,W原子的N层比K层少1个电子。下列说法正确的是( )
A.简单离子半径:W>R>Z>Y
B.Z2Y3既可以与强酸反应,也可以与强碱反应
C.常温下,W单质能与水反应生成能使带火星的木条复燃的气体
D.X2和Y2互为同素异形体
11.醋酸的电离方程式为 时,醋酸的电离常数。下列说法正确的是( )
A.向的醋酸溶液中滴加几滴稀盐酸,醋酸的电离平衡一定逆向移动
B.加水稀释醋酸溶液,增大
C.该温度下,将浓度均为的醋酸与醋酸钠溶液等体积混合,溶液显酸性
D.常温下,溶液加水稀释过程中,变大
12.一定温度下,向2.0L的恒容密闭容器中充入1.6molCO、1.6molNO,发生反应 ,经过一段时间后达平衡。不同时间测得如下表所示。下列说法错误的是( )
0 5 10 15 20
1.6 1.2 0.9 0.8 0.8
A.该温度下,该反应的平衡常数
B.反应在前10s的平均速率为
C.保持其他条件不变,升高温度,达到新平衡时,则反应的
D.相同温度下,起始时向容器中充入,则此时
13.某化学小组探究卤族元素的性质,进行如图所示的实验 (均为浸有相应试液的棉花,夹持装置略)。下列说法正确的是( )
A.具支试管中发生反应的化学方程式为
B.若处变为橙色,处变为蓝色,说明氧化性
C.若c处褪色,说明Cl2有还原性
D.若处褪色,说明具有漂白性
14.下列图示与对应的叙述相符的是( )
A.甲图表示和溶液稀释的变化曲线,由图可知HF属于强酸
B.若乙图表示不同温度下,水溶液中和浓度的变化曲线,则图中点对应温度高于点
C.若丙图表示溶液滴定溶液的滴定曲线,则图中点水的电离程度最大
D.若丁图表示一定温度下向冰醋酸中加水后溶液导电能力的变化曲线,则图中三点的电离程度:
15.25℃时,向15mL 0.1mol·L-1的氢氧化钠溶液中逐滴滴入0.1mol·L-1的CH3COOH溶液,加入CH3COOH溶液的体积与混合溶液pH的关系如图所示(混合过程中忽略溶液体积变化)。下列分析不正确的是( )
A.溶液的导电能力:d>c>a
B.c点对应溶液中, =1
C.a点溶液中:c(Na+)>c(OH-)>c(CH3COO-)>c(H+)
D.a、b、c、d四点对应溶液中均有
c(CH3COO-)+c(CH3COOH)+c(Na+)=0.1mol·L-1
非选择题:(本题共4个小题,共55分)
16.(14分)锑白(Sb2O3,两性氧化物)可用作白色颜料和阻燃剂。一种从含锑工业废渣(主要成分是Sb2O3、Sb2O5,含有CuO、Fe2O3和SiO2等杂质)中制取Sb2O3的工业流程如下图所示。
已知:①“滤液1”的主要阳离子是Sb3+、Sb5+、Fe3+、Cu2+、H+ ;②“滤饼”的成分是SbOCl
回答下列问题:
(1)对含锑废渣进行酸浸时,需多次浸取的目的是 。
(2)“滤渣2”的成分是 。
(3)“稀释水解”主要反应的离子反应方程式为 ;该操作中需要搅拌的原因是 。
(4)“酸洗”后检验沉淀是否洗净的试剂是 。
(5)“转化”时反应的化学方程式为 ;“转化”需控制溶液的pH在7~8,碱性不能过强的原因是 。
17.(14分)无水三氯化铬(CrCl3)为紫色晶体,在工业上主要用作媒染剂和催化剂,某化学小组用Cr2O3和CCl4在加热下制备无水三氯化铬,部分实验装置如图所示。
已知:①CrCl3熔点为83℃,易潮解,易升华,易溶于水但不易水解,高温下易被氧气氧化;②Cr2O3和CCl4在加热下反应的产物为CrCl3和光气(COCl2)。请回答下列问题:
(1)装置A是氮气制备装置,氮气除了排除空气还有的作用是 。
(2)装置B的作用为 ,装置E水槽中盛有 。
(3)装置D中生成CrCl3和光气(COCl2 )的化学方程式为 。
(4)该实验装置有设计不合理的地方,请写出改进方法: 。
(5)产品中CrCl3质量分数的测定:
(i)称取0.3000 g得到的CrCl3样品溶于水并于250mL容量瓶中定容;
(ii)取25.00mL样品溶液于带塞的锥形瓶中,加热至沸腾后加入稍过量的Na2O2,稀释并加热煮沸,再加入过量的H2SO4酸化,将Cr3+氧化为Cr2O72-;再加入过量的KI固体,加塞摇匀,使铬完全以Cr3+形式存在;
(iii)加入指示剂,用0.0250 mol·L-1标准Na2S2O3溶液滴定至终点,平行测定三次,平均消耗标准Na2S2O3溶液21.00mL(已知2Na2S2O3+I2= Na2S4O6+2NaI)。
①加入KI发生反应的离子方程式为 。
②产品中CrCl3质量分数为 %(结果保留到小数点后一位)
18.(13分)(1)①一定温度下,在密闭容器中充入1molN2和3molH2 发生反应:N2(g)+3H2(g)2NH3(g) ΔH<0。若容器容积恒定,达到平衡状态时,气体的总物质的量是原来的,则N2的转化率a1= ;
②若向该容器中再加入3molH2,达到平衡状态时,N2的转化率为 a2,则a2 a1 (填“>”、“<”或“=”)。
(2)对于反应 2NO(g)+O2(g) 2NO2(g)。在其他条件相同时,分别测得NO的平衡转化率在不同压强(P1、P2)下温度变化的曲线(如图)。
①比较 P1、P2 的大小关系:P1 P2(填“>”、“<”或“=”)。
②该反应的平衡常数 K 的表达式为 ,随温度升高,该反应平衡常数变化的趋势是 。(填“增大”、“减小”或“不变”)
③下列措施中能够同时满足增大反应速率和提高NO转化率的是 。(填写相应字母)
使用高效催化剂 B.保持容器体积不变加入惰性气体 C.保持容器体积不变加入O2
D.降低温度 E.压缩容器体积
(3)已知同温同压下,下列反应的焓变和平衡常数分别表示为
①2SO2(g)+O2(g) 2SO3(g) ΔH1=-197 kJ·mol-1 K1=a
②2NO(g)+O2(g) 2NO2(g) ΔH2=-144 kJ·mol-1 K2=b
③NO2(g)+SO2(g) SO3(g)+NO(g) ΔH3=m kJ·mol-1 K3=c
则m的数值为 ,c与a、b之间的关系为c= 。(用含a,b的表达式表示)
19.(14分)部分弱酸的电离平衡常数如表:
弱酸 HCOOH HNO2 H2S H2SO3 H2C2O4
电离平衡常数(25℃) K=1.8×10-4 K=5.1×10-4 K1=9.1×10-8 K2=1×10-12 K1=1.23×10-2 K2=6.6×10-8 K1=5.4×10-2 K2=5.4×10-5
(1)请写出HNO2的电离方程式 。
(2)0.01mol/L的Na2S溶液的pH是 。
(3)上表的5种酸进行比较,酸性最弱的是: ;HCOO-、S2-、 3种离子中,最难结合H+的是 。
(4)在10mL浓度均为0.1mol/L的HCOOH和H2C2O4混合溶液中,逐渐滴入10mL 0.1mol/L的NaOH溶液,写出反应离子方程式: 。
(5)已知HNO2具有强氧化性,弱还原性。将HNO2溶液滴加到H2S溶液中,同时有沉淀和无色气体生成,该气体遇空气立即变为红棕色,试写出两酸之间的化学反应方程式:
。
(6)根据上述信息,下列离子方程式书写正确的是 。
A.HNO2+HS-=+ H2S↑
B.2HCOOH+=2HCOO-+H2O+SO2↑
C.H2SO3+2HCOO-=2HCOOH+
D.H2SO3+=2
E.H2C2O4+=+HNO2
宜昌市部分省级示范高中2024秋季学期高二年级
期中考试化学参考答案
题号 1 2 3 4 5 6 7 8 9 10
答案 A B A C B D C D D B
题号 11 12 13 14 15
答案 C D A C A
二、非选择题:(未标注的空:2分/空)
16.(14分)(1)提高酸浸步骤中锑的浸出率
(2)Fe、Cu (只写“Cu”给1分)
(3)Sb3++Cl-+H2O=SbOC1↓+2H+ (未写“↓”扣1分) 加快反应速率
(4)KSCN溶液、氯水 (写“铁氰化钾溶液”也可给分)
(5)2NH3·H2O+2SbOCl=Sb2O3+2NH4Cl+H2O 碱性过强会造成Sb2O3的溶解损失
17.(14分)(1)吹出产物及尾气
(2)除去氮气中水蒸气 、氨气 (只写“水蒸气”给1分) 冷水
(3)Cr2O3+3CCl42CrCl3+3COCl2 (未写“Δ”条件不给分)
(4)将连接装置D、E的细导管改成粗导管
(5)① Cr2O72-+ 6I-+14H+= 2Cr3++3I2+7H2O
② 92.5 (结果未保留到小数点后一位或多写“%”均不给分)
18. (13分)(1)① 60% ② > (1分)
(2)① < (1分) ② K= 减小 (1分)
③ CE (选不全给1分,错选无分)
(3)-26.5 (掉“-”无分)
19.(14分)(1)HNO2H++ (写“=”无分)
(2)12
(3)H2S
(4)H2C2O4 + OH-= HC2O4-+ H2O (写化学方程式无分)
(5)2HNO2+H2S=2H2O+2NO↑+S↓ (未写“↑”“↓”扣1分)
(6)DE (选不全给1分,错选无分)
同课章节目录
