2025年福建省福州第一中学九年级下学期6月中考模拟化学试卷(含答案)
文档属性
| 名称 | 2025年福建省福州第一中学九年级下学期6月中考模拟化学试卷(含答案) |

|
|
| 格式 | docx | ||
| 文件大小 | 3.7MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 通用版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2025-07-02 00:00:00 | ||
图片预览



文档简介
2025年福建省福州市第一中学中考模拟化学试卷
一、选择题
1.人体缺乏某种元素会导致骨质疏松症,该元素是
A.铁 B.碘 C.钙 D.锌
2.运动型功能饮料含有下列营养素,其中主要用于补充能量的是
A.葡萄糖 B.维生素 C.水 D.无机盐
3.下列化学实验室物品中,由有机合成材料制成的是
A.漏斗 B.橡胶塞 C.铁架台 D.蒸发皿
4.化学是一门以实验为基础的自然学科,下列实验操作中正确的是
A.添加氯化钠固体 B.滴加蒸馏水
C.加热氯化钠溶液 D.熄灭酒精灯
5.下列叙述中错误的是
A.从空气中获取氧气的过程属于化学变化
B.回收利用废旧金属有利于社会的可持续发展
C.煤通过综合利用可以得到焦炭、煤焦油、煤气等化工原料
D.氢气是清洁的高能燃料,燃烧时能量从化学能转化为热能
6.三七素(化学式为C5H7N2O5)是传统中药三七的主要有效成分,需密封避光、低温保存。下列有关三七素的叙述正确的是
A.三七素中碳元素的质量分数最大
B.1个三七素分子中含有5个碳原子、7个氢原子、1个氮分子和5个氧原子
C.三七素在氧气中完全燃烧只生成CO2和H2O
D.三七素见光或受热易分解
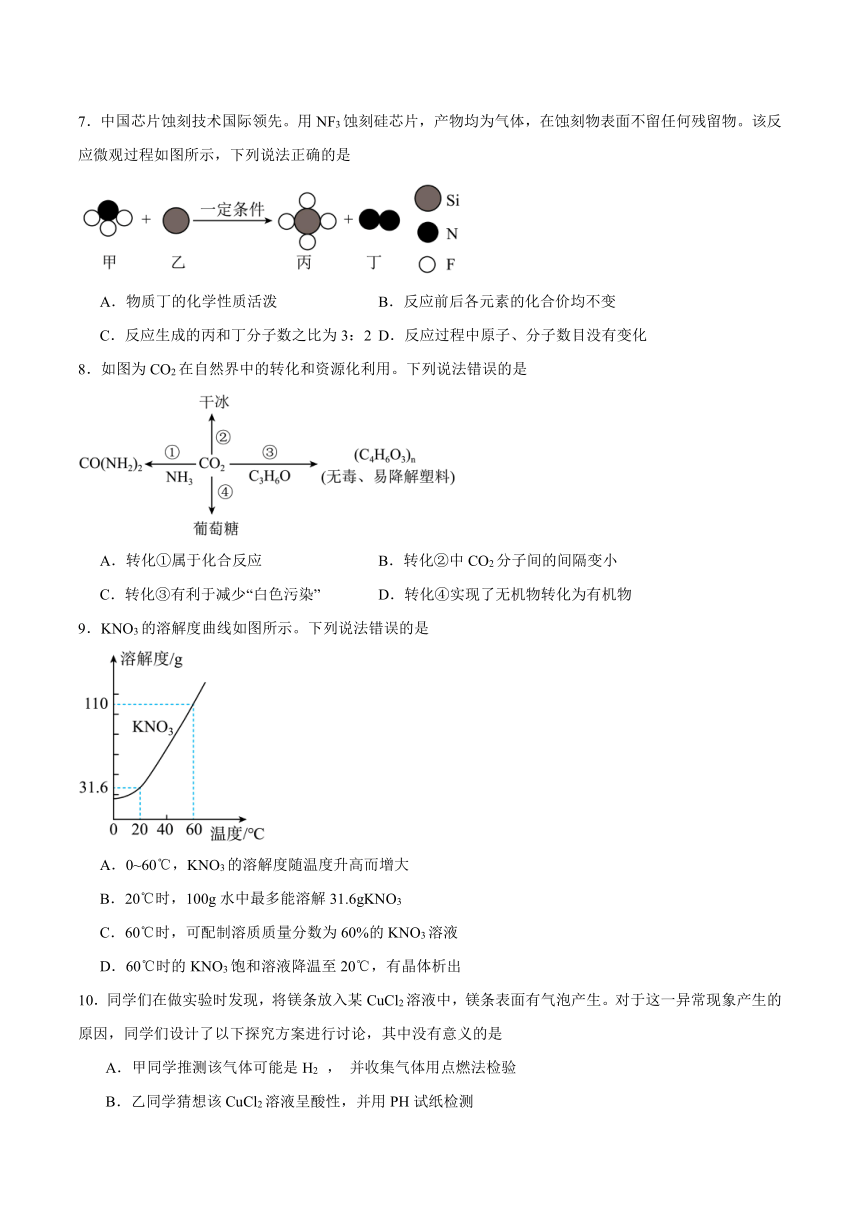
7.中国芯片蚀刻技术国际领先。用NF3蚀刻硅芯片,产物均为气体,在蚀刻物表面不留任何残留物。该反应微观过程如图所示,下列说法正确的是
A.物质丁的化学性质活泼 B.反应前后各元素的化合价均不变
C.反应生成的丙和丁分子数之比为3:2 D.反应过程中原子、分子数目没有变化
8.如图为CO2在自然界中的转化和资源化利用。下列说法错误的是
A.转化①属于化合反应 B.转化②中CO2分子间的间隔变小
C.转化③有利于减少“白色污染” D.转化④实现了无机物转化为有机物
9.KNO3的溶解度曲线如图所示。下列说法错误的是
A.0~60℃,KNO3的溶解度随温度升高而增大
B.20℃时,100g水中最多能溶解31.6gKNO3
C.60℃时,可配制溶质质量分数为60%的KNO3溶液
D.60℃时的KNO3饱和溶液降温至20℃,有晶体析出
10.同学们在做实验时发现,将镁条放入某CuCl2溶液中,镁条表面有气泡产生。对于这一异常现象产生的原因,同学们设计了以下探究方案进行讨论,其中没有意义的是
A.甲同学推测该气体可能是H2 , 并收集气体用点燃法检验
B.乙同学猜想该CuCl2溶液呈酸性,并用PH试纸检测
C.丙同学用锌粒与该CuCl2溶液反应,观察是否有气泡产生
D.丁同学用镁粉与该CuCl2溶液反应,观察产生气泡的快慢
二、填空与简答
11.“笔墨纸砚”被誉为文房四宝,承载着优秀的中国传统文化。
笔:《辞源》中记载:“恬始作笔,以枯木为管,鹿毛为柱,羊毛为被。”
(1)点燃鹿毛和羊毛,均能闻到 (选填“烧纸”或“烧焦羽毛”)的气味。
墨:《天工开物》中记载:“凡墨,烧烟凝质而为之。”
(2)松烟由松木 (选填“完全”或“不完全”)燃烧形成,古人用墨作画,经百年不褪色的原因是 。
纸:如图为一种植物纤维造纸流程。
(3)“蒸煮”时,生石灰变成熟石灰的过程属于 (选填“吸热”或“放热”)反应。将石灰浆[主要成分为Ca(OH)2]与碳酸钠溶液混合,可以更好地达到除去木质素的效果,原因是 (用化学方程式表示)。
(4)透火烘干是将150~300℃空气流穿透湿纸页从而快速脱水。此过程中纸张没有燃烧的原因可能是 。
砚:《释名》中对砚的释义为“砚者研也,可以研墨和之濡也。”
(5)这说明了砚的硬度 (选填“大于”或“小于”)墨条的硬度。
12.人类生产生活都离不开水,回答下列问题。
(1)某同学利用自制简易净水器对污浊的河水进行净化(如图一)。
①由于活性炭具有 性,可除去河水中的异味。
②经过图一处理后得到净水是 (选填“纯净物”或“混合物”),其原因是 。
(2)图二是电解水实验。
①将燃着的木条放在导管b的尖嘴处,打开活塞,观察到的现象为 。
②电解水的实验原理属于 (填基本反应类型),通过实验事实说明:水是由 组成的。
③正极端与负极段产生的气体质量比为 (填最简整数比)。
13.铀是人类发现的第一种放射性元素,其发现具有里程碑意义。
(1)1789年,德国矿物学家克拉普罗特研究沥青矿时意识到一种新元素的存在,并将之正式命名为铀(元素符号为U)。他将铀矿石溶解在王水中,经冷却、 、洗涤、干燥等操作后得到一种黄色固体(化学式为UO2CO3),该物质中铀元素的化合价为 。
(2)1841年,法国化学家佩利戈首次制备出四氯化铀固体,并发现四氯化铀与水的反应生成了二氧化铀和氯化氢气体,写出该化学反应的化学方程式为 。
(3)19世纪中期,科学家开始探索铀单质的制备方法,熔盐电解法的应用使得铀单质成功制备。在烧杯中放入少量金属铀,加入稀盐酸,结合金属活动性顺序,预测可观察到 (填实验现象)。
(4)进入20世纪,人们对原子结构的认识更加深入。科学家相继发现了234U、235U和238U,化学上将这些铀原子统称为铀元素的理由是 。
14.碳酸钠在生活、生产和实验研究中均有广泛应用。
【配制溶液】配制溶质质量分数分别为1%、2%和4%的Na2CO3溶液
(1)若配制50g溶质质量分数为4%的Na2CO3溶液,用托盘天平称量 gNa2CO3固体,用规格为 (选填“10mL”、“50mL”、“100mL”)的量筒量取所需水的体积。然后在 (填仪器名称)里将碳酸钠充分溶解,最后装入相应的试剂瓶中待用。
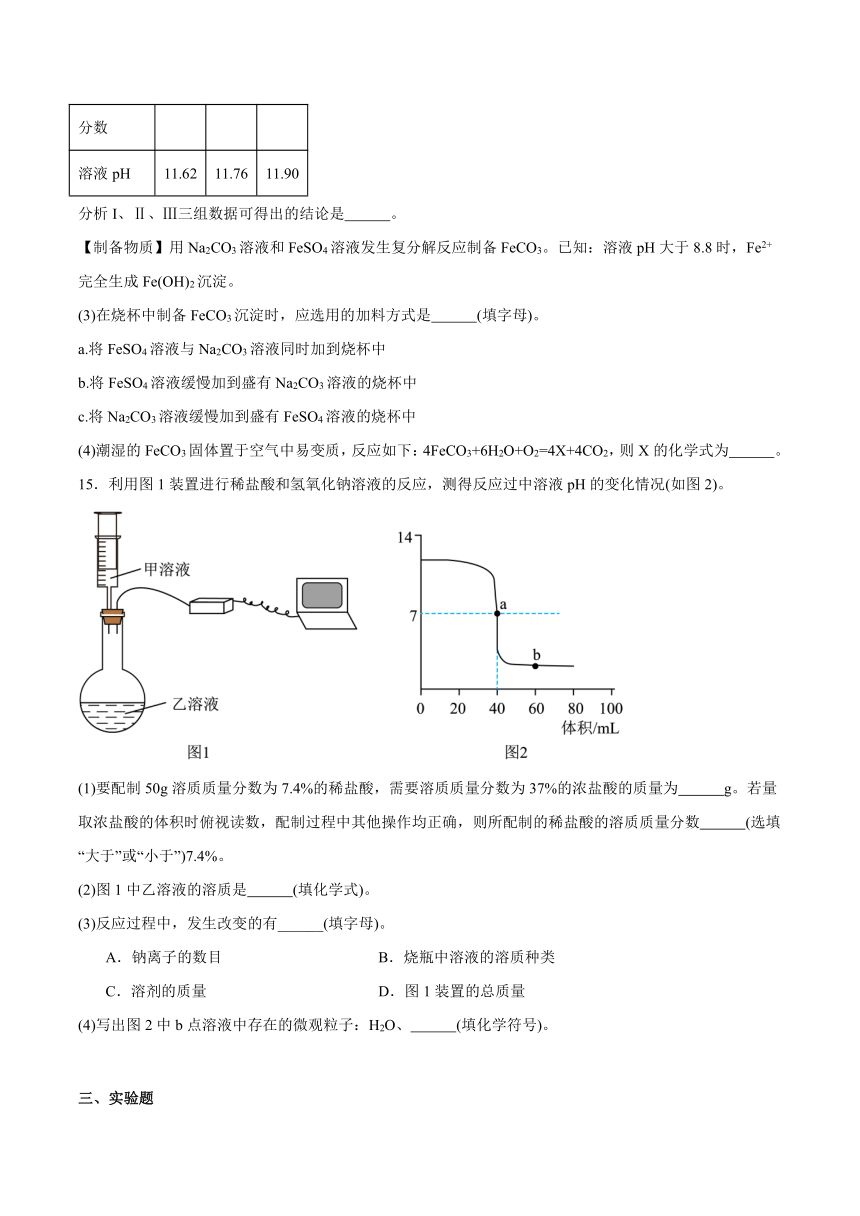
(2)分别测定25℃时,上述3种溶液的pH,记录数据如表:
实验编号 I Ⅱ Ⅲ
溶质质量分数 1% 2% 4%
溶液pH 11.62 11.76 11.90
分析I、Ⅱ、Ⅲ三组数据可得出的结论是 。
【制备物质】用Na2CO3溶液和FeSO4溶液发生复分解反应制备FeCO3。已知:溶液pH大于8.8时,Fe2+完全生成Fe(OH)2沉淀。
(3)在烧杯中制备FeCO3沉淀时,应选用的加料方式是 (填字母)。
a.将FeSO4溶液与Na2CO3溶液同时加到烧杯中
b.将FeSO4溶液缓慢加到盛有Na2CO3溶液的烧杯中
c.将Na2CO3溶液缓慢加到盛有FeSO4溶液的烧杯中
(4)潮湿的FeCO3固体置于空气中易变质,反应如下:4FeCO3+6H2O+O2=4X+4CO2,则X的化学式为 。
15.利用图1装置进行稀盐酸和氢氧化钠溶液的反应,测得反应过中溶液pH的变化情况(如图2)。
(1)要配制50g溶质质量分数为7.4%的稀盐酸,需要溶质质量分数为37%的浓盐酸的质量为 g。若量取浓盐酸的体积时俯视读数,配制过程中其他操作均正确,则所配制的稀盐酸的溶质质量分数 (选填“大于”或“小于”)7.4%。
(2)图1中乙溶液的溶质是 (填化学式)。
(3)反应过程中,发生改变的有______(填字母)。
A.钠离子的数目 B.烧瓶中溶液的溶质种类
C.溶剂的质量 D.图1装置的总质量
(4)写出图2中b点溶液中存在的微观粒子:H2O、 (填化学符号)。
三、实验题
16.实验室常用如图一装置制取气体,根据所学知识回答下列问题:
(1)用高锰酸钾制取氧气,应选用的发生装置是 (填装置标号,下同),使用该装置时应做的改进为 ,写出该反应的化学方程式 。欲收集一瓶氧气做铁丝在氧气中燃烧的实验,应选用收集装置 。
(2)实验室常用 和 (填试剂名称)在常温下反应来制取二氧化碳,并利用一朵干燥的石蕊纸花和适量水证明二氧化碳能和水反应,如图二所示,进行如图实验:
①将干燥纸花喷水 ②干燥纸花放入瓶中 ③喷过水的纸花放入瓶中
则实验的合适步骤排序为 。(填序号)
(3)实验室常用锌粒和稀硫酸制备氢气,若要收集干燥的氢气,应选择图一中的发生及收集装置组合是 (填装置标号)。
若要测定产生氢气的体积,可将发生装置与 (选填以下装置标号)连接。
四、科学探究题
17.某化学兴趣小组对木炭还原氧化铜的气体产物成分进行实验探究。
(1)按图1装置完成木炭还原氧化铜实验,观察到现象: ,初步得出“木炭还原氧化铜生成Cu和CO2”的结论。
(2)有同学提出不同看法,他认为生成的气体产物不一定只有CO2,也可能含有CO。为了验证这种看法,按图2与图3装置进行实验。
在图2与图3实验中,能说明生成的气体产物含有CO的现象是 。
(3)从环保角度对图1装置提出改进建议: 。
(4)为了进一步探究木炭还原氧化铜的反应原理,采用数字化传感器改进实验(装置如图4所示),对不同质量比的CuO与C反应产生的气体进行数据采集(1ppm=0.0001%)。
①实验前必须检查图4装置气密性,操作方法: 。
②加热前向三颈烧瓶和硬质短试管通入足量的氮气,目的是 。
③分析图5,CO2浓度下降的原因可能是 (用化学方程式表示);
④分析图6,可得出反应物的质量比与产生的CO含量的关系是 。
五、计算题
18.乙炔(C2H2)是有机合成的重要原料。某工厂采用电石(主要成分为CaC2)为原料制取乙炔,反应原理为CaC2+2H2O=Ca(OH)2+C2H2↑。若该厂日产130kgC2H2,则每天至少需要消耗含80%CaC2的电石的质量是多少?(写出计算过程)
参考答案
1.C
2.A
3.B
4.D
5.A
6.D
7.C
8.A
9.C
10.D
11.(1)烧焦羽毛
(2) 不完全 常温下碳的化学性质稳定
(3) 放热 Na2CO3+Ca(OH)2=CaCO3↓+2NaOH
(4)温度没有达到着火点
(5)大于
12.(1) 吸附 混合物 水中还含有可溶性杂质
(2) 木条燃烧更旺 分解反应 氢元素和氧元素 8:1
13.(1) 过滤 +6
(2)
(3)有大量气泡产生
(4)这些铀原子具有相同的质子数(或核电荷数)
14.(1) 2 50mL 烧杯
(2)25℃时,碳酸钠溶液中溶质的质量分数越大,碱性越强
(3)c
(4)Fe(OH)3
15.(1) 10 小于
(2)NaOH
(3)BC
(4)Na+、Cl-、H+
16.(1) A 试管口放一团棉花 E
(2) 大理石(或石灰石) 稀盐酸 ②①③
(3) BC C
17.(1)A中固体物质由黑色变为红色,B中澄清石灰水变浑浊
(2)B1处固体没有变化,B2处固体由黑色变为红色
(3)收集尾气,对CO尾气进行燃烧处理
(4) 稍加热装置,气球迅速膨胀,停止加热后气球又恢复原状,则说明装置气密性良好 排净装置内空气,防止碳与氧气反应,干扰实验分析 在一定条件下,氧化铜与木炭质量比越高,产生的一氧化碳气体越少
18.设参加反应的CaC2的质量为x,
x=320kg,
每天至少需要消耗含80%CaC2的电石的质量是:320kg÷80%=400kg;
答:每天至少需要消耗电石的质量是400kg。
一、选择题
1.人体缺乏某种元素会导致骨质疏松症,该元素是
A.铁 B.碘 C.钙 D.锌
2.运动型功能饮料含有下列营养素,其中主要用于补充能量的是
A.葡萄糖 B.维生素 C.水 D.无机盐
3.下列化学实验室物品中,由有机合成材料制成的是
A.漏斗 B.橡胶塞 C.铁架台 D.蒸发皿
4.化学是一门以实验为基础的自然学科,下列实验操作中正确的是
A.添加氯化钠固体 B.滴加蒸馏水
C.加热氯化钠溶液 D.熄灭酒精灯
5.下列叙述中错误的是
A.从空气中获取氧气的过程属于化学变化
B.回收利用废旧金属有利于社会的可持续发展
C.煤通过综合利用可以得到焦炭、煤焦油、煤气等化工原料
D.氢气是清洁的高能燃料,燃烧时能量从化学能转化为热能
6.三七素(化学式为C5H7N2O5)是传统中药三七的主要有效成分,需密封避光、低温保存。下列有关三七素的叙述正确的是
A.三七素中碳元素的质量分数最大
B.1个三七素分子中含有5个碳原子、7个氢原子、1个氮分子和5个氧原子
C.三七素在氧气中完全燃烧只生成CO2和H2O
D.三七素见光或受热易分解
7.中国芯片蚀刻技术国际领先。用NF3蚀刻硅芯片,产物均为气体,在蚀刻物表面不留任何残留物。该反应微观过程如图所示,下列说法正确的是
A.物质丁的化学性质活泼 B.反应前后各元素的化合价均不变
C.反应生成的丙和丁分子数之比为3:2 D.反应过程中原子、分子数目没有变化
8.如图为CO2在自然界中的转化和资源化利用。下列说法错误的是
A.转化①属于化合反应 B.转化②中CO2分子间的间隔变小
C.转化③有利于减少“白色污染” D.转化④实现了无机物转化为有机物
9.KNO3的溶解度曲线如图所示。下列说法错误的是
A.0~60℃,KNO3的溶解度随温度升高而增大
B.20℃时,100g水中最多能溶解31.6gKNO3
C.60℃时,可配制溶质质量分数为60%的KNO3溶液
D.60℃时的KNO3饱和溶液降温至20℃,有晶体析出
10.同学们在做实验时发现,将镁条放入某CuCl2溶液中,镁条表面有气泡产生。对于这一异常现象产生的原因,同学们设计了以下探究方案进行讨论,其中没有意义的是
A.甲同学推测该气体可能是H2 , 并收集气体用点燃法检验
B.乙同学猜想该CuCl2溶液呈酸性,并用PH试纸检测
C.丙同学用锌粒与该CuCl2溶液反应,观察是否有气泡产生
D.丁同学用镁粉与该CuCl2溶液反应,观察产生气泡的快慢
二、填空与简答
11.“笔墨纸砚”被誉为文房四宝,承载着优秀的中国传统文化。
笔:《辞源》中记载:“恬始作笔,以枯木为管,鹿毛为柱,羊毛为被。”
(1)点燃鹿毛和羊毛,均能闻到 (选填“烧纸”或“烧焦羽毛”)的气味。
墨:《天工开物》中记载:“凡墨,烧烟凝质而为之。”
(2)松烟由松木 (选填“完全”或“不完全”)燃烧形成,古人用墨作画,经百年不褪色的原因是 。
纸:如图为一种植物纤维造纸流程。
(3)“蒸煮”时,生石灰变成熟石灰的过程属于 (选填“吸热”或“放热”)反应。将石灰浆[主要成分为Ca(OH)2]与碳酸钠溶液混合,可以更好地达到除去木质素的效果,原因是 (用化学方程式表示)。
(4)透火烘干是将150~300℃空气流穿透湿纸页从而快速脱水。此过程中纸张没有燃烧的原因可能是 。
砚:《释名》中对砚的释义为“砚者研也,可以研墨和之濡也。”
(5)这说明了砚的硬度 (选填“大于”或“小于”)墨条的硬度。
12.人类生产生活都离不开水,回答下列问题。
(1)某同学利用自制简易净水器对污浊的河水进行净化(如图一)。
①由于活性炭具有 性,可除去河水中的异味。
②经过图一处理后得到净水是 (选填“纯净物”或“混合物”),其原因是 。
(2)图二是电解水实验。
①将燃着的木条放在导管b的尖嘴处,打开活塞,观察到的现象为 。
②电解水的实验原理属于 (填基本反应类型),通过实验事实说明:水是由 组成的。
③正极端与负极段产生的气体质量比为 (填最简整数比)。
13.铀是人类发现的第一种放射性元素,其发现具有里程碑意义。
(1)1789年,德国矿物学家克拉普罗特研究沥青矿时意识到一种新元素的存在,并将之正式命名为铀(元素符号为U)。他将铀矿石溶解在王水中,经冷却、 、洗涤、干燥等操作后得到一种黄色固体(化学式为UO2CO3),该物质中铀元素的化合价为 。
(2)1841年,法国化学家佩利戈首次制备出四氯化铀固体,并发现四氯化铀与水的反应生成了二氧化铀和氯化氢气体,写出该化学反应的化学方程式为 。
(3)19世纪中期,科学家开始探索铀单质的制备方法,熔盐电解法的应用使得铀单质成功制备。在烧杯中放入少量金属铀,加入稀盐酸,结合金属活动性顺序,预测可观察到 (填实验现象)。
(4)进入20世纪,人们对原子结构的认识更加深入。科学家相继发现了234U、235U和238U,化学上将这些铀原子统称为铀元素的理由是 。
14.碳酸钠在生活、生产和实验研究中均有广泛应用。
【配制溶液】配制溶质质量分数分别为1%、2%和4%的Na2CO3溶液
(1)若配制50g溶质质量分数为4%的Na2CO3溶液,用托盘天平称量 gNa2CO3固体,用规格为 (选填“10mL”、“50mL”、“100mL”)的量筒量取所需水的体积。然后在 (填仪器名称)里将碳酸钠充分溶解,最后装入相应的试剂瓶中待用。
(2)分别测定25℃时,上述3种溶液的pH,记录数据如表:
实验编号 I Ⅱ Ⅲ
溶质质量分数 1% 2% 4%
溶液pH 11.62 11.76 11.90
分析I、Ⅱ、Ⅲ三组数据可得出的结论是 。
【制备物质】用Na2CO3溶液和FeSO4溶液发生复分解反应制备FeCO3。已知:溶液pH大于8.8时,Fe2+完全生成Fe(OH)2沉淀。
(3)在烧杯中制备FeCO3沉淀时,应选用的加料方式是 (填字母)。
a.将FeSO4溶液与Na2CO3溶液同时加到烧杯中
b.将FeSO4溶液缓慢加到盛有Na2CO3溶液的烧杯中
c.将Na2CO3溶液缓慢加到盛有FeSO4溶液的烧杯中
(4)潮湿的FeCO3固体置于空气中易变质,反应如下:4FeCO3+6H2O+O2=4X+4CO2,则X的化学式为 。
15.利用图1装置进行稀盐酸和氢氧化钠溶液的反应,测得反应过中溶液pH的变化情况(如图2)。
(1)要配制50g溶质质量分数为7.4%的稀盐酸,需要溶质质量分数为37%的浓盐酸的质量为 g。若量取浓盐酸的体积时俯视读数,配制过程中其他操作均正确,则所配制的稀盐酸的溶质质量分数 (选填“大于”或“小于”)7.4%。
(2)图1中乙溶液的溶质是 (填化学式)。
(3)反应过程中,发生改变的有______(填字母)。
A.钠离子的数目 B.烧瓶中溶液的溶质种类
C.溶剂的质量 D.图1装置的总质量
(4)写出图2中b点溶液中存在的微观粒子:H2O、 (填化学符号)。
三、实验题
16.实验室常用如图一装置制取气体,根据所学知识回答下列问题:
(1)用高锰酸钾制取氧气,应选用的发生装置是 (填装置标号,下同),使用该装置时应做的改进为 ,写出该反应的化学方程式 。欲收集一瓶氧气做铁丝在氧气中燃烧的实验,应选用收集装置 。
(2)实验室常用 和 (填试剂名称)在常温下反应来制取二氧化碳,并利用一朵干燥的石蕊纸花和适量水证明二氧化碳能和水反应,如图二所示,进行如图实验:
①将干燥纸花喷水 ②干燥纸花放入瓶中 ③喷过水的纸花放入瓶中
则实验的合适步骤排序为 。(填序号)
(3)实验室常用锌粒和稀硫酸制备氢气,若要收集干燥的氢气,应选择图一中的发生及收集装置组合是 (填装置标号)。
若要测定产生氢气的体积,可将发生装置与 (选填以下装置标号)连接。
四、科学探究题
17.某化学兴趣小组对木炭还原氧化铜的气体产物成分进行实验探究。
(1)按图1装置完成木炭还原氧化铜实验,观察到现象: ,初步得出“木炭还原氧化铜生成Cu和CO2”的结论。
(2)有同学提出不同看法,他认为生成的气体产物不一定只有CO2,也可能含有CO。为了验证这种看法,按图2与图3装置进行实验。
在图2与图3实验中,能说明生成的气体产物含有CO的现象是 。
(3)从环保角度对图1装置提出改进建议: 。
(4)为了进一步探究木炭还原氧化铜的反应原理,采用数字化传感器改进实验(装置如图4所示),对不同质量比的CuO与C反应产生的气体进行数据采集(1ppm=0.0001%)。
①实验前必须检查图4装置气密性,操作方法: 。
②加热前向三颈烧瓶和硬质短试管通入足量的氮气,目的是 。
③分析图5,CO2浓度下降的原因可能是 (用化学方程式表示);
④分析图6,可得出反应物的质量比与产生的CO含量的关系是 。
五、计算题
18.乙炔(C2H2)是有机合成的重要原料。某工厂采用电石(主要成分为CaC2)为原料制取乙炔,反应原理为CaC2+2H2O=Ca(OH)2+C2H2↑。若该厂日产130kgC2H2,则每天至少需要消耗含80%CaC2的电石的质量是多少?(写出计算过程)
参考答案
1.C
2.A
3.B
4.D
5.A
6.D
7.C
8.A
9.C
10.D
11.(1)烧焦羽毛
(2) 不完全 常温下碳的化学性质稳定
(3) 放热 Na2CO3+Ca(OH)2=CaCO3↓+2NaOH
(4)温度没有达到着火点
(5)大于
12.(1) 吸附 混合物 水中还含有可溶性杂质
(2) 木条燃烧更旺 分解反应 氢元素和氧元素 8:1
13.(1) 过滤 +6
(2)
(3)有大量气泡产生
(4)这些铀原子具有相同的质子数(或核电荷数)
14.(1) 2 50mL 烧杯
(2)25℃时,碳酸钠溶液中溶质的质量分数越大,碱性越强
(3)c
(4)Fe(OH)3
15.(1) 10 小于
(2)NaOH
(3)BC
(4)Na+、Cl-、H+
16.(1) A 试管口放一团棉花 E
(2) 大理石(或石灰石) 稀盐酸 ②①③
(3) BC C
17.(1)A中固体物质由黑色变为红色,B中澄清石灰水变浑浊
(2)B1处固体没有变化,B2处固体由黑色变为红色
(3)收集尾气,对CO尾气进行燃烧处理
(4) 稍加热装置,气球迅速膨胀,停止加热后气球又恢复原状,则说明装置气密性良好 排净装置内空气,防止碳与氧气反应,干扰实验分析 在一定条件下,氧化铜与木炭质量比越高,产生的一氧化碳气体越少
18.设参加反应的CaC2的质量为x,
x=320kg,
每天至少需要消耗含80%CaC2的电石的质量是:320kg÷80%=400kg;
答:每天至少需要消耗电石的质量是400kg。
同课章节目录
