1.1.1化学反应的反应热——高一化学鲁科版(2019)选择性必修一同步课时作业(含解析)
文档属性
| 名称 | 1.1.1化学反应的反应热——高一化学鲁科版(2019)选择性必修一同步课时作业(含解析) |  | |
| 格式 | docx | ||
| 文件大小 | 232.2KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 鲁科版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2025-07-03 09:08:54 | ||
图片预览

文档简介
1.1.1化学反应的反应热——高一化学鲁科版(2019)选择性必修一同步课时作业
1.下列反应过程中的能量变化符合图所示的是( )
A.甲烷在氧气中燃烧 B.氢氧化钠与盐酸反应
C.盐酸与碳酸氢钠反应 D.二氧化硫与氧气加热时反应
2.下列关于化学反应中的能量变化说法正确的是( )
A.需要加热才能发生的反应一定是吸热反应
B.化学反应不一定伴随能量变化
C.金刚石转化为石墨是放热反应,说明金刚石比石墨稳定
D.燃烧反应、酸碱中和反应是常见的放热反应
3.冷敷袋常用于保鲜、镇痛等,其中不可能盛装的物质是( )
A.冰 B.铁、碳、氯化钠
C.硝酸铵和水 D.硝酸铵和十水合碳酸钠
4.为了测定酸碱反应的反应热,计算时至少需要的数据是( )
①酸的浓度和体积
②碱的浓度和体积
③比热容
④量热器的质量
⑤反应前后溶液温度变化
⑥操作所需的时间
A.①②③⑤ B.①③④⑥ C.③④⑤⑥ D.全部
5.已知,下列反应的是( )
A.稀与足量溶液反应
B.稀盐酸与氨水反应生成
C.稀盐酸与稀溶液反应生成
D.稀溶液与浓硫酸生成
6.在测定中和反应的反应热的实验中,下列说法正确的是(已知弱酸电离时吸热)( )
A.使用搅拌器是为了加快反应速率,减小实验误差
B.为了准确测定反应混合溶液的温度,实验中温度计水银球应与内筒底部接触
C.用溶液分别与的盐酸、醋酸溶液反应,若所取的溶液体积相等,则测得的中和反应的反应热数值相同
D.在测定中和反应的反应热的实验中,将NaOH溶液缓慢加入装有盐酸的内筒中
7.下列反应中,反应产物的总焓大于反应物总焓的是( )
A.氢气在氧气中燃烧 B.铁丝在氧气中燃烧
C.硫在氧气中燃烧 D.焦炭在高温条件下与水蒸气反应
8.用一定浓度的NaOH溶液与稀盐酸进行中和反应反应热的测定实验时,测得生成1 mol液态水时的,产生这种偏差的原因不可能是( )
A.实验用NaOH溶液的浓度过大
B.实验时搅拌速度慢
C.分2~3次把NaOH溶液倒入盛有稀盐酸的小烧杯中
D.用量取完稀盐酸的量筒直接量取氢氧化钠溶液
9.下列实验现象或图像信息不能充分说明相应的化学反应是放热反应的是( )
A B C D
反应装置或图像
实验现象或图像信息 温度计的水银柱上升 反应物总能量大于生成物总能量 反应开始后,甲处液面低于乙处液面 反应开始后,针筒活塞向右移动
A.A B.B C.C D.D
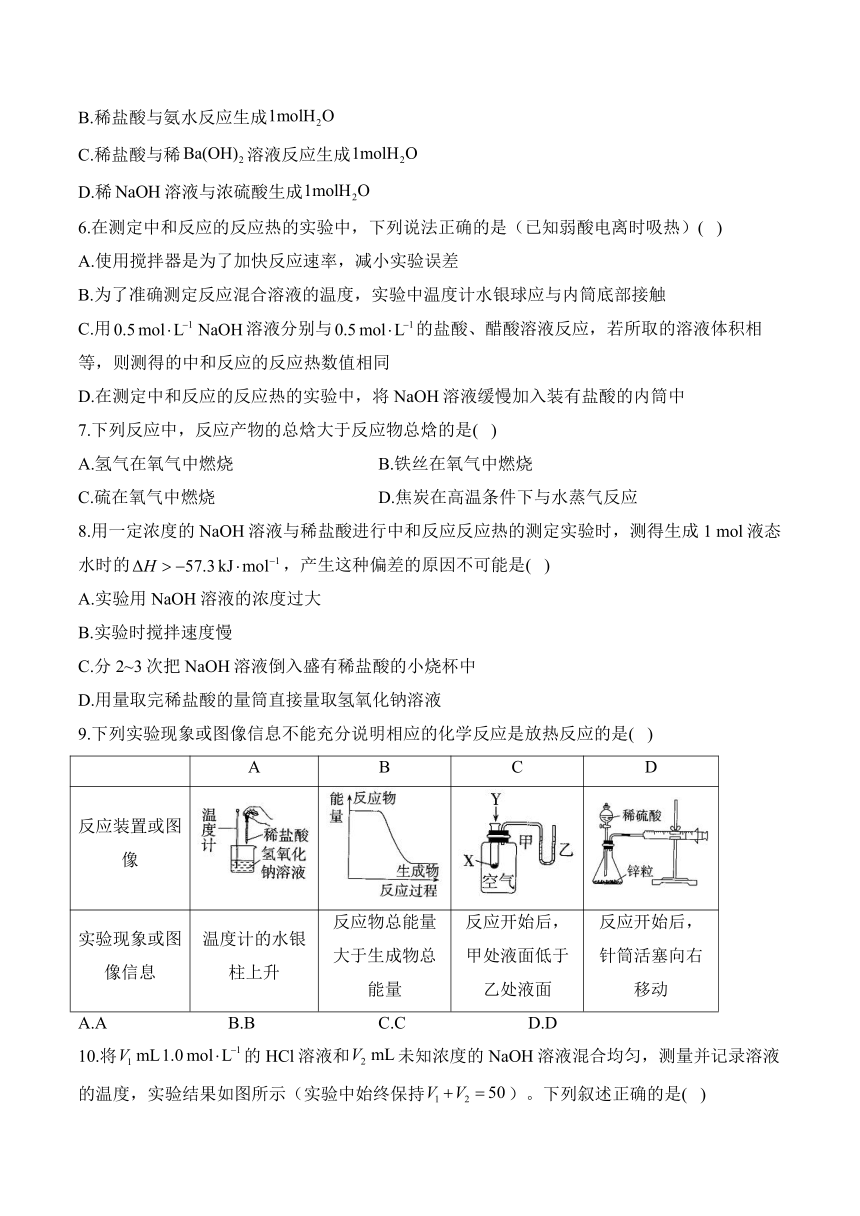
10.将的HCl溶液和未知浓度的NaOH溶液混合均匀,测量并记录溶液的温度,实验结果如图所示(实验中始终保持)。下列叙述正确的是( )
A.实验时溶液初始温度为22 ℃
B.该实验表明化学能可以转化为热能
C.NaOH溶液的浓度为
D.该实验表明有水生成的反应都是放热反应
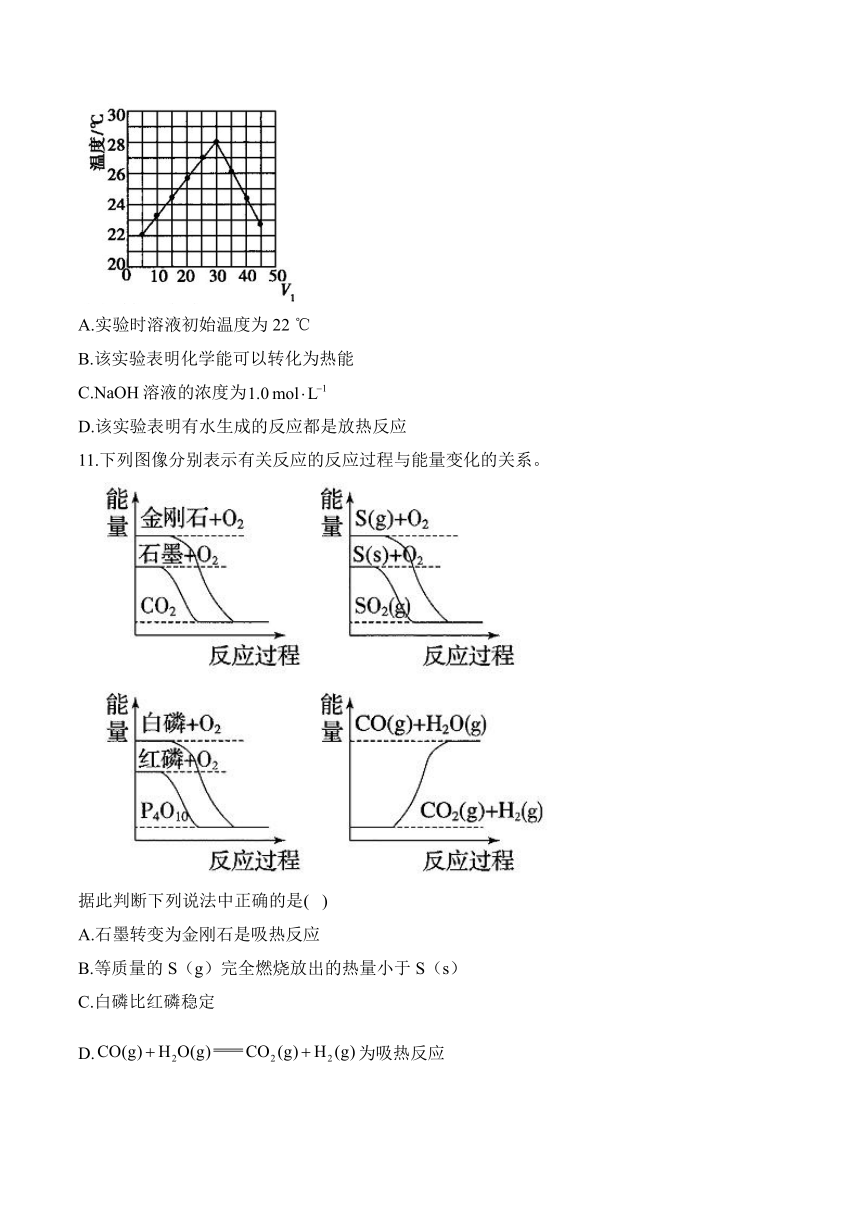
11.下列图像分别表示有关反应的反应过程与能量变化的关系。
据此判断下列说法中正确的是( )
A.石墨转变为金刚石是吸热反应
B.等质量的S(g)完全燃烧放出的热量小于S(s)
C.白磷比红磷稳定
D.为吸热反应
12.盐酸与溶液在如图所示的装置中进行中和反应。通过测定反应过程中所放出的热量可计算中和热。回答下列问题:
(1)从实验装置上看,图中尚缺少的一种玻璃仪器是_______________,烧杯间填满碎泡沫塑料的作用是_______________。
(2)向盐酸中倒入溶液的正确操作是_______________。
A.沿玻璃棒缓慢倒入 B.分三次少量倒入 C.一次迅速倒入
(3)大烧杯上如果不盖硬纸板,则求得的中和热_______________(填“偏大”“偏小”或“无影响”)。
(4)两次实验记录的数据如下表:
实验用品 溶液温度 中和热
① 溶液 溶液 20 ℃ 23.3 ℃
② 溶液 溶液 20 ℃ 23.4 ℃
已知:,反应后溶液的比热容c为,各溶液的密度均为。则中和热____________。
(5)若改用盐酸和溶液进行反应,与上述实验相比,所放出的热量___________(填“相等”或“不相等”),若实验操作均正确,则所求中和热___________(填“相等”或“不相等”)。
答案以及解析
1.答案:C
解析:A.甲烷在氧气中燃烧反应是放热反应,A不符合题意;
B.氢氧化钠与盐酸反应发生时会放出热量,该反应为放热反应,B不符合题意;
C.盐酸与碳酸氢钠反应发生时要吸收热量,因此该反应为吸热反应,C符合题意;
D.二氧化硫与氧气加热时反应转化为三氧化硫,该反应为放热反应,D不符合题意;故合理选项是C。
2.答案:D
解析:需要加热才能发生的反应不一定是吸热反应,如铁和硫反应需要加热,但为放热反应,A错误;化学反应一定伴随能量变化,B错误;能量越高越不稳定,C错误;燃烧反应和酸碱中和反应是常见的放热反应,D正确。
3.答案:B
解析:冷敷袋是利用物质溶解时吸热来达到降低温度的目的。A项,冰融化时吸热,可以用于冷敷袋;B项,铁、碳、氯化钠溶于水时,溶液温度基本不变,不能用于冷敷袋;C项,硝酸铵溶于水时吸热,可以用于冷敷袋;D项,硝酸铵溶于水时吸热,十水合碳酸钠溶于水时放热,二者混合后,溶液温度基本不变,不能用于冷敷袋。
4.答案:A
解析:根据分析可知,酸碱反应的中和热计算时,至少需要的数据有:比热容c,酸的浓度和体积、碱的浓度和体积,反应前后温度变化△T,然后计算出反应后溶液的质量、生成水的物质的量,故选A。
5.答案:C
解析:A.稀与足量的溶液反应生成和,生成沉淀放热,故放出的热量大于57.3kJ,,A不符合题意;
B.一水合氨是弱碱,存在电离平衡,电离吸热,则稀盐酸与氨水反应生成时放出热量小于57.3kJ,ΔH> 57.3kJ/mol,B不符合题意;
C.稀盐酸与稀溶液反应生成时放出热量为57.3kJ,,C符合题意;
D.浓硫酸溶于水放热,则稀NaOH与浓硫酸反应生成时放出热量大于57.3kJ,,D不符合题意;故答案选C。
6.答案:A
解析:温度计水银球应浸入溶液中但不能与内筒底部接触,B项错误;盐酸是强酸,醋酸是弱酸,醋酸电离吸热,C项错误;NaOH溶液应迅速加入装有盐酸的内筒中,D项错误。
7.答案:D
解析:化学反应中,反应产物的总焓大于反应物的总焓,即,反应吸热。由于燃烧反应都是放热反应,因此答案选D。
8.答案:A
解析:NaOH溶液浓度过大,稀释过程释放热量,导致测得生成1 mol液态水时的,A符合题意;实验时搅拌速度慢,导致热量散失较多,测得生成1 mol液态水时的,B不符合题意;分2~3次把NaOH溶液倒入盛有稀盐酸的小烧杯中,导致热量散失较多,测得生成1 mol液态水时的,C不符合题意;用量取完稀盐酸的量筒直接量取氢氧化钠溶液,氢氧化钠部分被反应,导致测得生成1 mol液态水时的,D不符合题意。
9.答案:D
解析:温度计的水银柱上升,说明稀盐酸与NaOH溶液反应放热使温度升高,故A不符合题意;该反应中反应物的总能量大于生成物的总能量,为放热反应,故B不符合题意;反应开始后,甲处液面低于乙处液面,说明试管中的反应放热使集气瓶中的空气膨胀,故C不符合题意;反应开始后,锌粒与稀硫酸反应生成的氢气也会使针筒活塞向右移动,不能说明反应放热,故D符合题意。
10.答案:B
解析:由图可知,加入5 mL盐酸时混合液的温度为22 ℃,故实验时溶液初始温度应低于22 ℃,A项错误;该反应为放热反应,化学能转化为热能,B项正确;二者恰好完全反应时,反应放出的热量最多,此时,则NaOH溶液的浓度为,C项错误;有水生成的反应不一定是放热反应,如是吸热反应,D项错误。
11.答案:A
解析:A.图中,石墨的能量比金刚石低,所以石墨转变为金刚石是吸热反应,A正确;B.图中,S(g)的能量比S(s)的能量高,所以等质量的S(g)完全燃烧放出的热量大于S(s),B错误;C.图中,白磷的能量高于红磷的能量,所以白磷的稳定性差,C错误;D.图中,的反应物的总能量高于生成物的总能量,为放热反应,D错误。
12.答案:(1)环形玻璃搅拌棒;保温、隔热,减少实验过程中的热量损失
(2)C
(3)偏大
(4)
(5)不相等;相等
解析:(1)测定中和热,要使酸、碱快速混合,同时减少混合时的热量损失。
(2)中和热测定的关键是减少反应过程的热量损失,向盐酸中倒入溶液的正确操作是:一次迅速倒入,故合理选项是C。
(3)大烧杯上如果不盖硬纸板,则会导致部分热量损失,产生等量的水,溶液温度升高的少,使测得放出的热量减少,求得的中和热偏大。
(4),,则反应过程中放出的热量,反应产生水的物质的量是,则中和热。
(5)若改用盐酸和溶液进行反应,反应时酸过量,以不足量的溶液为标准计算,的物质的量比第一次反应的的物质的量多,则反应产生的水的物质的量就多,所放出的热量就比上次多;由于中和热是酸、碱发生中和反应产生1 mol水时放出的热量,因此若实验操作均正确,则所求中和热相等。
1.下列反应过程中的能量变化符合图所示的是( )
A.甲烷在氧气中燃烧 B.氢氧化钠与盐酸反应
C.盐酸与碳酸氢钠反应 D.二氧化硫与氧气加热时反应
2.下列关于化学反应中的能量变化说法正确的是( )
A.需要加热才能发生的反应一定是吸热反应
B.化学反应不一定伴随能量变化
C.金刚石转化为石墨是放热反应,说明金刚石比石墨稳定
D.燃烧反应、酸碱中和反应是常见的放热反应
3.冷敷袋常用于保鲜、镇痛等,其中不可能盛装的物质是( )
A.冰 B.铁、碳、氯化钠
C.硝酸铵和水 D.硝酸铵和十水合碳酸钠
4.为了测定酸碱反应的反应热,计算时至少需要的数据是( )
①酸的浓度和体积
②碱的浓度和体积
③比热容
④量热器的质量
⑤反应前后溶液温度变化
⑥操作所需的时间
A.①②③⑤ B.①③④⑥ C.③④⑤⑥ D.全部
5.已知,下列反应的是( )
A.稀与足量溶液反应
B.稀盐酸与氨水反应生成
C.稀盐酸与稀溶液反应生成
D.稀溶液与浓硫酸生成
6.在测定中和反应的反应热的实验中,下列说法正确的是(已知弱酸电离时吸热)( )
A.使用搅拌器是为了加快反应速率,减小实验误差
B.为了准确测定反应混合溶液的温度,实验中温度计水银球应与内筒底部接触
C.用溶液分别与的盐酸、醋酸溶液反应,若所取的溶液体积相等,则测得的中和反应的反应热数值相同
D.在测定中和反应的反应热的实验中,将NaOH溶液缓慢加入装有盐酸的内筒中
7.下列反应中,反应产物的总焓大于反应物总焓的是( )
A.氢气在氧气中燃烧 B.铁丝在氧气中燃烧
C.硫在氧气中燃烧 D.焦炭在高温条件下与水蒸气反应
8.用一定浓度的NaOH溶液与稀盐酸进行中和反应反应热的测定实验时,测得生成1 mol液态水时的,产生这种偏差的原因不可能是( )
A.实验用NaOH溶液的浓度过大
B.实验时搅拌速度慢
C.分2~3次把NaOH溶液倒入盛有稀盐酸的小烧杯中
D.用量取完稀盐酸的量筒直接量取氢氧化钠溶液
9.下列实验现象或图像信息不能充分说明相应的化学反应是放热反应的是( )
A B C D
反应装置或图像
实验现象或图像信息 温度计的水银柱上升 反应物总能量大于生成物总能量 反应开始后,甲处液面低于乙处液面 反应开始后,针筒活塞向右移动
A.A B.B C.C D.D
10.将的HCl溶液和未知浓度的NaOH溶液混合均匀,测量并记录溶液的温度,实验结果如图所示(实验中始终保持)。下列叙述正确的是( )
A.实验时溶液初始温度为22 ℃
B.该实验表明化学能可以转化为热能
C.NaOH溶液的浓度为
D.该实验表明有水生成的反应都是放热反应
11.下列图像分别表示有关反应的反应过程与能量变化的关系。
据此判断下列说法中正确的是( )
A.石墨转变为金刚石是吸热反应
B.等质量的S(g)完全燃烧放出的热量小于S(s)
C.白磷比红磷稳定
D.为吸热反应
12.盐酸与溶液在如图所示的装置中进行中和反应。通过测定反应过程中所放出的热量可计算中和热。回答下列问题:
(1)从实验装置上看,图中尚缺少的一种玻璃仪器是_______________,烧杯间填满碎泡沫塑料的作用是_______________。
(2)向盐酸中倒入溶液的正确操作是_______________。
A.沿玻璃棒缓慢倒入 B.分三次少量倒入 C.一次迅速倒入
(3)大烧杯上如果不盖硬纸板,则求得的中和热_______________(填“偏大”“偏小”或“无影响”)。
(4)两次实验记录的数据如下表:
实验用品 溶液温度 中和热
① 溶液 溶液 20 ℃ 23.3 ℃
② 溶液 溶液 20 ℃ 23.4 ℃
已知:,反应后溶液的比热容c为,各溶液的密度均为。则中和热____________。
(5)若改用盐酸和溶液进行反应,与上述实验相比,所放出的热量___________(填“相等”或“不相等”),若实验操作均正确,则所求中和热___________(填“相等”或“不相等”)。
答案以及解析
1.答案:C
解析:A.甲烷在氧气中燃烧反应是放热反应,A不符合题意;
B.氢氧化钠与盐酸反应发生时会放出热量,该反应为放热反应,B不符合题意;
C.盐酸与碳酸氢钠反应发生时要吸收热量,因此该反应为吸热反应,C符合题意;
D.二氧化硫与氧气加热时反应转化为三氧化硫,该反应为放热反应,D不符合题意;故合理选项是C。
2.答案:D
解析:需要加热才能发生的反应不一定是吸热反应,如铁和硫反应需要加热,但为放热反应,A错误;化学反应一定伴随能量变化,B错误;能量越高越不稳定,C错误;燃烧反应和酸碱中和反应是常见的放热反应,D正确。
3.答案:B
解析:冷敷袋是利用物质溶解时吸热来达到降低温度的目的。A项,冰融化时吸热,可以用于冷敷袋;B项,铁、碳、氯化钠溶于水时,溶液温度基本不变,不能用于冷敷袋;C项,硝酸铵溶于水时吸热,可以用于冷敷袋;D项,硝酸铵溶于水时吸热,十水合碳酸钠溶于水时放热,二者混合后,溶液温度基本不变,不能用于冷敷袋。
4.答案:A
解析:根据分析可知,酸碱反应的中和热计算时,至少需要的数据有:比热容c,酸的浓度和体积、碱的浓度和体积,反应前后温度变化△T,然后计算出反应后溶液的质量、生成水的物质的量,故选A。
5.答案:C
解析:A.稀与足量的溶液反应生成和,生成沉淀放热,故放出的热量大于57.3kJ,,A不符合题意;
B.一水合氨是弱碱,存在电离平衡,电离吸热,则稀盐酸与氨水反应生成时放出热量小于57.3kJ,ΔH> 57.3kJ/mol,B不符合题意;
C.稀盐酸与稀溶液反应生成时放出热量为57.3kJ,,C符合题意;
D.浓硫酸溶于水放热,则稀NaOH与浓硫酸反应生成时放出热量大于57.3kJ,,D不符合题意;故答案选C。
6.答案:A
解析:温度计水银球应浸入溶液中但不能与内筒底部接触,B项错误;盐酸是强酸,醋酸是弱酸,醋酸电离吸热,C项错误;NaOH溶液应迅速加入装有盐酸的内筒中,D项错误。
7.答案:D
解析:化学反应中,反应产物的总焓大于反应物的总焓,即,反应吸热。由于燃烧反应都是放热反应,因此答案选D。
8.答案:A
解析:NaOH溶液浓度过大,稀释过程释放热量,导致测得生成1 mol液态水时的,A符合题意;实验时搅拌速度慢,导致热量散失较多,测得生成1 mol液态水时的,B不符合题意;分2~3次把NaOH溶液倒入盛有稀盐酸的小烧杯中,导致热量散失较多,测得生成1 mol液态水时的,C不符合题意;用量取完稀盐酸的量筒直接量取氢氧化钠溶液,氢氧化钠部分被反应,导致测得生成1 mol液态水时的,D不符合题意。
9.答案:D
解析:温度计的水银柱上升,说明稀盐酸与NaOH溶液反应放热使温度升高,故A不符合题意;该反应中反应物的总能量大于生成物的总能量,为放热反应,故B不符合题意;反应开始后,甲处液面低于乙处液面,说明试管中的反应放热使集气瓶中的空气膨胀,故C不符合题意;反应开始后,锌粒与稀硫酸反应生成的氢气也会使针筒活塞向右移动,不能说明反应放热,故D符合题意。
10.答案:B
解析:由图可知,加入5 mL盐酸时混合液的温度为22 ℃,故实验时溶液初始温度应低于22 ℃,A项错误;该反应为放热反应,化学能转化为热能,B项正确;二者恰好完全反应时,反应放出的热量最多,此时,则NaOH溶液的浓度为,C项错误;有水生成的反应不一定是放热反应,如是吸热反应,D项错误。
11.答案:A
解析:A.图中,石墨的能量比金刚石低,所以石墨转变为金刚石是吸热反应,A正确;B.图中,S(g)的能量比S(s)的能量高,所以等质量的S(g)完全燃烧放出的热量大于S(s),B错误;C.图中,白磷的能量高于红磷的能量,所以白磷的稳定性差,C错误;D.图中,的反应物的总能量高于生成物的总能量,为放热反应,D错误。
12.答案:(1)环形玻璃搅拌棒;保温、隔热,减少实验过程中的热量损失
(2)C
(3)偏大
(4)
(5)不相等;相等
解析:(1)测定中和热,要使酸、碱快速混合,同时减少混合时的热量损失。
(2)中和热测定的关键是减少反应过程的热量损失,向盐酸中倒入溶液的正确操作是:一次迅速倒入,故合理选项是C。
(3)大烧杯上如果不盖硬纸板,则会导致部分热量损失,产生等量的水,溶液温度升高的少,使测得放出的热量减少,求得的中和热偏大。
(4),,则反应过程中放出的热量,反应产生水的物质的量是,则中和热。
(5)若改用盐酸和溶液进行反应,反应时酸过量,以不足量的溶液为标准计算,的物质的量比第一次反应的的物质的量多,则反应产生的水的物质的量就多,所放出的热量就比上次多;由于中和热是酸、碱发生中和反应产生1 mol水时放出的热量,因此若实验操作均正确,则所求中和热相等。
同课章节目录
- 第1章 化学反应与能量转化
- 第1节 化学反应的热效应
- 第2节 化学能转化为电能——电池
- 第3节 电能转化为化学能——电解
- 第4节 金属的腐蚀与防护
- 微项目 设计载人航天器用化学电池与氧气再生方案——化学反应中能量及物质的转化利用
- 第2章 化学反应的方向、 限度与速率
- 第1节 化学反应的方向
- 第2节 化学反应的限度
- 第3节 化学反应的速率
- 第4节 化学反应条件的优化——工业合成氨
- 微项目 探讨如何利用工业废气中的二氧化碳合成甲醇——化学反应选择与反应条件优化
- 第3章 物质在水溶液中的行为
- 第1节 水与水溶液
- 第2节 弱电解质的电离 盐类的水解
- 第3节 沉淀溶解平衡
- 第4节 离子反应
- 微项目 揭秘索尔维制碱法和侯氏制碱法——化学平衡思想的创造性应用
