1.1.3反应焓变的计算——高一化学鲁科版(2019)选择性必修一同步课时作业(含解析)
文档属性
| 名称 | 1.1.3反应焓变的计算——高一化学鲁科版(2019)选择性必修一同步课时作业(含解析) |  | |
| 格式 | docx | ||
| 文件大小 | 640.7KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 鲁科版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2025-07-03 09:09:15 | ||
图片预览



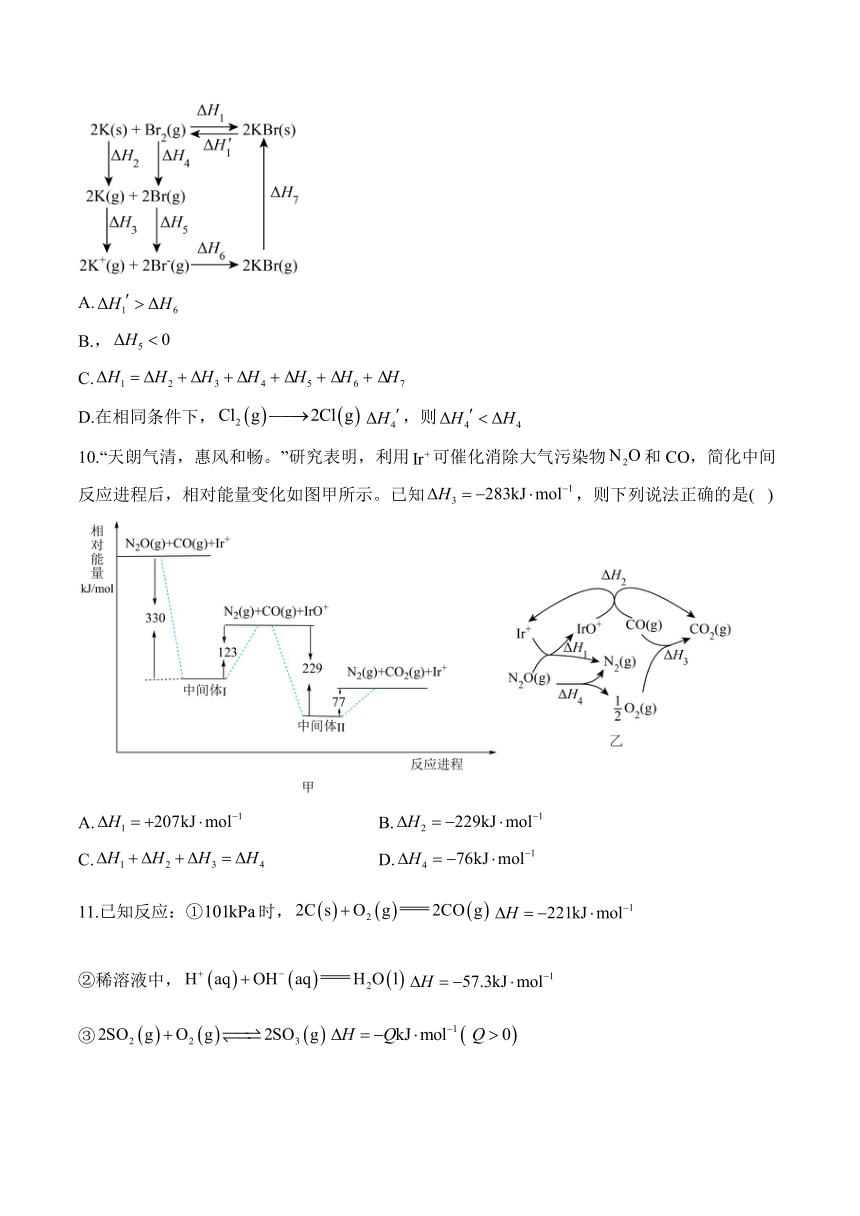

文档简介
1.1.3反应焓变的计算——高一化学鲁科版(2019)选择性必修一同步课时作业
1.下列有关说法正确的是( )
A.化学反应的过程中,一定伴随着物质变化,可能伴随着能量变化
B.在等温、等容条件下进行的化学反应,其反应热等于反应的焓变
C.化学反应伴随能量变化的本质原因为反应物的总能量与生成物的总能量不同
D.一定条件下,化学反应的反应热只与反应体系的始态和终态有关,与反应途径无关
2.已知:
根据上述反应所得出的结论正确的是( )
A. B.
C. D.金刚石比石墨稳定
3.根据下列热化学方程式:
①
②
③
可计算出的反应热( )
A. B.
C. D.
4.依据图示关系和金刚石燃烧的热化学方程式,下列说法不正确的是( )
①;
②金刚石燃烧的热化学方程式:。
A.
B.
C.金刚石比石墨稳定
D.化学反应的,只与反应体系的始态和终态有关,与反应途径无关
5.卤化铵()的能量关系如图所示,下列说法正确的是( )
A.,
B.相同条件下,的比的大
C.相同条件下,的比的小
D.
6.已知:
(浓)
上述反应均为溶液中的反应,则、、的大小的关系为( )
A. B. C. D.
7.已知:与不足量的反应时,生成S和。根据以下三个热化学方程式:
①
②
③
、、三者大小关系正确的是( )
A. B.
C. D.
8.工业上,冶炼铁的有关热化学方程式如下:
①;
②;
③;
④。
上述热化学方程式中,a、b、c、d均不等于0。下列说法不正确的是( )
A.
B.
C.
D.
9.金属钾和反应生成的能量循环如图。下列说法错误的是( )
A.
B.,
C.
D.在相同条件下,,则
10.“天朗气清,惠风和畅。”研究表明,利用可催化消除大气污染物和CO,简化中间反应进程后,相对能量变化如图甲所示。已知,则下列说法正确的是( )
A. B.
C. D.
11.已知反应:①时,
②稀溶液中,
③
④;
下列结论正确的是( )
A.碳的燃烧热等于
B.稀硫酸与稀氢氧化钡溶液反应生成水时放出的热量
C.一定条件下,和充分反应可放热QkJ
D.
12.(1)含有的稀溶液与的溶液反应,放出11.46 kJ的热量,表示该反应中和热的热化学方程式为______________,表示该反应中和热的离子方程式为____________________________。
(2)已知在常温常压下:
①
②写出表示甲醇燃烧热的热化学方程式:______________________________________。
(3)可转化为,在空气中加热反应可制得铁系氧化物材料。已知25 ℃,101 kPa时:
在空气中加热反应生成的热化学方程式是______________________。
(4)在25 ℃、101 kPa下,一定质量的无水乙醇完全燃烧时放出热量Q kJ,其燃烧生成的用过量饱和石灰水吸收可得沉淀,则乙醇燃烧的热化学方程式为__________________________________________。
(5)已知反应的,、分子中化学键断裂时分别需要吸收436 kJ、151 kJ的能量,则分子中化学键断裂时需吸收的能量为_________kJ。
(6)和反应生成和的能量变化如图所示,若生成,其______________。
答案以及解析
1.答案:D
解析:A.化学反应的过程中,一定伴随着物质变化,可能伴随着能量变化,A正确;B.在等温、等容条件下进行的化学反应,其反应热等于反应的焓变,B正确;C.化学反应伴随能量变化的本质原因为反应物的总能量与生成物的总能量不同,C正确;D.一定条件下,化学反应的反应热只与反应体系的始量与生成物的终态有关,与反应的途径无关,D错误;答案选D。
2.答案:C
解析:根据金刚石和石墨的转化,此反应是放热反应,即金刚石具有的能量高于石墨,因此金刚石燃烧放出的热量高于石墨,因此。
答案选C。
3.答案:B
解析:①
②
③
由盖斯定律可知,①×2+②×2-③得到的反应热,故选B。
4.答案:C
解析:A.由盖斯定律,,A正确;
B.①
②
根据盖斯定律①-②可得:,B正确;
C.
则金刚石放热更多,则金刚石能量高于石墨,那么金刚石不如石墨稳定,C错误;
D.根据盖斯定律化学反应的,只与反应体系的始态和终态有关,与反应途径无关,D正确;
故选C。
5.答案:B
解析:A.卤化铵的分解为吸热反应,则,对应的为化学键断裂过程,断裂化学键吸收热量,则,A错误;
B.的键能大于,故的大于的,B正确;
C.为与反应,与无关,C错误;
D.途径6与途径1、2、3、4、5之和的起点和终点相同,结合盖斯定律可知,D错误;
故选B。
6.答案:B
解析:稀的强酸与强碱生成1mol放出的热量为中和热,醋酸的电离吸热,放出的热量的绝对值偏小,浓硫酸稀释放热,放出的热量的绝对值偏大,而稀硝酸为稀的强酸,中和热不变,由于酸和碱的中和反应是放热反应,<0,放出热量越多的越小,所以:,故选:B。
7.答案:B
解析:依据反应的能量守恒可知反应都是放热反应,①;②;③;均为负数,反应②③相比,生成气态水和生成液态水相比,生成液态水放出的热量多,所以;反应①②相比,②反应生成的单质硫转化为二氧化硫时放出热量,所以,综上所述,三者大小关系为:,故选B。
8.答案:D
解析:①为放热反应,;②为吸热反应,,因此,A正确。②,③,根据盖斯定律可知,反应②×3+反应③×2,可得,B正确。①,②,根据盖斯定律可知,(反应①+反应②)×,可得,C正确。因为碳燃烧生成CO为放热反应,所以1 mol碳完全燃烧放出的热量大于1 mol CO完全燃烧放出的热量,而反应热为负值,故,D错误。
9.答案:D
解析:A.对应的是,表示形成化学键,对应的是KBr分解反应,为吸热反应,,故,故A正确;
B.表示气体K原子失去电子时的热效应,要吸热,即表示气体溴原子得到电子时的热效应,要放热,故,故B正确;
C.根据盖斯定律,反应过程不管是一步完成还是分多步完成,热效应不变,有,故C正确;
D.氯原子半径更小,键强于Br-Br键,故吸热更多,故,故D错误;
答案选D。
10.答案:D
解析:根据甲和乙的能量变化可知,反应①,,反应②,,反应③,。
A.由分析可知:,A错误;
B.由分析可知:,B错误;
C.反应④为,由盖斯定律:反应④=反应①+反应②-反应③,则,C错误;
D.根据盖斯定律,,D正确;
答案选D。
11.答案:D
解析:A.碳的燃烧热是指1mol碳完全燃烧放出的热量变化,根据题中信息不能得出碳的燃烧热,故A错误;
B.稀硫酸与稀氢氧化钡溶液反应生成水的同时还生成了硫酸钡沉淀,因此生成1mol水时放出的热量大于,故B错误;
C.根据(Q>0),由于该反应是可逆反应,一定条件下,和充分反应,可放出的热量小于QkJ,故C错误;
D.根据盖斯定律得到第一个方程式减去第二个方程式得到,故D正确。
综上所述,答案为D。
12.答案:(1);
(2)
(3)
(4)
(5)299
(6)-139
解析:(1),,二者发生反应,生成0.2 mol水放出11.46 kJ热量,则生成1 mol水放出57.3 kJ热量,中和热为生成1 mol水放出的热量,则表示该反应中和热的热化学方程式为;表示该反应中和热的离子方程式为。
(2)①
②,根据盖斯定律,将①-②×4得:。在101 kPa时,1 mol可燃物完全燃烧生成指定产物时所放出的热量,叫作该物质的燃烧热。所以表示甲醇燃烧热的热化学方程式为:。
(3)已知:①,②,③,根据盖斯定律,①-③×2+②×4可得
。
(4)因生成的用过量饱和石灰水完全吸收,可得沉淀,的物质的量是1 mol,由碳元素守恒可知,二氧化碳的物质的量也为1 mol,即生成放出的热量为Q kJ,而完全燃烧时生成,则放出的热量为,热化学方程式为:。
(5)设分子中化学键断裂时需吸收的能量为x kJ,反应的、、分子中化学键断裂时分别需要吸收436 kJ、151 kJ的能量,则,解得。
(6)由图可知,。
1.下列有关说法正确的是( )
A.化学反应的过程中,一定伴随着物质变化,可能伴随着能量变化
B.在等温、等容条件下进行的化学反应,其反应热等于反应的焓变
C.化学反应伴随能量变化的本质原因为反应物的总能量与生成物的总能量不同
D.一定条件下,化学反应的反应热只与反应体系的始态和终态有关,与反应途径无关
2.已知:
根据上述反应所得出的结论正确的是( )
A. B.
C. D.金刚石比石墨稳定
3.根据下列热化学方程式:
①
②
③
可计算出的反应热( )
A. B.
C. D.
4.依据图示关系和金刚石燃烧的热化学方程式,下列说法不正确的是( )
①;
②金刚石燃烧的热化学方程式:。
A.
B.
C.金刚石比石墨稳定
D.化学反应的,只与反应体系的始态和终态有关,与反应途径无关
5.卤化铵()的能量关系如图所示,下列说法正确的是( )
A.,
B.相同条件下,的比的大
C.相同条件下,的比的小
D.
6.已知:
(浓)
上述反应均为溶液中的反应,则、、的大小的关系为( )
A. B. C. D.
7.已知:与不足量的反应时,生成S和。根据以下三个热化学方程式:
①
②
③
、、三者大小关系正确的是( )
A. B.
C. D.
8.工业上,冶炼铁的有关热化学方程式如下:
①;
②;
③;
④。
上述热化学方程式中,a、b、c、d均不等于0。下列说法不正确的是( )
A.
B.
C.
D.
9.金属钾和反应生成的能量循环如图。下列说法错误的是( )
A.
B.,
C.
D.在相同条件下,,则
10.“天朗气清,惠风和畅。”研究表明,利用可催化消除大气污染物和CO,简化中间反应进程后,相对能量变化如图甲所示。已知,则下列说法正确的是( )
A. B.
C. D.
11.已知反应:①时,
②稀溶液中,
③
④;
下列结论正确的是( )
A.碳的燃烧热等于
B.稀硫酸与稀氢氧化钡溶液反应生成水时放出的热量
C.一定条件下,和充分反应可放热QkJ
D.
12.(1)含有的稀溶液与的溶液反应,放出11.46 kJ的热量,表示该反应中和热的热化学方程式为______________,表示该反应中和热的离子方程式为____________________________。
(2)已知在常温常压下:
①
②写出表示甲醇燃烧热的热化学方程式:______________________________________。
(3)可转化为,在空气中加热反应可制得铁系氧化物材料。已知25 ℃,101 kPa时:
在空气中加热反应生成的热化学方程式是______________________。
(4)在25 ℃、101 kPa下,一定质量的无水乙醇完全燃烧时放出热量Q kJ,其燃烧生成的用过量饱和石灰水吸收可得沉淀,则乙醇燃烧的热化学方程式为__________________________________________。
(5)已知反应的,、分子中化学键断裂时分别需要吸收436 kJ、151 kJ的能量,则分子中化学键断裂时需吸收的能量为_________kJ。
(6)和反应生成和的能量变化如图所示,若生成,其______________。
答案以及解析
1.答案:D
解析:A.化学反应的过程中,一定伴随着物质变化,可能伴随着能量变化,A正确;B.在等温、等容条件下进行的化学反应,其反应热等于反应的焓变,B正确;C.化学反应伴随能量变化的本质原因为反应物的总能量与生成物的总能量不同,C正确;D.一定条件下,化学反应的反应热只与反应体系的始量与生成物的终态有关,与反应的途径无关,D错误;答案选D。
2.答案:C
解析:根据金刚石和石墨的转化,此反应是放热反应,即金刚石具有的能量高于石墨,因此金刚石燃烧放出的热量高于石墨,因此。
答案选C。
3.答案:B
解析:①
②
③
由盖斯定律可知,①×2+②×2-③得到的反应热,故选B。
4.答案:C
解析:A.由盖斯定律,,A正确;
B.①
②
根据盖斯定律①-②可得:,B正确;
C.
则金刚石放热更多,则金刚石能量高于石墨,那么金刚石不如石墨稳定,C错误;
D.根据盖斯定律化学反应的,只与反应体系的始态和终态有关,与反应途径无关,D正确;
故选C。
5.答案:B
解析:A.卤化铵的分解为吸热反应,则,对应的为化学键断裂过程,断裂化学键吸收热量,则,A错误;
B.的键能大于,故的大于的,B正确;
C.为与反应,与无关,C错误;
D.途径6与途径1、2、3、4、5之和的起点和终点相同,结合盖斯定律可知,D错误;
故选B。
6.答案:B
解析:稀的强酸与强碱生成1mol放出的热量为中和热,醋酸的电离吸热,放出的热量的绝对值偏小,浓硫酸稀释放热,放出的热量的绝对值偏大,而稀硝酸为稀的强酸,中和热不变,由于酸和碱的中和反应是放热反应,<0,放出热量越多的越小,所以:,故选:B。
7.答案:B
解析:依据反应的能量守恒可知反应都是放热反应,①;②;③;均为负数,反应②③相比,生成气态水和生成液态水相比,生成液态水放出的热量多,所以;反应①②相比,②反应生成的单质硫转化为二氧化硫时放出热量,所以,综上所述,三者大小关系为:,故选B。
8.答案:D
解析:①为放热反应,;②为吸热反应,,因此,A正确。②,③,根据盖斯定律可知,反应②×3+反应③×2,可得,B正确。①,②,根据盖斯定律可知,(反应①+反应②)×,可得,C正确。因为碳燃烧生成CO为放热反应,所以1 mol碳完全燃烧放出的热量大于1 mol CO完全燃烧放出的热量,而反应热为负值,故,D错误。
9.答案:D
解析:A.对应的是,表示形成化学键,对应的是KBr分解反应,为吸热反应,,故,故A正确;
B.表示气体K原子失去电子时的热效应,要吸热,即表示气体溴原子得到电子时的热效应,要放热,故,故B正确;
C.根据盖斯定律,反应过程不管是一步完成还是分多步完成,热效应不变,有,故C正确;
D.氯原子半径更小,键强于Br-Br键,故吸热更多,故,故D错误;
答案选D。
10.答案:D
解析:根据甲和乙的能量变化可知,反应①,,反应②,,反应③,。
A.由分析可知:,A错误;
B.由分析可知:,B错误;
C.反应④为,由盖斯定律:反应④=反应①+反应②-反应③,则,C错误;
D.根据盖斯定律,,D正确;
答案选D。
11.答案:D
解析:A.碳的燃烧热是指1mol碳完全燃烧放出的热量变化,根据题中信息不能得出碳的燃烧热,故A错误;
B.稀硫酸与稀氢氧化钡溶液反应生成水的同时还生成了硫酸钡沉淀,因此生成1mol水时放出的热量大于,故B错误;
C.根据(Q>0),由于该反应是可逆反应,一定条件下,和充分反应,可放出的热量小于QkJ,故C错误;
D.根据盖斯定律得到第一个方程式减去第二个方程式得到,故D正确。
综上所述,答案为D。
12.答案:(1);
(2)
(3)
(4)
(5)299
(6)-139
解析:(1),,二者发生反应,生成0.2 mol水放出11.46 kJ热量,则生成1 mol水放出57.3 kJ热量,中和热为生成1 mol水放出的热量,则表示该反应中和热的热化学方程式为;表示该反应中和热的离子方程式为。
(2)①
②,根据盖斯定律,将①-②×4得:。在101 kPa时,1 mol可燃物完全燃烧生成指定产物时所放出的热量,叫作该物质的燃烧热。所以表示甲醇燃烧热的热化学方程式为:。
(3)已知:①,②,③,根据盖斯定律,①-③×2+②×4可得
。
(4)因生成的用过量饱和石灰水完全吸收,可得沉淀,的物质的量是1 mol,由碳元素守恒可知,二氧化碳的物质的量也为1 mol,即生成放出的热量为Q kJ,而完全燃烧时生成,则放出的热量为,热化学方程式为:。
(5)设分子中化学键断裂时需吸收的能量为x kJ,反应的、、分子中化学键断裂时分别需要吸收436 kJ、151 kJ的能量,则,解得。
(6)由图可知,。
同课章节目录
- 第1章 化学反应与能量转化
- 第1节 化学反应的热效应
- 第2节 化学能转化为电能——电池
- 第3节 电能转化为化学能——电解
- 第4节 金属的腐蚀与防护
- 微项目 设计载人航天器用化学电池与氧气再生方案——化学反应中能量及物质的转化利用
- 第2章 化学反应的方向、 限度与速率
- 第1节 化学反应的方向
- 第2节 化学反应的限度
- 第3节 化学反应的速率
- 第4节 化学反应条件的优化——工业合成氨
- 微项目 探讨如何利用工业废气中的二氧化碳合成甲醇——化学反应选择与反应条件优化
- 第3章 物质在水溶液中的行为
- 第1节 水与水溶液
- 第2节 弱电解质的电离 盐类的水解
- 第3节 沉淀溶解平衡
- 第4节 离子反应
- 微项目 揭秘索尔维制碱法和侯氏制碱法——化学平衡思想的创造性应用
