1.2.1原电池的工作原理——高一化学鲁科版(2019)选择性必修一同步课时作业(含解析)
文档属性
| 名称 | 1.2.1原电池的工作原理——高一化学鲁科版(2019)选择性必修一同步课时作业(含解析) |  | |
| 格式 | docx | ||
| 文件大小 | 635.8KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 鲁科版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2025-07-03 09:09:37 | ||
图片预览


文档简介
1.2.1原电池的工作原理——高一化学鲁科版(2019)选择性必修一同步课时作业
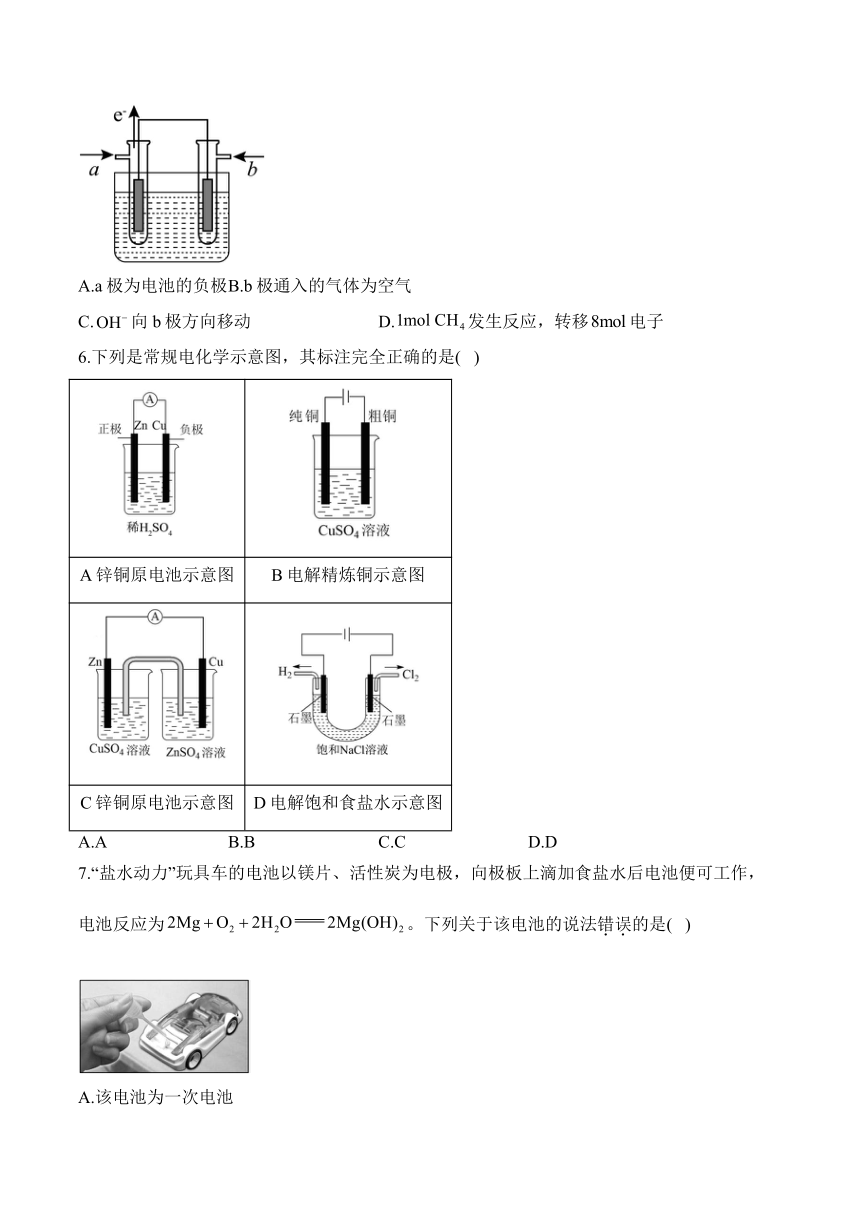
1.下列装置能构成原电池的是( )
A. B. C. D.
2.原电池原理在生活中的应用非常广泛,下列有关电池的说法正确的是( )
A.硅太阳能电池与燃料电池一样,都是将化学能转化为电能
B.理论上说,任何能自发进行的氧化还原反应都可设计成原电池
C.原电池的两极一定是由活动性不同的两种金属组成
D.将镁和铝用导线连接放入氢氧化钠溶液中组成原电池,镁电极作为负极
3.下列可设计成原电池的化学反应是( )
A.
B.
C.
D.
4.图1是铜锌原电池示意图。图2中,x轴表示实验时流入正极的电子的物质的量,y轴表示( )
A.锌棒的质量 B. C.pH D.
5.燃料电池能量转化效率高,供电量易于调节,具有广阔的应用前景。以溶液为电解质溶液的某甲烷—空气燃料电池装置如图所示,下列说法错误的是( )
A.a极为电池的负极 B.b极通入的气体为空气
C.向b极方向移动 D.发生反应,转移电子
6.下列是常规电化学示意图,其标注完全正确的是( )
A锌铜原电池示意图 B电解精炼铜示意图
C锌铜原电池示意图 D电解饱和食盐水示意图
A.A B.B C.C D.D
7.“盐水动力”玩具车的电池以镁片、活性炭为电极,向极板上滴加食盐水后电池便可工作,电池反应为。下列关于该电池的说法错误的是( )
A.该电池为一次电池
B.活性炭得电子被还原
C.电池工作时镁片作负极被消耗
D.电池工作时食盐水中的向活性炭移动
8.有关如图所示原电池(盐桥中装有含琼脂的饱和溶液)的叙述,正确的是( )
A.铜片上有气泡逸出
B.反应中,盐桥中的会移向溶液
C.取出盐桥后,电流计依然发生偏转
D.反应前后铜片质量不改变
9.现有a、b、c、d四个金属电极,用导线两两相连组成原电池。
①a、b相连插入硫酸铜溶液中后,b极变粗;
②a、d相连插入稀硫酸中后,外电路电流从a流向d;
③b、c相连插入稀硫酸中后,c极上有气泡产生;
④c、d相连插入稀硫酸中后,d极溶解。
由此可判断这四种金属的活动性顺序是( )
A. B. C. D.
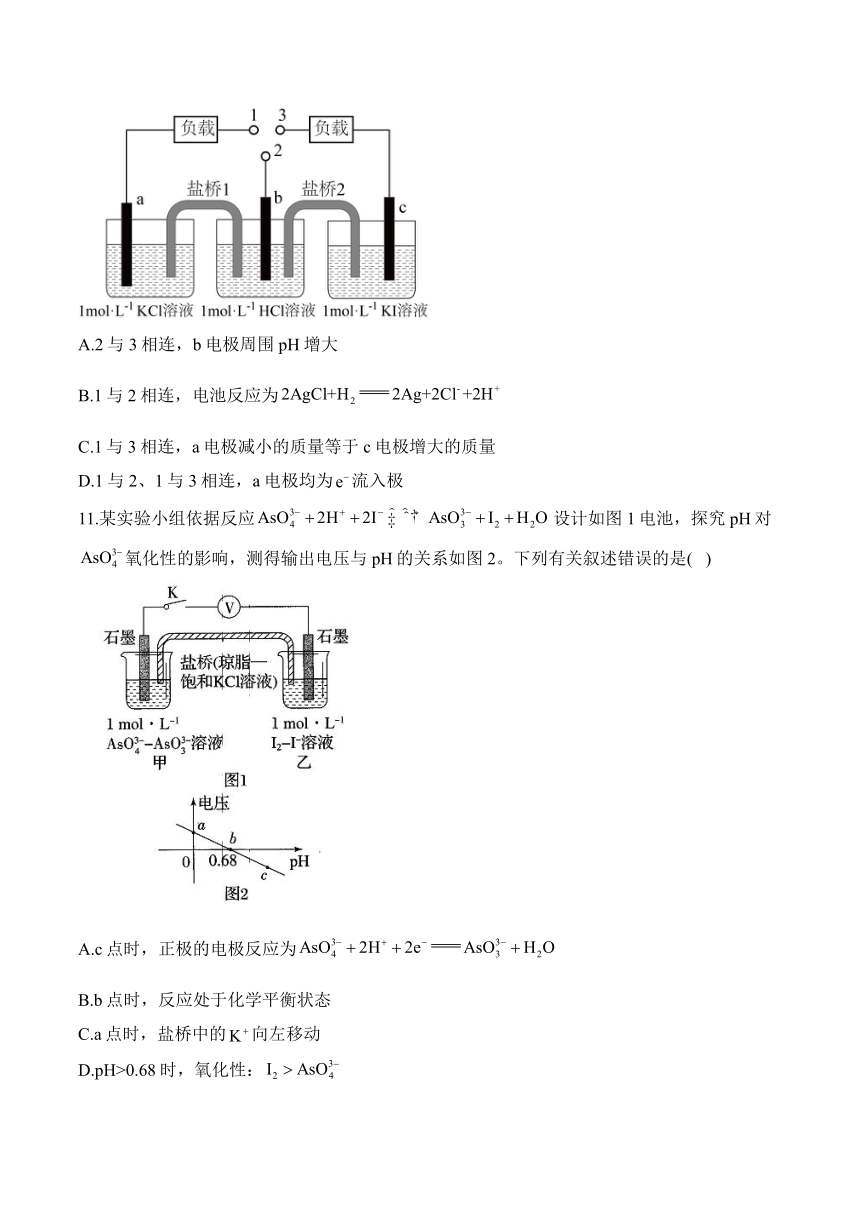
10.如图所示电化学装置,b为标准氢电极,可发生还原反应或氧化反应,a、c分别为AgCl/Ag、AgI/Ag电极。实验发现:1与2相连a电极质量减小,2与3相连c电极质量增大。下列说法不正确的是( )
A.2与3相连,b电极周围pH增大
B.1与2相连,电池反应为
C.1与3相连,a电极减小的质量等于c电极增大的质量
D.1与2、1与3相连,a电极均为流入极
11.某实验小组依据反应设计如图1电池,探究pH对氧化性的影响,测得输出电压与pH的关系如图2。下列有关叙述错误的是( )
A.c点时,正极的电极反应为
B.b点时,反应处于化学平衡状态
C.a点时,盐桥中的向左移动
D.pH>0.68时,氧化性:
12.某课外小组利用原电池原理驱动某简易小车(用电动机表示)。
(1)初步设计的实验装置示意图如图1所示,溶液在图1所示装置中的作用是_______(答两点)。
实验发现:该装置不能驱动小车。
(2)该小组同学提出假设:可能是氧化反应和还原反应没有完全隔开,降低了能量利用率。为进一步提高能量利用率,该小组同学在原有反应的基础上将氧化反应与还原反应隔开进行,优化的实验装置示意图如图2所示,图2中A溶液和B溶液分别是_______和_______,盐桥属于_______(填“电子导体”或“离子导体”),盐桥中的移向_______溶液(填“A”或“B”)。为降低电池自重,该小组用阳离子交换膜代替盐桥,实验装置示意图如图3所示。
(3)利用改进后的实验装置(图3),仍不能驱动小车,该小组同学再次提出假设:可能是电压不够;可能是电流不够;可能是电压和电流都不够。
实验发现:1.5 V的干电池能驱动小车,其电流为;
图3中实验装置的最大电压为1.0 V,最大电流为。
该小组从电极材料、电极反应、离子导体等角度对装置做进一步优化,请补全优化后的实验装置示意图4,并在图中用箭头标明阳离子的流向。
答案以及解析
1.答案:C
解析:A.A装置没有形成闭合电路,不能构成原电池,故不选A;
B.B装置中两个电极材料相同,不能构成原电池,故不选B;
C.铁和稀硫酸反应,铁失电子发生氧化反应,铁为负极,氢离子在碳棒表面得电子生成氢气,碳棒为正极,能构成原电池,故选C;
D.乙醇是非电解质,不能构成原电池,故不选D;
选C。
2.答案:B
解析:A(×)硅太阳能电池是将太阳能转化为电能。
B(√)氧化还原反应中存在电子的转移,理论上说,任何能自发进行的氧化还原反应都可以设计成原电池。
C(×)原电池的两极可以是两种活动性不同的金属,也可以是金属和非金属,如铁和石墨在稀硫酸中也能构成原电池,还可以都是金属铂或石墨,如氢氧燃料电池。
D(×)NaOH溶液与镁不反应,NaOH溶液与铝反应生成和,铝电极作为负极,镁电极作为正极。
3.答案:D
解析:可设计成原电池的化学反应是能自发进行的氧化还原反应,且通常为放热反应。
A(×)为非氧化还原反应。
B(×)为非氧化还原反应。
C(×)虽然是氧化还原反应,但属于吸热反应。
D(√)为氧化还原反应,且为放热反应。
4.答案:A
解析:A.随着流入正极电子物质的量增多,即反应进行,锌棒不断溶解,锌棒质量不断减小,与图2曲线变化相符,A正确;
B.因为,随着流入正极电子物质的量增多,反应生成的增多,应增大,与图2曲线变化不符,B错误;
C.由于正极反应消耗,随着流入正极电子物质的量增多,溶液中减小,pH应增大,与图2曲线变化不符,C错误;
D.不参与原电池反应,其浓度不变,与图2曲线变化不符,D错误;
5.答案:C
解析:a极有电子流出,则a极为负极,A项正确;b极为原电池的正极,通入的气体为空气,B项正确,原电池中阴离子向负极移动,因此移向a极,C项错误;a极的电极反应式为,因此发生反应,转移8mol电子,D项正确。
6.答案:D
解析:A.铜锌原电池中锌作负极,铜作正极,故A错误;
B.在精炼铜中,粗铜作阳极与电源正极相连,精铜作阴极,与电源的负极相连,电解液为硫酸铜溶液,故B错误;
C.带有盐桥的铜锌原电池中,作负极锌的电解液为硫酸锌,做正极铜的电解液为硫酸铜,故C错误;
D.电解饱和食盐水的阳极产生氯气,阴极产生氢气,故D正确;
7.答案:D
解析:A.该电池为一次电池,A正确;
B.根据原电池反应式知,氧气在活性炭电极得到电子被还原,B正确;
C.根据原电池反应式知,Mg元素化合价由0价变为+2价,所以Mg失电子作负极,C正确;
D.电池工作时,阳离子往负极移动,食盐水中的向负极的镁片移动,D错误;
8.答案:B
解析:A.Cu为正极,发生还原反应,析出Cu,A错误;
B.原电池工作时,阳离子向正极移动,阴离子向负极移动,盐桥中的会移向溶液,B正确;
C.取出盐桥后,不是闭合回路,没有形成原电池,电流计不发生偏转,C错误;
D.Cu为正极,发生还原反应,析出Cu附着在Cu电极上,故铜片质量增加,D错误;
9.答案:C
解析:①a、b相连插入硫酸铜溶液中后,b极变粗,则b为正极,a为负极,金属活动性;
②a、d相连插入稀硫酸中后,外电路电流从a流向d,则a为正极,d为负极,金属活动性;
③b、c相连插入稀硫酸中后,c极上有气泡产生,则c为正极,b为负极,金属活动性;
④c、d相连插入稀硫酸中后,d极溶解,则d为负极,c为正极,金属活动性;
综合以上分析,可以得出金属活动性关系为,故选C。
10.答案:C
解析:A.2与3相连,c电极质量增大,则c极发生反应,c极为负极,则b极为正极,发生反应,b电极消耗,周围pH增大,A正确;
B.1与2相连,a电极质量减小,则a电极发生反应,a极为正极,b极为负极,发生反应,依据得失电子守恒,将两电极反应调整得失电子守恒后相加,即得电池反应为,B正确;
C.1与3相连时,由于AgI的溶解度更小,AgCl易转化为AgI,则a极为正极,c电极为负极,a电极反应为,c电极反应为,所以a电极减小的质量小于c电极增大的质量,C不正确;
D.由前面分析可知,1与2时,a极为正极,1与3相连时,a极也为正极,则a电极均为e-流入极,D正确;
故选C。
11.答案:A
解析:A.pH>0.68时,电压小于0,反应逆向进行,在负极失电子,则负极电极反应式为,A选项错误;B.pH=0.68时,电压为零,反应处于平衡状态,B选项正确;C.乙中碘离子失电子,则乙中石墨电极为负极,甲中石墨为正极,原电池中阳离子向正极移动,所以盐桥中的向左移动,C选项正确;D.pH>0.8时,电压小于0,反应逆向进行,碘作氧化剂,所以氧化性,D选项正确。
12.答案:(1)传导离子、作正极反应物
(2)硫酸锌溶液;硫酸铜溶液;离子导体;A
(3)(答案合理即可)
解析:(1)由图1可知,该原电池中Zn作负极,Cu作正极,溶液中的在正极得到电子生成Cu,故溶液起传导离子、作正极反应物的作用。
(2)由图2可知,Zn为负极,Cu为正极,故B溶液应为硫酸铜溶液,A溶液应为硫酸锌溶液;盐桥属于离子导体:原电池中阴离子向负极移动,Zn为负极,故向A溶液移动。
(3)由图4可知,电子从左边电极经外电路流向右边电极,则左边电极为负极,右边电极为正极,根据题意可知,需要增大电压和电流,故可选取电极材料Mg和石墨,阳离子向正极移动,优化后的实验装置示意图可以为
。
1.下列装置能构成原电池的是( )
A. B. C. D.
2.原电池原理在生活中的应用非常广泛,下列有关电池的说法正确的是( )
A.硅太阳能电池与燃料电池一样,都是将化学能转化为电能
B.理论上说,任何能自发进行的氧化还原反应都可设计成原电池
C.原电池的两极一定是由活动性不同的两种金属组成
D.将镁和铝用导线连接放入氢氧化钠溶液中组成原电池,镁电极作为负极
3.下列可设计成原电池的化学反应是( )
A.
B.
C.
D.
4.图1是铜锌原电池示意图。图2中,x轴表示实验时流入正极的电子的物质的量,y轴表示( )
A.锌棒的质量 B. C.pH D.
5.燃料电池能量转化效率高,供电量易于调节,具有广阔的应用前景。以溶液为电解质溶液的某甲烷—空气燃料电池装置如图所示,下列说法错误的是( )
A.a极为电池的负极 B.b极通入的气体为空气
C.向b极方向移动 D.发生反应,转移电子
6.下列是常规电化学示意图,其标注完全正确的是( )
A锌铜原电池示意图 B电解精炼铜示意图
C锌铜原电池示意图 D电解饱和食盐水示意图
A.A B.B C.C D.D
7.“盐水动力”玩具车的电池以镁片、活性炭为电极,向极板上滴加食盐水后电池便可工作,电池反应为。下列关于该电池的说法错误的是( )
A.该电池为一次电池
B.活性炭得电子被还原
C.电池工作时镁片作负极被消耗
D.电池工作时食盐水中的向活性炭移动
8.有关如图所示原电池(盐桥中装有含琼脂的饱和溶液)的叙述,正确的是( )
A.铜片上有气泡逸出
B.反应中,盐桥中的会移向溶液
C.取出盐桥后,电流计依然发生偏转
D.反应前后铜片质量不改变
9.现有a、b、c、d四个金属电极,用导线两两相连组成原电池。
①a、b相连插入硫酸铜溶液中后,b极变粗;
②a、d相连插入稀硫酸中后,外电路电流从a流向d;
③b、c相连插入稀硫酸中后,c极上有气泡产生;
④c、d相连插入稀硫酸中后,d极溶解。
由此可判断这四种金属的活动性顺序是( )
A. B. C. D.
10.如图所示电化学装置,b为标准氢电极,可发生还原反应或氧化反应,a、c分别为AgCl/Ag、AgI/Ag电极。实验发现:1与2相连a电极质量减小,2与3相连c电极质量增大。下列说法不正确的是( )
A.2与3相连,b电极周围pH增大
B.1与2相连,电池反应为
C.1与3相连,a电极减小的质量等于c电极增大的质量
D.1与2、1与3相连,a电极均为流入极
11.某实验小组依据反应设计如图1电池,探究pH对氧化性的影响,测得输出电压与pH的关系如图2。下列有关叙述错误的是( )
A.c点时,正极的电极反应为
B.b点时,反应处于化学平衡状态
C.a点时,盐桥中的向左移动
D.pH>0.68时,氧化性:
12.某课外小组利用原电池原理驱动某简易小车(用电动机表示)。
(1)初步设计的实验装置示意图如图1所示,溶液在图1所示装置中的作用是_______(答两点)。
实验发现:该装置不能驱动小车。
(2)该小组同学提出假设:可能是氧化反应和还原反应没有完全隔开,降低了能量利用率。为进一步提高能量利用率,该小组同学在原有反应的基础上将氧化反应与还原反应隔开进行,优化的实验装置示意图如图2所示,图2中A溶液和B溶液分别是_______和_______,盐桥属于_______(填“电子导体”或“离子导体”),盐桥中的移向_______溶液(填“A”或“B”)。为降低电池自重,该小组用阳离子交换膜代替盐桥,实验装置示意图如图3所示。
(3)利用改进后的实验装置(图3),仍不能驱动小车,该小组同学再次提出假设:可能是电压不够;可能是电流不够;可能是电压和电流都不够。
实验发现:1.5 V的干电池能驱动小车,其电流为;
图3中实验装置的最大电压为1.0 V,最大电流为。
该小组从电极材料、电极反应、离子导体等角度对装置做进一步优化,请补全优化后的实验装置示意图4,并在图中用箭头标明阳离子的流向。
答案以及解析
1.答案:C
解析:A.A装置没有形成闭合电路,不能构成原电池,故不选A;
B.B装置中两个电极材料相同,不能构成原电池,故不选B;
C.铁和稀硫酸反应,铁失电子发生氧化反应,铁为负极,氢离子在碳棒表面得电子生成氢气,碳棒为正极,能构成原电池,故选C;
D.乙醇是非电解质,不能构成原电池,故不选D;
选C。
2.答案:B
解析:A(×)硅太阳能电池是将太阳能转化为电能。
B(√)氧化还原反应中存在电子的转移,理论上说,任何能自发进行的氧化还原反应都可以设计成原电池。
C(×)原电池的两极可以是两种活动性不同的金属,也可以是金属和非金属,如铁和石墨在稀硫酸中也能构成原电池,还可以都是金属铂或石墨,如氢氧燃料电池。
D(×)NaOH溶液与镁不反应,NaOH溶液与铝反应生成和,铝电极作为负极,镁电极作为正极。
3.答案:D
解析:可设计成原电池的化学反应是能自发进行的氧化还原反应,且通常为放热反应。
A(×)为非氧化还原反应。
B(×)为非氧化还原反应。
C(×)虽然是氧化还原反应,但属于吸热反应。
D(√)为氧化还原反应,且为放热反应。
4.答案:A
解析:A.随着流入正极电子物质的量增多,即反应进行,锌棒不断溶解,锌棒质量不断减小,与图2曲线变化相符,A正确;
B.因为,随着流入正极电子物质的量增多,反应生成的增多,应增大,与图2曲线变化不符,B错误;
C.由于正极反应消耗,随着流入正极电子物质的量增多,溶液中减小,pH应增大,与图2曲线变化不符,C错误;
D.不参与原电池反应,其浓度不变,与图2曲线变化不符,D错误;
5.答案:C
解析:a极有电子流出,则a极为负极,A项正确;b极为原电池的正极,通入的气体为空气,B项正确,原电池中阴离子向负极移动,因此移向a极,C项错误;a极的电极反应式为,因此发生反应,转移8mol电子,D项正确。
6.答案:D
解析:A.铜锌原电池中锌作负极,铜作正极,故A错误;
B.在精炼铜中,粗铜作阳极与电源正极相连,精铜作阴极,与电源的负极相连,电解液为硫酸铜溶液,故B错误;
C.带有盐桥的铜锌原电池中,作负极锌的电解液为硫酸锌,做正极铜的电解液为硫酸铜,故C错误;
D.电解饱和食盐水的阳极产生氯气,阴极产生氢气,故D正确;
7.答案:D
解析:A.该电池为一次电池,A正确;
B.根据原电池反应式知,氧气在活性炭电极得到电子被还原,B正确;
C.根据原电池反应式知,Mg元素化合价由0价变为+2价,所以Mg失电子作负极,C正确;
D.电池工作时,阳离子往负极移动,食盐水中的向负极的镁片移动,D错误;
8.答案:B
解析:A.Cu为正极,发生还原反应,析出Cu,A错误;
B.原电池工作时,阳离子向正极移动,阴离子向负极移动,盐桥中的会移向溶液,B正确;
C.取出盐桥后,不是闭合回路,没有形成原电池,电流计不发生偏转,C错误;
D.Cu为正极,发生还原反应,析出Cu附着在Cu电极上,故铜片质量增加,D错误;
9.答案:C
解析:①a、b相连插入硫酸铜溶液中后,b极变粗,则b为正极,a为负极,金属活动性;
②a、d相连插入稀硫酸中后,外电路电流从a流向d,则a为正极,d为负极,金属活动性;
③b、c相连插入稀硫酸中后,c极上有气泡产生,则c为正极,b为负极,金属活动性;
④c、d相连插入稀硫酸中后,d极溶解,则d为负极,c为正极,金属活动性;
综合以上分析,可以得出金属活动性关系为,故选C。
10.答案:C
解析:A.2与3相连,c电极质量增大,则c极发生反应,c极为负极,则b极为正极,发生反应,b电极消耗,周围pH增大,A正确;
B.1与2相连,a电极质量减小,则a电极发生反应,a极为正极,b极为负极,发生反应,依据得失电子守恒,将两电极反应调整得失电子守恒后相加,即得电池反应为,B正确;
C.1与3相连时,由于AgI的溶解度更小,AgCl易转化为AgI,则a极为正极,c电极为负极,a电极反应为,c电极反应为,所以a电极减小的质量小于c电极增大的质量,C不正确;
D.由前面分析可知,1与2时,a极为正极,1与3相连时,a极也为正极,则a电极均为e-流入极,D正确;
故选C。
11.答案:A
解析:A.pH>0.68时,电压小于0,反应逆向进行,在负极失电子,则负极电极反应式为,A选项错误;B.pH=0.68时,电压为零,反应处于平衡状态,B选项正确;C.乙中碘离子失电子,则乙中石墨电极为负极,甲中石墨为正极,原电池中阳离子向正极移动,所以盐桥中的向左移动,C选项正确;D.pH>0.8时,电压小于0,反应逆向进行,碘作氧化剂,所以氧化性,D选项正确。
12.答案:(1)传导离子、作正极反应物
(2)硫酸锌溶液;硫酸铜溶液;离子导体;A
(3)(答案合理即可)
解析:(1)由图1可知,该原电池中Zn作负极,Cu作正极,溶液中的在正极得到电子生成Cu,故溶液起传导离子、作正极反应物的作用。
(2)由图2可知,Zn为负极,Cu为正极,故B溶液应为硫酸铜溶液,A溶液应为硫酸锌溶液;盐桥属于离子导体:原电池中阴离子向负极移动,Zn为负极,故向A溶液移动。
(3)由图4可知,电子从左边电极经外电路流向右边电极,则左边电极为负极,右边电极为正极,根据题意可知,需要增大电压和电流,故可选取电极材料Mg和石墨,阳离子向正极移动,优化后的实验装置示意图可以为
。
同课章节目录
- 第1章 化学反应与能量转化
- 第1节 化学反应的热效应
- 第2节 化学能转化为电能——电池
- 第3节 电能转化为化学能——电解
- 第4节 金属的腐蚀与防护
- 微项目 设计载人航天器用化学电池与氧气再生方案——化学反应中能量及物质的转化利用
- 第2章 化学反应的方向、 限度与速率
- 第1节 化学反应的方向
- 第2节 化学反应的限度
- 第3节 化学反应的速率
- 第4节 化学反应条件的优化——工业合成氨
- 微项目 探讨如何利用工业废气中的二氧化碳合成甲醇——化学反应选择与反应条件优化
- 第3章 物质在水溶液中的行为
- 第1节 水与水溶液
- 第2节 弱电解质的电离 盐类的水解
- 第3节 沉淀溶解平衡
- 第4节 离子反应
- 微项目 揭秘索尔维制碱法和侯氏制碱法——化学平衡思想的创造性应用
