1.1.1反应热 焓变——高一化学人教版(2019)选择性必修一同步课时作业(含解析)
文档属性
| 名称 | 1.1.1反应热 焓变——高一化学人教版(2019)选择性必修一同步课时作业(含解析) |  | |
| 格式 | docx | ||
| 文件大小 | 494.5KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2025-07-03 09:09:54 | ||
图片预览


文档简介
1.1.1反应热 焓变——高一化学人教版(2019)选择性必修一同步课时作业
1.下列叙述不正确的是( )
A.物质发生化学变化一定会伴有能量的变化
B.可逆反应的表示完全反应时的热量变化,与反应是否可逆无关
C.同温同压下,反应在光照和点燃条件下的ΔH相同
D.水蒸气变为液态水时放出的能量就是该变化的反应热
2.下列反应属于氧化还原反应,又符合的是( )
A.与HCl的反应 B.灼热的炭与反应
C.铝片与稀反应 D.甲烷在中的燃烧反应
3.能表示反应的示意图是( )
A. B.
C. D.
4.关于能量的说法正确的是( )
A.水变成水蒸气时吸收的能量就是该过程的反应热
B.可逆反应的与反应进行的程度有关
C.放热反应在任何条件下都可以发生,吸热反应不加热就不能发生
D.等压条件下进行的化学反应的反应热等于反应的焓变
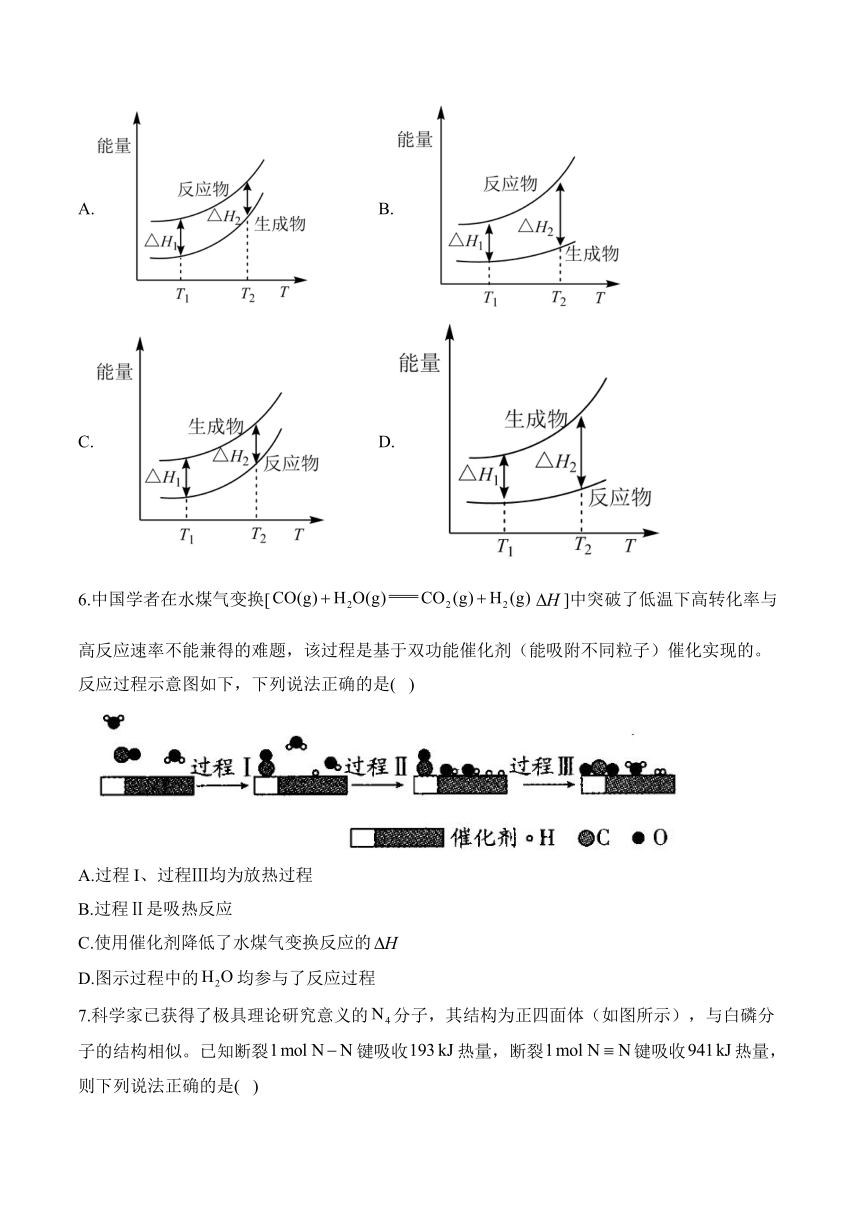
5.在298.15K、100kPa条件下,,和的比热容分别为29.1、28.9和。一定压强下,1mol反应中,反应物、生成物的能量随温度T的变化示意图合理的是( )
A. B.
C. D.
6.中国学者在水煤气变换[]中突破了低温下高转化率与高反应速率不能兼得的难题,该过程是基于双功能催化剂(能吸附不同粒子)催化实现的。反应过程示意图如下,下列说法正确的是( )
A.过程I、过程Ⅲ均为放热过程
B.过程Ⅱ是吸热反应
C.使用催化剂降低了水煤气变换反应的
D.图示过程中的均参与了反应过程
7.科学家已获得了极具理论研究意义的分子,其结构为正四面体(如图所示),与白磷分子的结构相似。已知断裂键吸收热量,断裂键吸收热量,则下列说法正确的是( )
A.比更稳定
B.转化为反应的
C.转化为时要吸收的能量
D.转化为反应的
8.生产液晶显示器的过程中使用的化学清洗剂是一种温室气体,其存储能量的能力是的倍,在大气中的寿命可长达740年之久,以下是几种化学键的键能:
化学键 F-F N-F
键能 941.7 154.8 283.0
下列说法中不正确的是( )
A.过程吸收能量
B.过程放出能量
C.反应的
D.吸收能量后如果没有化学键的断裂与生成,仍可能发生化学反应
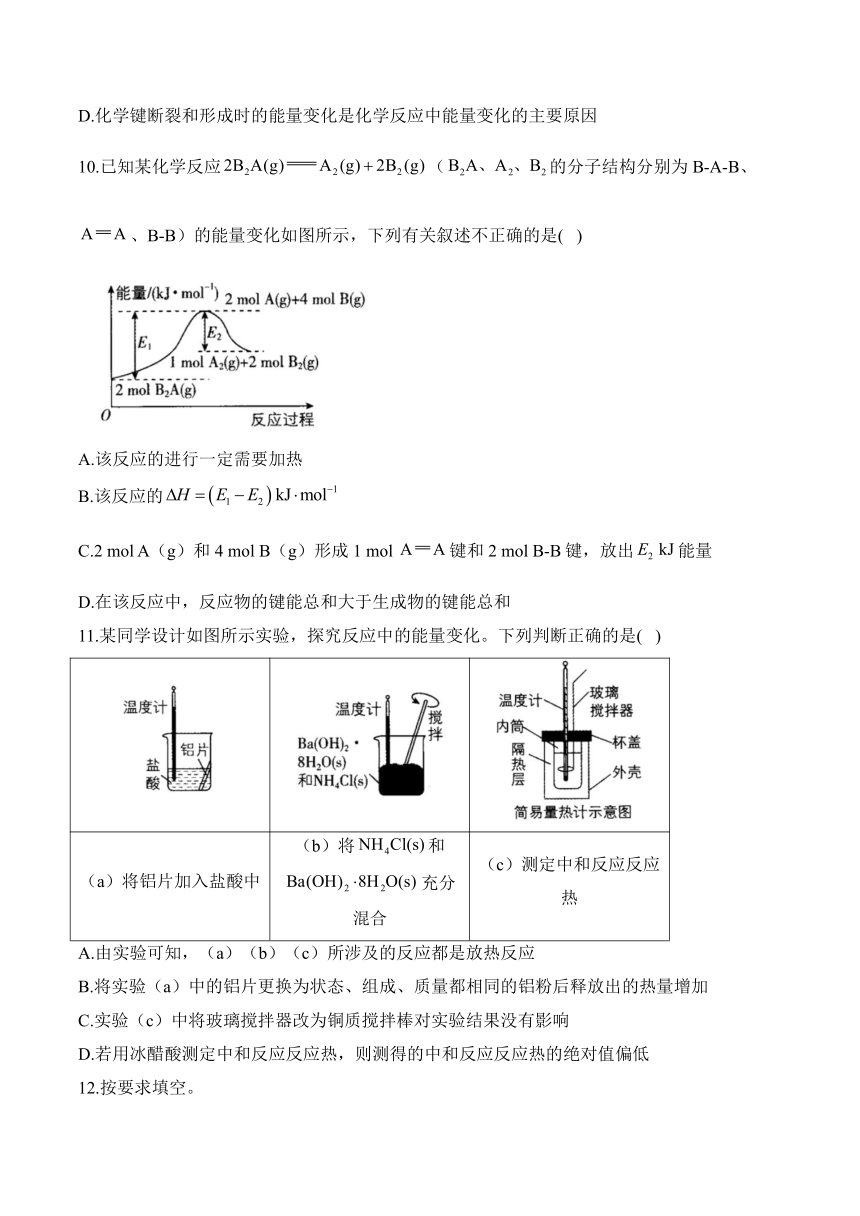
9.25 ℃和101 kPa下,反应的能量变化如图所示。下列有关说法不正确的是( )
A.断裂1 mol H-H键需要吸收436 kJ的能量
B.2 mol Cl的能量高于1 mol 的能量
C.1 mol 与1 mol 反应生成2 mol HCl的反应热
D.化学键断裂和形成时的能量变化是化学反应中能量变化的主要原因
10.已知某化学反应(的分子结构分别为B-A-B、、B-B)的能量变化如图所示,下列有关叙述不正确的是( )
A.该反应的进行一定需要加热
B.该反应的
C.2 mol A(g)和4 mol B(g)形成1 mol 键和2 mol B-B键,放出能量
D.在该反应中,反应物的键能总和大于生成物的键能总和
11.某同学设计如图所示实验,探究反应中的能量变化。下列判断正确的是( )
(a)将铝片加入盐酸中 (b)将和充分混合 (c)测定中和反应反应热
A.由实验可知,(a)(b)(c)所涉及的反应都是放热反应
B.将实验(a)中的铝片更换为状态、组成、质量都相同的铝粉后释放出的热量增加
C.实验(c)中将玻璃搅拌器改为铜质搅拌棒对实验结果没有影响
D.若用冰醋酸测定中和反应反应热,则测得的中和反应反应热的绝对值偏低
12.按要求填空。
(1)某化学兴趣小组的同学进行了如图所示的实验来探究复分解反应的热效应。在一个小烧杯中加入晶体,将小烧杯放在事先已滴有4~5滴水的玻璃片上,然后向小烧杯中加入晶体,并用玻璃棒迅速搅拌。稍后用手拿起烧杯时,发现玻璃片与烧杯黏结在一起。
①实验中玻璃棒的作用是________,所发生反应的化学方程式是________。
②若用手触摸烧杯外壁,将会有________的感觉,说明该反应是
反应,反应热________(填“>”“<”或“=”)0。由该实验能否得出复分解反应就是吸热反应或放热反应的结论?________(填“能”或“不能”),原因是________。
(2)如图所示,某反应在不同条件下的反应历程分别为a、b。
①根据图像可判断出反应物的总键能_______(填“>”“<”或“=”,下同)生成物的总键能,则该反应的反应热_______0。
②其中反应历程b采用的条件为_______(填字母)。
A.升高温度
B.增大反应物的浓度
C.增大压强
D.使用催化剂
答案以及解析
1.答案:D
解析:A.物质发生化学变化时有新物质生成,一定会伴有能量的变化,故A正确;
B.可逆反应的表示完全反应时的热量变化,与加入反应物的多少无关,与反应是否可逆无关,故B正确;
C.与物质的状态和方程式的书写形式有关,与反应条件无关,则反应在光照和点燃条件下的相同,故C正确;
D.水蒸气变为液态水属于物理变化,只有化学反应才有反应热,则水蒸气变为液态水时放出的能量不是反应热,故D错误;故选:D。
2.答案:B
解析:A.与HCl的反应,无化合价的改烃,且属于放热反应,A错误;
B.灼热的炭与反应,有化合价的变化,属于氧化还原反应,且属于吸热反应,B正确;
C.铝片与稀反应,有化合价的变化,属于氧化还原反应,且属于放热反应,C错误;
D.甲烷在中的燃烧反应,有化合价的变化,属于氧化还原反应,且属于放热反应,D错误;
故选B。
3.答案:A
解析:为甲烷的燃烧反应,为放热反应,反应物的焓大于生成物的焓,故选A;
4.答案:D
解析:A.液态水变为水蒸气属于物理变化,而反应热是化学变化中的热效应,A错误;
B.表示完全反应时的热量变化,与反应过程、是否是可逆反应无关,与反应进行的程度无关,B错误;
C.有些放热反应需要在一定条件下才能发生,如铝热反应是放热反应,但在高温条件下才能进行,有些吸热反应不需要加热也能进行,如与反应,C错误;
D.在等压条件下进行的化学反应,其反应热等于反应的焓变,D正确;
故答案为:D。
5.答案:B
解析:该反应为放热反应,反应物的总能量大于生成物的总能量,根据题目中给出的反应物与生成物的比热容可知,升高温度反应物能量升高较快,反应结束后反应放出的热量也会增大,比较4个图像B符合题意,故答案选B。
6.答案:D
解析:过程Ⅰ为水分子中的化学键断裂的过程,为吸热过程,过程I形成化学键,为放热过程,A错误;过程Ⅱ也是水分子中的化学键断裂的过程,为吸热过程,不是吸热反应,B错误;催化剂不能改变反应的始态和终态,不能改变反应的焓变,C错误:根据反应过程示意图,过程Ⅰ中水分子中的化学键断裂,过程Ⅱ也是水分子中的化学键断裂的过程,过程Ⅲ中形成了水分子,因此均参与了反应过程,D正确。
7.答案:D
解析:从图中可以看出,一个分子中含有6个键,根据可知,反应的,为放热反应,每转化为要释放的能量,的能量比高,所以比稳定,D正确。
8.答案:D解析:断键吸热,A正确;成键放热,B正确;反应的,C正确;化学反应过程中一定有化学键的断裂与生成,D错误。
9.答案:C
解析:根据题图知,断裂1 mol H-H键需要吸收436 kJ的能量,故A正确:断裂1 mol Cl-Cl键可生成2 mol Cl,需要吸收243 kJ的能量,所以2 mol Cl的能量高于1 mol 的能量,故B正确;1 mol 与1 mol 反应生成2 mol HCl的反应热,故C错误;化学键断裂吸收能量、化学键形成放出能量,吸收的能量和放出的能量不相等,化学键断裂和形成时的能量变化是化学反应中能量变化的主要原因,故D正确。
10.答案:A
解析:由题图可知,反应物的总能量小于生成物的总能量,该反应为吸热反应,但吸热反应不一定需要加热,如氢氧化钡晶体与氯化铵的反应,故A错误;该反应的反应物分子断键吸收的总能量-生成物分子成键释放的总能量,故B正确;根据题图可知,2 mol A(g)和4 mol B(g)形成1 mol 键和2 mol B-B键,放出能量,故C正确;反应物的键能总和-生成物的键能总和,该反应为吸热反应,,则在该反应中,反应物的键能总和大于生成物的键能总和,故D正确。
11.答案:D
解析:氢氧化钡晶体与氯化铵晶体的反应属于吸热反应,A项错误:铝粉和铝片是同一种物质,等质量的铝粉和铝片分别与等量的盐酸反应,放出的热量相同,只是铝粉参与反应时,反应速率较快,B项错误;相较于玻璃搅拌器,铜质搅拌棒导热快,会造成热量损失,对实验结果有影响,C项错误;冰醋酸是弱酸,电离时醋酸分子中共价键断裂需要吸收热量,使最终测得的中和反应反应热的绝对值偏低,D项正确。
12.答案:(1)①使反应物充分接触并加快反应速率;;②冰凉;吸热;>;不能;只进行了一个复分解反应的实验,不能科学地得出结论
(2)①<;<;②D
解析:(2)①=反应物的总键能-生成物的总键能,由图可知,该反应为放热反应,<0,则反应物的总键能小于生成物的总键能。②由图可知,反应历程b与a相比,改变了反应历程,但最后达到相同的平衡状态,故改变的条件应是使用催化剂,D正确。
1.下列叙述不正确的是( )
A.物质发生化学变化一定会伴有能量的变化
B.可逆反应的表示完全反应时的热量变化,与反应是否可逆无关
C.同温同压下,反应在光照和点燃条件下的ΔH相同
D.水蒸气变为液态水时放出的能量就是该变化的反应热
2.下列反应属于氧化还原反应,又符合的是( )
A.与HCl的反应 B.灼热的炭与反应
C.铝片与稀反应 D.甲烷在中的燃烧反应
3.能表示反应的示意图是( )
A. B.
C. D.
4.关于能量的说法正确的是( )
A.水变成水蒸气时吸收的能量就是该过程的反应热
B.可逆反应的与反应进行的程度有关
C.放热反应在任何条件下都可以发生,吸热反应不加热就不能发生
D.等压条件下进行的化学反应的反应热等于反应的焓变
5.在298.15K、100kPa条件下,,和的比热容分别为29.1、28.9和。一定压强下,1mol反应中,反应物、生成物的能量随温度T的变化示意图合理的是( )
A. B.
C. D.
6.中国学者在水煤气变换[]中突破了低温下高转化率与高反应速率不能兼得的难题,该过程是基于双功能催化剂(能吸附不同粒子)催化实现的。反应过程示意图如下,下列说法正确的是( )
A.过程I、过程Ⅲ均为放热过程
B.过程Ⅱ是吸热反应
C.使用催化剂降低了水煤气变换反应的
D.图示过程中的均参与了反应过程
7.科学家已获得了极具理论研究意义的分子,其结构为正四面体(如图所示),与白磷分子的结构相似。已知断裂键吸收热量,断裂键吸收热量,则下列说法正确的是( )
A.比更稳定
B.转化为反应的
C.转化为时要吸收的能量
D.转化为反应的
8.生产液晶显示器的过程中使用的化学清洗剂是一种温室气体,其存储能量的能力是的倍,在大气中的寿命可长达740年之久,以下是几种化学键的键能:
化学键 F-F N-F
键能 941.7 154.8 283.0
下列说法中不正确的是( )
A.过程吸收能量
B.过程放出能量
C.反应的
D.吸收能量后如果没有化学键的断裂与生成,仍可能发生化学反应
9.25 ℃和101 kPa下,反应的能量变化如图所示。下列有关说法不正确的是( )
A.断裂1 mol H-H键需要吸收436 kJ的能量
B.2 mol Cl的能量高于1 mol 的能量
C.1 mol 与1 mol 反应生成2 mol HCl的反应热
D.化学键断裂和形成时的能量变化是化学反应中能量变化的主要原因
10.已知某化学反应(的分子结构分别为B-A-B、、B-B)的能量变化如图所示,下列有关叙述不正确的是( )
A.该反应的进行一定需要加热
B.该反应的
C.2 mol A(g)和4 mol B(g)形成1 mol 键和2 mol B-B键,放出能量
D.在该反应中,反应物的键能总和大于生成物的键能总和
11.某同学设计如图所示实验,探究反应中的能量变化。下列判断正确的是( )
(a)将铝片加入盐酸中 (b)将和充分混合 (c)测定中和反应反应热
A.由实验可知,(a)(b)(c)所涉及的反应都是放热反应
B.将实验(a)中的铝片更换为状态、组成、质量都相同的铝粉后释放出的热量增加
C.实验(c)中将玻璃搅拌器改为铜质搅拌棒对实验结果没有影响
D.若用冰醋酸测定中和反应反应热,则测得的中和反应反应热的绝对值偏低
12.按要求填空。
(1)某化学兴趣小组的同学进行了如图所示的实验来探究复分解反应的热效应。在一个小烧杯中加入晶体,将小烧杯放在事先已滴有4~5滴水的玻璃片上,然后向小烧杯中加入晶体,并用玻璃棒迅速搅拌。稍后用手拿起烧杯时,发现玻璃片与烧杯黏结在一起。
①实验中玻璃棒的作用是________,所发生反应的化学方程式是________。
②若用手触摸烧杯外壁,将会有________的感觉,说明该反应是
反应,反应热________(填“>”“<”或“=”)0。由该实验能否得出复分解反应就是吸热反应或放热反应的结论?________(填“能”或“不能”),原因是________。
(2)如图所示,某反应在不同条件下的反应历程分别为a、b。
①根据图像可判断出反应物的总键能_______(填“>”“<”或“=”,下同)生成物的总键能,则该反应的反应热_______0。
②其中反应历程b采用的条件为_______(填字母)。
A.升高温度
B.增大反应物的浓度
C.增大压强
D.使用催化剂
答案以及解析
1.答案:D
解析:A.物质发生化学变化时有新物质生成,一定会伴有能量的变化,故A正确;
B.可逆反应的表示完全反应时的热量变化,与加入反应物的多少无关,与反应是否可逆无关,故B正确;
C.与物质的状态和方程式的书写形式有关,与反应条件无关,则反应在光照和点燃条件下的相同,故C正确;
D.水蒸气变为液态水属于物理变化,只有化学反应才有反应热,则水蒸气变为液态水时放出的能量不是反应热,故D错误;故选:D。
2.答案:B
解析:A.与HCl的反应,无化合价的改烃,且属于放热反应,A错误;
B.灼热的炭与反应,有化合价的变化,属于氧化还原反应,且属于吸热反应,B正确;
C.铝片与稀反应,有化合价的变化,属于氧化还原反应,且属于放热反应,C错误;
D.甲烷在中的燃烧反应,有化合价的变化,属于氧化还原反应,且属于放热反应,D错误;
故选B。
3.答案:A
解析:为甲烷的燃烧反应,为放热反应,反应物的焓大于生成物的焓,故选A;
4.答案:D
解析:A.液态水变为水蒸气属于物理变化,而反应热是化学变化中的热效应,A错误;
B.表示完全反应时的热量变化,与反应过程、是否是可逆反应无关,与反应进行的程度无关,B错误;
C.有些放热反应需要在一定条件下才能发生,如铝热反应是放热反应,但在高温条件下才能进行,有些吸热反应不需要加热也能进行,如与反应,C错误;
D.在等压条件下进行的化学反应,其反应热等于反应的焓变,D正确;
故答案为:D。
5.答案:B
解析:该反应为放热反应,反应物的总能量大于生成物的总能量,根据题目中给出的反应物与生成物的比热容可知,升高温度反应物能量升高较快,反应结束后反应放出的热量也会增大,比较4个图像B符合题意,故答案选B。
6.答案:D
解析:过程Ⅰ为水分子中的化学键断裂的过程,为吸热过程,过程I形成化学键,为放热过程,A错误;过程Ⅱ也是水分子中的化学键断裂的过程,为吸热过程,不是吸热反应,B错误;催化剂不能改变反应的始态和终态,不能改变反应的焓变,C错误:根据反应过程示意图,过程Ⅰ中水分子中的化学键断裂,过程Ⅱ也是水分子中的化学键断裂的过程,过程Ⅲ中形成了水分子,因此均参与了反应过程,D正确。
7.答案:D
解析:从图中可以看出,一个分子中含有6个键,根据可知,反应的,为放热反应,每转化为要释放的能量,的能量比高,所以比稳定,D正确。
8.答案:D解析:断键吸热,A正确;成键放热,B正确;反应的,C正确;化学反应过程中一定有化学键的断裂与生成,D错误。
9.答案:C
解析:根据题图知,断裂1 mol H-H键需要吸收436 kJ的能量,故A正确:断裂1 mol Cl-Cl键可生成2 mol Cl,需要吸收243 kJ的能量,所以2 mol Cl的能量高于1 mol 的能量,故B正确;1 mol 与1 mol 反应生成2 mol HCl的反应热,故C错误;化学键断裂吸收能量、化学键形成放出能量,吸收的能量和放出的能量不相等,化学键断裂和形成时的能量变化是化学反应中能量变化的主要原因,故D正确。
10.答案:A
解析:由题图可知,反应物的总能量小于生成物的总能量,该反应为吸热反应,但吸热反应不一定需要加热,如氢氧化钡晶体与氯化铵的反应,故A错误;该反应的反应物分子断键吸收的总能量-生成物分子成键释放的总能量,故B正确;根据题图可知,2 mol A(g)和4 mol B(g)形成1 mol 键和2 mol B-B键,放出能量,故C正确;反应物的键能总和-生成物的键能总和,该反应为吸热反应,,则在该反应中,反应物的键能总和大于生成物的键能总和,故D正确。
11.答案:D
解析:氢氧化钡晶体与氯化铵晶体的反应属于吸热反应,A项错误:铝粉和铝片是同一种物质,等质量的铝粉和铝片分别与等量的盐酸反应,放出的热量相同,只是铝粉参与反应时,反应速率较快,B项错误;相较于玻璃搅拌器,铜质搅拌棒导热快,会造成热量损失,对实验结果有影响,C项错误;冰醋酸是弱酸,电离时醋酸分子中共价键断裂需要吸收热量,使最终测得的中和反应反应热的绝对值偏低,D项正确。
12.答案:(1)①使反应物充分接触并加快反应速率;;②冰凉;吸热;>;不能;只进行了一个复分解反应的实验,不能科学地得出结论
(2)①<;<;②D
解析:(2)①=反应物的总键能-生成物的总键能,由图可知,该反应为放热反应,<0,则反应物的总键能小于生成物的总键能。②由图可知,反应历程b与a相比,改变了反应历程,但最后达到相同的平衡状态,故改变的条件应是使用催化剂,D正确。
