1.1.3能源的充分利用——高一化学苏教版(2019)选择性必修一同步课时作业(含解析)
文档属性
| 名称 | 1.1.3能源的充分利用——高一化学苏教版(2019)选择性必修一同步课时作业(含解析) |  | |
| 格式 | docx | ||
| 文件大小 | 546.5KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 苏教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2025-07-03 09:10:38 | ||
图片预览



文档简介
1.1.3能源的充分利用——高一化学苏教版(2019)选择性必修一同步课时作业
1.下列各组物质的燃烧热相等的是( )
A.碳和一氧化碳 B.葡萄糖和麦芽糖
C.1mol和3mol D.3mol和1mol
2.下列说法中错误的是( )
A.燃料的燃烧都是放热反应
B.一定量的燃料完全燃烧放出的热比不完全燃烧放出的热多
C.清洁燃料的首要条件是燃烧不会产生对环境有害的污染物
D.选择燃料只需考虑燃料热值的大小
3.以下几个热化学方程式中能表示燃烧热的是( )
A.
B.
C.
D.
4.25℃、101kPa下充分燃烧一定量丁烷气体放出的热量为xQ kJ,用5mol/L的KOH溶液100mL完全吸收生成的,并与之生成正盐,则丁烷的燃烧热的数值是( )
A.16xQ B.8xQ C.4xQ D.2xQ
5.下列热化学方程式正确的是(的绝对值均正确)( )
A.(反应热)
B.(燃烧热)
C.(中和热)
D.C(金刚石、s)(石墨、s)(反应热)(已知石墨比金刚石稳定)
6.已知①;
②;
③。下列说法不正确的是( )
A.C的燃烧热
B.2g完全燃烧生成液态水放出的热量为241.8kJ
C.反应的反应热为
D.反应在高温下才能自发
7.已知:
;
;
。
下列说法正确的是( )
A.S的燃烧热为
B.S的燃烧热为
C.a<324
D.密闭容器中充入和充分反应,放热198kJ
8.下列能够表示物质燃烧热的热化学方程式的是(的绝对值均正确) ( )
A.
B.
C.
D.
9.在25℃和101kPa时,几种燃料的燃烧热如下表:
燃料
-283.0 -285.8 -890.3 -726.5
下列说法正确的是( )
A.相同质量的上述四种燃料完全燃烧时,甲烷放出的热量最多
B.CO燃烧的热化学方程式为:
C.常温常压下,1mol甲醇液体完全燃烧生成气体和水蒸气放出热量726.5kJ
D.标准状况下,相同体积的CO、、完全燃烧的碳排放量:
10.在无氧环境下,经催化脱氢芳构化可以直接转化为高附加值的芳烃产品。一定温度下,芳构化时同时存在如下反应:
ⅰ.
ⅱ.
已知25℃时有关物质的燃烧热数据如表。
物质
a b c
下列说法不正确的是( )
A.受反应i影响,随着反应进行,单位时间内甲烷转化率和芳烃产率逐渐降低
B.反应ⅱ的
C.反应ⅰ在1000K时能自发进行
D.分离产物,可提高在混合气体中的体积分数
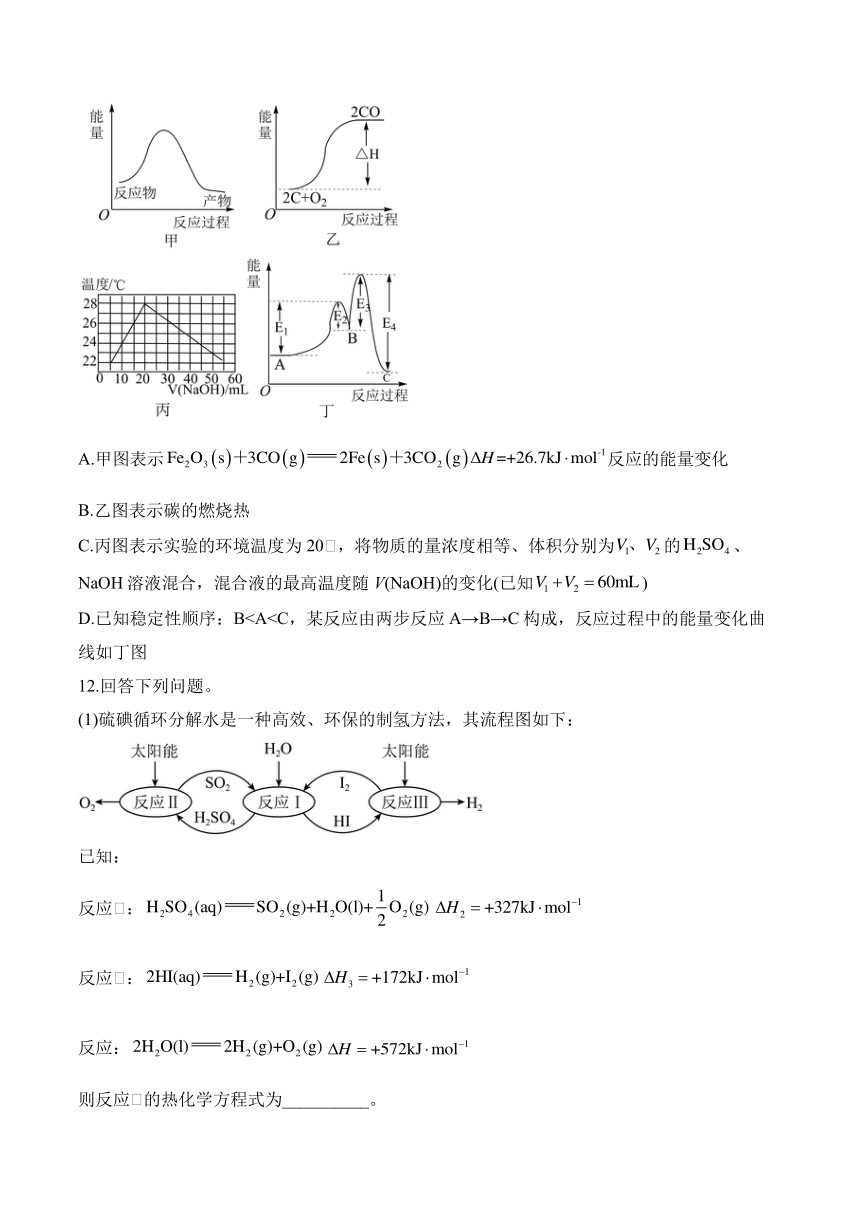
11.下列示意图表示正确的是( )
A.甲图表示反应的能量变化
B.乙图表示碳的燃烧热
C.丙图表示实验的环境温度为20℃,将物质的量浓度相等、体积分别为的、NaOH溶液混合,混合液的最高温度随V(NaOH)的变化(已知)
D.已知稳定性顺序:B12.回答下列问题。
(1)硫碘循环分解水是一种高效、环保的制氢方法,其流程图如下:
已知:
反应Ⅱ:
反应Ⅲ:
反应:
则反应Ⅰ的热化学方程式为__________。
(2)已知:;。
①则氢气的燃烧热__________。
②计算__________。
③计算氢气完全燃烧生成气态水时放出__________的热量。
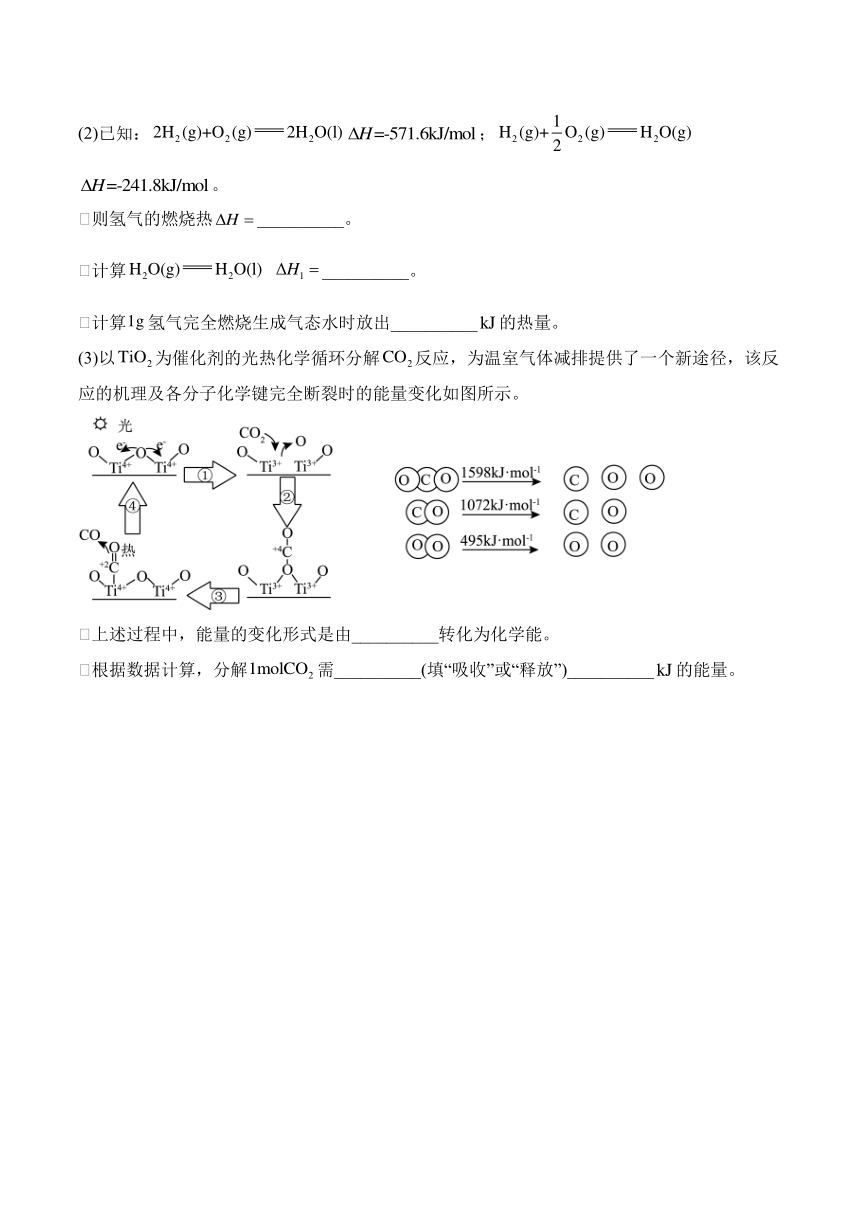
(3)以为催化剂的光热化学循环分解反应,为温室气体减排提供了一个新途径,该反应的机理及各分子化学键完全断裂时的能量变化如图所示。
①上述过程中,能量的变化形式是由__________转化为化学能。
②根据数据计算,分解需__________(填“吸收”或“释放”)__________的能量。
答案以及解析
1.答案:C
解析:A.碳和一氧化碳是不同的物质,物质不同,具有不同的能量,燃烧热也不相等,故A错误;
B.葡萄糖是单糖,麦芽糖是二糖,它们是不同的物质,物质不同,具有不同的能量,燃烧热不相等,故B错误;
C.燃烧热是物质的性质,与量的多少无关,可燃物相同,该组物质的燃烧热相等,故C正确;
D.和是不同的物质,物质不同,具有不同的能量,燃烧热不相等,故D错误;
故选C。
2.答案:D
解析:除了热值,还需要考虑制备,存储,运输,开采成本等方面诸多问题,D项错误。
3.答案:B
解析:1mol可燃物在氧气中完全燃烧生成稳定的氧化物时,放出的热量为该物质的燃烧热。一般情况下,水为液态,二氧化碳为气态。
A. C(s)燃烧未生成稳定氧化物,故其反应热不能表示燃烧热,A错误;
B.符合燃烧热的定义,B正确;
C.虽然转变成了稳定的氧化物,但由于其反应热表示的是完全燃烧时的热量变化,故不能表示燃烧热,C错误;
D.参加燃烧的虽然是1mol,但其生成,而不是,故它的反应热不能表示的燃烧热,D错误;
故选B。
4.答案:A
解析:,则由可知,,则,放出的热量为x QkJ,所以1mol丁烷完全燃烧放出的热量为16xQkJ,故选A。
5.答案:C
解析:A.热化学方程式书写时需注明各物质所处的状态,故原热化学方程式错误,A错误;
B.燃烧热是指1mol纯物质完全燃烧生成指定稳定的物质时放出的热量,水是液态水,故不是表示燃烧热,B错误;
C.中和热是指强酸和强碱稀溶液反应生成1mol时放出的热量,故表示中和热,C正确;
D.已知石墨比金刚石稳定,即石墨具有的总能量比金刚石低,故金刚石转化为石墨是一个放热反应,即C(金刚石、s)(石墨、s),D错误;
故答案为:C。
6.答案:B
解析:A.根据反应③可知,C的燃烧热,A正确;
B.根据反应①2g完全燃烧生成气态水放出的热量为241.8kJ,B错误;
C.根据盖斯定律①+②-③得到目标反应,,C正确;
D.,是吸热反应,,则需要高温才可自发,D正确;
故选B。
7.答案:C
解析:A.常温下S为固体,充分反应生成,S的燃烧热为,是气态硫燃烧放出的热,A项错误;
B.常温下S为固体,充分反应生成,S的燃烧热为,B项错误;
C.,故a<324,C项正确;
D.该反应为可逆反应,加入的和不可能完全转化为,放热小于198kJ,D项错误;
答案选C。
8.答案:C
解析:在101kPa时,1mol纯物质完全燃烧生成指定产物(稳定的物质)所放出的热量叫做燃烧热。
A.生成的水为液态时是稳定的,A中生成的是气态,不符合要求,A错误;
B.碳完全燃烧生成稳定的氧化物为二氧化碳,B中生成的CO可继续燃烧生成,不符合要求,B错误;
C.,满足“1mol”的要求,生成的二氧化硫是稳定的氧化物,符合要求,C正确;
D.生成的二氧化硫是稳定的氧化物,D中生成的S也可继续燃烧生成SO2,不符合要求,D错误;
故选C。
9.答案:D
解析:A.的相对分子质量分别为28、2、16、32,又因为它们每1mol分别完全燃烧时,放出的热量依次为283.0kJ、285.8kJ、890.3kJ、726.5kJ,所以完全燃烧时,放出热量分别为:10.0kJ、142.9kJ、55.6kJ、22.7kJ,则相同质量的以上四种燃料,完全燃烧时放出热量最多的是,A错误;
B.CO燃烧热为,表示1molCO完全燃烧释放283.0kJ热量,则CO燃烧的热化学方程式为:,B错误;
C.甲醇燃烧热的数据指的是1mol甲醇完全燃烧生成和液态水时释放热量726.5kJ,若生成气态水,释放的热量小于726.5kJ,C错误;
D.标准状况下,相同体积的物质的量相同,根据C元素守恒,完全燃烧的碳排放量:,D正确;
10.答案:D
解析:A.反应ⅰ有积炭生成,随着反应的进行,生成的积炭越多,覆盖在催化剂表面,使催化剂性能逐渐降低,化学反应速率逐渐减小,所以单位时间内甲烷转化率和芳烃产率逐渐降低,A正确;
B.由题中所给数据可得以下热化学方程式:③,④,⑤,根据盖斯定律,将反应得反应ⅱ的,B正确;
C.在1000K时,,故反应ⅰ在1000K时能自发进行,C正确;
D.苯为液体,分离出部分苯,其浓度不变,平衡不移动,在混合气体中的体积分数不变,D错误;
11.答案:D
解析:A.图中反应物总能量高于生成物总能量,为放热反应,反应为吸热反应,与图示不符,选项A错误;
B.C的燃烧热是指1molC完全燃烧生成(g)时的焓变,且反应物的总能量高于生成物的总能量,选项B错误;
C.、NaOH溶液的物质的量浓度相等,当二者体积比为1∶2时,二者恰好完全反应,放出的热量最多,混合液温度最高,此时溶液为20mL,NaOH溶液为40mL,选项C错误;
D.稳定性BA>C,故A→B为吸热反应,B→C为放热反应,A→C为放热反应,选项D正确;
12.答案:(1)
(2)-285.8kJ/mol;;120.9
(3)光能和热能;吸收;278.5
解析:(1)已知:
反应Ⅱ:
反应Ⅲ:
反应①:
由流程图信息可知,反应Ⅰ为,利用盖斯定律,将反应[①-反应Ⅱ×2-反应Ⅲ×2]×得反应Ⅰ的热化学方程式为:;
(2)①燃烧热是在101kPa时,1mol纯物质完全燃烧生成指定产物时所放出的热量;已知:,则表示氢气的燃烧热的热化学方程式为,即燃烧热;
②已知:Ⅰ
Ⅱ
×Ⅰ-Ⅱ得;
③,则1g氢气完全燃烧生成气态水时热量变化为,故放出的热量。
(3)①该图中以为催化剂、光和热条件下分解反应生成CO和,根据能量守恒定律知,该反应中,光能和热能转化为化学能;
②根据反应=反应物的总键能-生成物的总键能,分解反应的热化学方程式为,反应焓变为=1598kJ/mol×2-1072kJ/mol×2-495kJ/mol×1=+557kJ/mol,故1mol需吸收278.5kJ热量。
1.下列各组物质的燃烧热相等的是( )
A.碳和一氧化碳 B.葡萄糖和麦芽糖
C.1mol和3mol D.3mol和1mol
2.下列说法中错误的是( )
A.燃料的燃烧都是放热反应
B.一定量的燃料完全燃烧放出的热比不完全燃烧放出的热多
C.清洁燃料的首要条件是燃烧不会产生对环境有害的污染物
D.选择燃料只需考虑燃料热值的大小
3.以下几个热化学方程式中能表示燃烧热的是( )
A.
B.
C.
D.
4.25℃、101kPa下充分燃烧一定量丁烷气体放出的热量为xQ kJ,用5mol/L的KOH溶液100mL完全吸收生成的,并与之生成正盐,则丁烷的燃烧热的数值是( )
A.16xQ B.8xQ C.4xQ D.2xQ
5.下列热化学方程式正确的是(的绝对值均正确)( )
A.(反应热)
B.(燃烧热)
C.(中和热)
D.C(金刚石、s)(石墨、s)(反应热)(已知石墨比金刚石稳定)
6.已知①;
②;
③。下列说法不正确的是( )
A.C的燃烧热
B.2g完全燃烧生成液态水放出的热量为241.8kJ
C.反应的反应热为
D.反应在高温下才能自发
7.已知:
;
;
。
下列说法正确的是( )
A.S的燃烧热为
B.S的燃烧热为
C.a<324
D.密闭容器中充入和充分反应,放热198kJ
8.下列能够表示物质燃烧热的热化学方程式的是(的绝对值均正确) ( )
A.
B.
C.
D.
9.在25℃和101kPa时,几种燃料的燃烧热如下表:
燃料
-283.0 -285.8 -890.3 -726.5
下列说法正确的是( )
A.相同质量的上述四种燃料完全燃烧时,甲烷放出的热量最多
B.CO燃烧的热化学方程式为:
C.常温常压下,1mol甲醇液体完全燃烧生成气体和水蒸气放出热量726.5kJ
D.标准状况下,相同体积的CO、、完全燃烧的碳排放量:
10.在无氧环境下,经催化脱氢芳构化可以直接转化为高附加值的芳烃产品。一定温度下,芳构化时同时存在如下反应:
ⅰ.
ⅱ.
已知25℃时有关物质的燃烧热数据如表。
物质
a b c
下列说法不正确的是( )
A.受反应i影响,随着反应进行,单位时间内甲烷转化率和芳烃产率逐渐降低
B.反应ⅱ的
C.反应ⅰ在1000K时能自发进行
D.分离产物,可提高在混合气体中的体积分数
11.下列示意图表示正确的是( )
A.甲图表示反应的能量变化
B.乙图表示碳的燃烧热
C.丙图表示实验的环境温度为20℃,将物质的量浓度相等、体积分别为的、NaOH溶液混合,混合液的最高温度随V(NaOH)的变化(已知)
D.已知稳定性顺序:B
(1)硫碘循环分解水是一种高效、环保的制氢方法,其流程图如下:
已知:
反应Ⅱ:
反应Ⅲ:
反应:
则反应Ⅰ的热化学方程式为__________。
(2)已知:;。
①则氢气的燃烧热__________。
②计算__________。
③计算氢气完全燃烧生成气态水时放出__________的热量。
(3)以为催化剂的光热化学循环分解反应,为温室气体减排提供了一个新途径,该反应的机理及各分子化学键完全断裂时的能量变化如图所示。
①上述过程中,能量的变化形式是由__________转化为化学能。
②根据数据计算,分解需__________(填“吸收”或“释放”)__________的能量。
答案以及解析
1.答案:C
解析:A.碳和一氧化碳是不同的物质,物质不同,具有不同的能量,燃烧热也不相等,故A错误;
B.葡萄糖是单糖,麦芽糖是二糖,它们是不同的物质,物质不同,具有不同的能量,燃烧热不相等,故B错误;
C.燃烧热是物质的性质,与量的多少无关,可燃物相同,该组物质的燃烧热相等,故C正确;
D.和是不同的物质,物质不同,具有不同的能量,燃烧热不相等,故D错误;
故选C。
2.答案:D
解析:除了热值,还需要考虑制备,存储,运输,开采成本等方面诸多问题,D项错误。
3.答案:B
解析:1mol可燃物在氧气中完全燃烧生成稳定的氧化物时,放出的热量为该物质的燃烧热。一般情况下,水为液态,二氧化碳为气态。
A. C(s)燃烧未生成稳定氧化物,故其反应热不能表示燃烧热,A错误;
B.符合燃烧热的定义,B正确;
C.虽然转变成了稳定的氧化物,但由于其反应热表示的是完全燃烧时的热量变化,故不能表示燃烧热,C错误;
D.参加燃烧的虽然是1mol,但其生成,而不是,故它的反应热不能表示的燃烧热,D错误;
故选B。
4.答案:A
解析:,则由可知,,则,放出的热量为x QkJ,所以1mol丁烷完全燃烧放出的热量为16xQkJ,故选A。
5.答案:C
解析:A.热化学方程式书写时需注明各物质所处的状态,故原热化学方程式错误,A错误;
B.燃烧热是指1mol纯物质完全燃烧生成指定稳定的物质时放出的热量,水是液态水,故不是表示燃烧热,B错误;
C.中和热是指强酸和强碱稀溶液反应生成1mol时放出的热量,故表示中和热,C正确;
D.已知石墨比金刚石稳定,即石墨具有的总能量比金刚石低,故金刚石转化为石墨是一个放热反应,即C(金刚石、s)(石墨、s),D错误;
故答案为:C。
6.答案:B
解析:A.根据反应③可知,C的燃烧热,A正确;
B.根据反应①2g完全燃烧生成气态水放出的热量为241.8kJ,B错误;
C.根据盖斯定律①+②-③得到目标反应,,C正确;
D.,是吸热反应,,则需要高温才可自发,D正确;
故选B。
7.答案:C
解析:A.常温下S为固体,充分反应生成,S的燃烧热为,是气态硫燃烧放出的热,A项错误;
B.常温下S为固体,充分反应生成,S的燃烧热为,B项错误;
C.,故a<324,C项正确;
D.该反应为可逆反应,加入的和不可能完全转化为,放热小于198kJ,D项错误;
答案选C。
8.答案:C
解析:在101kPa时,1mol纯物质完全燃烧生成指定产物(稳定的物质)所放出的热量叫做燃烧热。
A.生成的水为液态时是稳定的,A中生成的是气态,不符合要求,A错误;
B.碳完全燃烧生成稳定的氧化物为二氧化碳,B中生成的CO可继续燃烧生成,不符合要求,B错误;
C.,满足“1mol”的要求,生成的二氧化硫是稳定的氧化物,符合要求,C正确;
D.生成的二氧化硫是稳定的氧化物,D中生成的S也可继续燃烧生成SO2,不符合要求,D错误;
故选C。
9.答案:D
解析:A.的相对分子质量分别为28、2、16、32,又因为它们每1mol分别完全燃烧时,放出的热量依次为283.0kJ、285.8kJ、890.3kJ、726.5kJ,所以完全燃烧时,放出热量分别为:10.0kJ、142.9kJ、55.6kJ、22.7kJ,则相同质量的以上四种燃料,完全燃烧时放出热量最多的是,A错误;
B.CO燃烧热为,表示1molCO完全燃烧释放283.0kJ热量,则CO燃烧的热化学方程式为:,B错误;
C.甲醇燃烧热的数据指的是1mol甲醇完全燃烧生成和液态水时释放热量726.5kJ,若生成气态水,释放的热量小于726.5kJ,C错误;
D.标准状况下,相同体积的物质的量相同,根据C元素守恒,完全燃烧的碳排放量:,D正确;
10.答案:D
解析:A.反应ⅰ有积炭生成,随着反应的进行,生成的积炭越多,覆盖在催化剂表面,使催化剂性能逐渐降低,化学反应速率逐渐减小,所以单位时间内甲烷转化率和芳烃产率逐渐降低,A正确;
B.由题中所给数据可得以下热化学方程式:③,④,⑤,根据盖斯定律,将反应得反应ⅱ的,B正确;
C.在1000K时,,故反应ⅰ在1000K时能自发进行,C正确;
D.苯为液体,分离出部分苯,其浓度不变,平衡不移动,在混合气体中的体积分数不变,D错误;
11.答案:D
解析:A.图中反应物总能量高于生成物总能量,为放热反应,反应为吸热反应,与图示不符,选项A错误;
B.C的燃烧热是指1molC完全燃烧生成(g)时的焓变,且反应物的总能量高于生成物的总能量,选项B错误;
C.、NaOH溶液的物质的量浓度相等,当二者体积比为1∶2时,二者恰好完全反应,放出的热量最多,混合液温度最高,此时溶液为20mL,NaOH溶液为40mL,选项C错误;
D.稳定性B
12.答案:(1)
(2)-285.8kJ/mol;;120.9
(3)光能和热能;吸收;278.5
解析:(1)已知:
反应Ⅱ:
反应Ⅲ:
反应①:
由流程图信息可知,反应Ⅰ为,利用盖斯定律,将反应[①-反应Ⅱ×2-反应Ⅲ×2]×得反应Ⅰ的热化学方程式为:;
(2)①燃烧热是在101kPa时,1mol纯物质完全燃烧生成指定产物时所放出的热量;已知:,则表示氢气的燃烧热的热化学方程式为,即燃烧热;
②已知:Ⅰ
Ⅱ
×Ⅰ-Ⅱ得;
③,则1g氢气完全燃烧生成气态水时热量变化为,故放出的热量。
(3)①该图中以为催化剂、光和热条件下分解反应生成CO和,根据能量守恒定律知,该反应中,光能和热能转化为化学能;
②根据反应=反应物的总键能-生成物的总键能,分解反应的热化学方程式为,反应焓变为=1598kJ/mol×2-1072kJ/mol×2-495kJ/mol×1=+557kJ/mol,故1mol需吸收278.5kJ热量。
