1.2.1原电池的工作原理——高一化学苏教版(2019)选择性必修一同步课时作业(含解析)
文档属性
| 名称 | 1.2.1原电池的工作原理——高一化学苏教版(2019)选择性必修一同步课时作业(含解析) |  | |
| 格式 | docx | ||
| 文件大小 | 338.0KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 苏教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2025-07-03 09:10:48 | ||
图片预览



文档简介
1.2.1原电池的工作原理——高一化学苏教版(2019)选择性必修一同步课时作业
1.在如图所示的装置中,观察到电流表指针偏转(指针顺着电流方向偏转),M变粗,N变细,由此判断下表中所列M、N、P三种物质,其中可以成立的是( )
选项 M N P
A 锌 铜 稀硫酸
B 铜 铁 稀盐酸
C 银 锌 硝酸银溶液
D 锌 铁 硝酸铁溶液
A.A B.B C.C D.D
2.下列过程不涉及原电池的是( )
A.生铁在潮湿的环境中生锈
B.镀锡的铁片镀层破损后会加速腐蚀
C.纯镁在空气中表面迅速形成致密的氧化膜
D.实验室用铁制备时,向稀硫酸中滴入几滴溶液
3.图1是铜锌原电池示意图。图2中,x轴表示实验时流入正极的电子的物质的量,y轴表示( )
A.锌棒的质量 B. C.pH D.
4.某原电池的总反应的离子方程式为:,能实现该反应的原电池组成是( )
A.正极为铜,负极为铁,电解质溶液为溶液
B.正极为铜,负极为铁,电解质溶液为NaCl溶液
C.正极为铁,负极为铁,电解质溶液为溶液
D.正极为银,负极为铁,电解质溶液为溶液
5.下列有关原电池构成要素的说法错误的是( )
A.一般有一个自发的氧化还原反应 B.必须有离子导体
C.必须有两个活性不同的电极 D.必须形成闭合回路
6.把金属X放入盐的溶液中,发生如下反应:,下列说法正确的是( )
A.常温下金属X一定能与水反应,Y一定不能与水反应
B.X与Y用导线连接后放入中,一定形成原电池
C.X与Y用导线连接后放入同一个盛有溶液的烧杯中,一定有电流产生
D.由X与Y作电极形成的原电池中,X一定是负极,Y一定是正极
7.a、b、c、d四种金属片浸入稀硫酸中,用导线两两组成原电池。若a、b相连时,电流由a经导线流向b;c、d相连时,d极质量减少;a、c相连时,c极上产生大量气泡;a、d相连时,移向a极,则四种金属的活动性顺序由强到弱的顺序为( )
A. B. C. D.
8.有关如图所示原电池(盐桥中装有含琼脂的饱和溶液)的叙述,正确的是( )
A.铜片上有气泡逸出
B.反应中,盐桥中的会移向溶液
C.取出盐桥后,电流计依然发生偏转
D.反应前后铜片质量不改变
9.原电池为电化学建构认识模型奠定了重要的基础,下图装置中的盐桥装有琼脂凝胶,内含氯化钾.下列对于该原电池说法正确的是( )
A.该装置能将化学能完全转化为电能
B.电池工作时,盐桥中的移向溶液
C.电池工作时,导线中电流流向为
D.负极反应为,发生还原反应
10.某合作学习小组的同学设计如图原电池,盐桥中装有含饱和的胶状物,只起导电和平衡电荷的作用。下列叙述中正确的是( )
A.乙烧杯中发生还原反应
B.盐桥中的电解质可换成饱和KCl溶液
C.电子流动方向:石墨(甲)→a→b→石墨(乙)→盐桥→石墨(甲)
D.电池工作一段时间,甲烧杯中酸性减弱
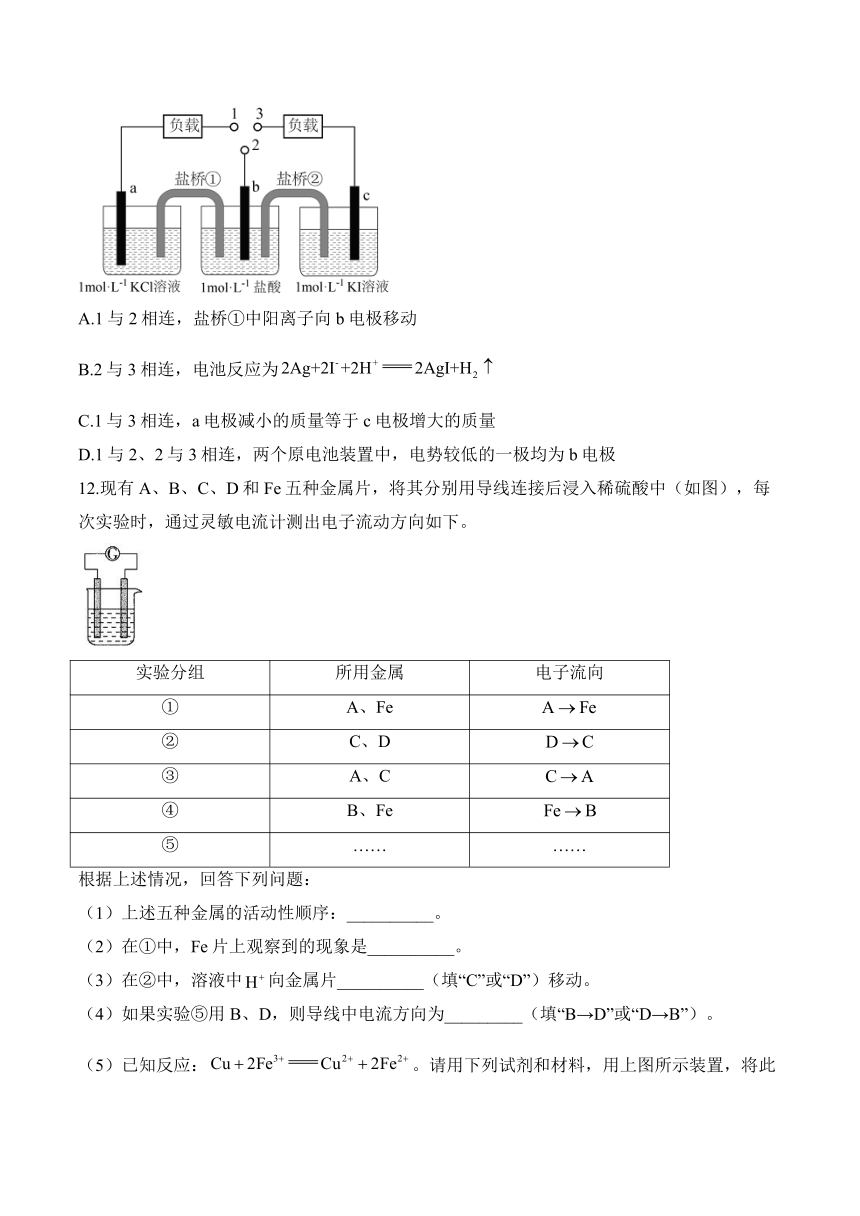
11.如图装置中,b为标准氢电极,可发生还原反应()或氧化反应(),a、c分别为AgCl/Ag、AgI/Ag电极。实验发现:1与2相连a电极质量减小,2与3相连c电极质量增大。下列说法正确的是( )
A.1与2相连,盐桥①中阳离子向b电极移动
B.2与3相连,电池反应为
C.1与3相连,a电极减小的质量等于c电极增大的质量
D.1与2、2与3相连,两个原电池装置中,电势较低的一极均为b电极
12.现有A、B、C、D和Fe五种金属片,将其分别用导线连接后浸入稀硫酸中(如图),每次实验时,通过灵敏电流计测出电子流动方向如下。
实验分组 所用金属 电子流向
① A、Fe
② C、D
③ A、C
④ B、Fe
⑤ …… ……
根据上述情况,回答下列问题:
(1)上述五种金属的活动性顺序:__________。
(2)在①中,Fe片上观察到的现象是__________。
(3)在②中,溶液中向金属片__________(填“C”或“D”)移动。
(4)如果实验⑤用B、D,则导线中电流方向为_________(填“B→D”或“D→B”)。
(5)已知反应:。请用下列试剂和材料,用上图所示装置,将此反应设计成原电池。
试剂:溶液、溶液、溶液、KSCN溶液、溶液、双氧水、NaOH溶液。
材料:Cu片、Fe片、石墨棒。
设计原电池应选用的试剂和材料是__________。
答案以及解析
1.答案:C
解析:A.锌极材料比铜极活泼,A错误;
B.铜极上氢离子被还原生成氢气,铜极质量不增大,B错误;
C.N极材料比M极活泼,且M极上有银析出,所以质量增加,符合题意,C正确;
D.锌极材料比铁极活泼,D错误;
故选C。
2.答案:C
解析:A(×)潮湿环境中,生铁里的铁、碳与水溶液可构成原电池,能加快铁的生锈。
B(×)铁比锡活泼,镀锡的铁片镀层破损后,在潮湿环境中,可构成原电池,铁作负极,腐蚀速率加快。
C(√)纯镁在空气中与氧气反应,使表面生成致密氧化膜,保护内部镁不再反应,与原电池无关。
D(×)实验室用铁和稀硫酸制备时,加入硫酸铜溶液后,铁与铜离子发生置换反应,在铁表面析出铜,使铁、铜与电解质溶液构成原电池,可加快生成氢气的反应速率。
3.答案:A
解析:A.随着流入正极电子物质的量增多,即反应进行,锌棒不断溶解,锌棒质量不断减小,与图2曲线变化相符,A正确;
B.因为,随着流入正极电子物质的量增多,反应生成的增多,应增大,与图2曲线变化不符,B错误;
C.由于正极反应消耗,随着流入正极电子物质的量增多,溶液中减小,pH应增大,与图2曲线变化不符,C错误;
D.不参与原电池反应,其浓度不变,与图2曲线变化不符,D错误;
故选A。
4.答案:A
解析:A.铁作负极,铜作正极,电解质为可溶性的,能实现该反应,故A正确;
B.正极为铜,负极为铁,电解质溶液为NaCl溶液,不能实现该反应,故B错误;
C.正极为铁,负极为铁,不能构成原电池,故C错误;
D.铁作负极,银作正极,电解质为溶液,负极铁失去电子生成二价铁,正极铜离子得到电子生成铜单质,不能实现该反应,故D错误;
故答案选A。
5.答案:C
解析:A.根据原电池构成条件可知,自发进行的氧化还原反应理论上均可设计成原电池,A正确;
B.要形成原电池,必须形成闭合回路,所以必须有电解质溶液或离子导体,B正确;
C.要形成原电池,必须有两个电极,两个电极的活性可以不同,但也可以相同,如燃料电池,C错误;
D.要形成原电池,必须形成闭合回路,电路中才能产生电流,才能对外提供电能,D正确;故答案选C。
6.答案:C
解析:本题主要考查原电池的原理。由反应可知,金属活动性,且此置换反应能在水溶液中发生。
C项,有反应可知,X、Y用导线连接后,可形成原电池,有电流产生,故C项正确;
A项,金属Cu放入盐的溶液中,发生铜置换银的反应,但是金属铜和金属银和水都不反应,故A项错误;
B项,属于非电解质,X、Y连接后,无法形成原电池,故B项错误;
D项,由X与Y做电极形成的原电池中,X不一定是负极,Y不一定是正极,如Fe、Cu、浓硝酸形成的原电池中Fe作正极,故D项错误。
综上所述,本题正确答案为C。
7.答案:A
解析:a与b相连时,电流由a流向b,电流方向从正极到负极,故a为正极,b为负极;负极金属活动性更强,因此;
c与d相连时,d极质量减少,质量减少的电极是负极,故d为负极,c为正极;金属活动性:;
a与c相连时,c极产生气泡,产生气泡的电极是正极(被还原为),故c为正极,a为负极,金属活动性:;
a与d相连时,移向a极,原电池中阴离子向负极迁移,故a为负极,d为正极,金属活动性:;
由上述关系可得:,对应选项A。
8.答案:B
解析:A.Cu为正极,发生还原反应,析出Cu,A错误;
B.原电池工作时,阳离子向正极移动,阴离子向负极移动,盐桥中的会移向溶液,B正确;
C.取出盐桥后,不是闭合回路,没有形成原电池,电流计不发生偏转,C错误;
D.Cu为正极,发生还原反应,析出Cu附着在Cu电极上,故铜片质量增加,D错误;
故选B。
9.答案:B
解析:A.该装置具备原电池的构成条件,因此形成了原电池,能将化学能转化为电能,但不能将化学能完全转化为电能,A错误;
B.电池工作时,盐桥中的移向电源的正极,即移向溶液,B正确;
C.电池工作时,导线中电流流向为,C错误;
D.负极反应为,发生氧化反应,D错误;
故选B。
10.答案:D
解析:A.据分析,乙烧杯中在b侧乙烧杯失电子发生氧化反应生成,A错误;
B.高锰酸钾溶液可以氧化氯离子,故不能换成饱和KCl溶液,B错误;
C.b侧是负极、a侧是正极,电池工作时,电子流动方向:石墨(乙)→b→a→石墨(甲),C错误;
D.a侧是正极,电极反应为,消耗氢离子,电池工作一段时间,甲烧杯中酸性减弱,D正确;
故选D。
11.答案:B
解析:A.由分析可知,1与2相连,a为正极,b为负极,盐桥①中阳离子向a电极移动,A错误;
B.2与3相连,右侧两池构成原电池,c电极质量增大,Ag转化为AgI,说明c为负极,b为正极,生成氢气,电池反应为,B正确;
C.1与3相连,由于AgI更难溶,AgCl转化为AgI,a极为正极,AgCl转化为Ag,a极质量减小,b极为负极,Ag转化为AgI,b极质量增加,a电极减小的质量小于c电极增大的质量,C错误;
D.1与2相连,b为负极,电势较低;2与3相连,c为负极,电势较低,D错误;
故选B。
12、
(1)答案:D>C>A>Fe>B
解析:原电池工作时,电子从负极经导线流向正极,以稀硫酸为电解质溶液时负极较活泼,由电子流向可知金属活动性:A>Fe、D>C、C>A、Fe>B,则金属活动性:D>C>A>Fe>B。
(2)答案:有无色气泡生成
解析:在①中,Fe为正极,氢离子得电子生成氢气,可观察到Fe片上有无色气泡生成。
(3)答案:C
解析:在②中,溶液中向正极移动,即向C移动。
(4)答案:B→D
解析:如果实验⑤用B、D,因活泼性B(5)答案:溶液、Cu片、石墨棒
解析:根据反应设计原电池,Cu被氧化,应为负极,正极可为石墨棒,电解质溶液为氯化铁溶液。
1.在如图所示的装置中,观察到电流表指针偏转(指针顺着电流方向偏转),M变粗,N变细,由此判断下表中所列M、N、P三种物质,其中可以成立的是( )
选项 M N P
A 锌 铜 稀硫酸
B 铜 铁 稀盐酸
C 银 锌 硝酸银溶液
D 锌 铁 硝酸铁溶液
A.A B.B C.C D.D
2.下列过程不涉及原电池的是( )
A.生铁在潮湿的环境中生锈
B.镀锡的铁片镀层破损后会加速腐蚀
C.纯镁在空气中表面迅速形成致密的氧化膜
D.实验室用铁制备时,向稀硫酸中滴入几滴溶液
3.图1是铜锌原电池示意图。图2中,x轴表示实验时流入正极的电子的物质的量,y轴表示( )
A.锌棒的质量 B. C.pH D.
4.某原电池的总反应的离子方程式为:,能实现该反应的原电池组成是( )
A.正极为铜,负极为铁,电解质溶液为溶液
B.正极为铜,负极为铁,电解质溶液为NaCl溶液
C.正极为铁,负极为铁,电解质溶液为溶液
D.正极为银,负极为铁,电解质溶液为溶液
5.下列有关原电池构成要素的说法错误的是( )
A.一般有一个自发的氧化还原反应 B.必须有离子导体
C.必须有两个活性不同的电极 D.必须形成闭合回路
6.把金属X放入盐的溶液中,发生如下反应:,下列说法正确的是( )
A.常温下金属X一定能与水反应,Y一定不能与水反应
B.X与Y用导线连接后放入中,一定形成原电池
C.X与Y用导线连接后放入同一个盛有溶液的烧杯中,一定有电流产生
D.由X与Y作电极形成的原电池中,X一定是负极,Y一定是正极
7.a、b、c、d四种金属片浸入稀硫酸中,用导线两两组成原电池。若a、b相连时,电流由a经导线流向b;c、d相连时,d极质量减少;a、c相连时,c极上产生大量气泡;a、d相连时,移向a极,则四种金属的活动性顺序由强到弱的顺序为( )
A. B. C. D.
8.有关如图所示原电池(盐桥中装有含琼脂的饱和溶液)的叙述,正确的是( )
A.铜片上有气泡逸出
B.反应中,盐桥中的会移向溶液
C.取出盐桥后,电流计依然发生偏转
D.反应前后铜片质量不改变
9.原电池为电化学建构认识模型奠定了重要的基础,下图装置中的盐桥装有琼脂凝胶,内含氯化钾.下列对于该原电池说法正确的是( )
A.该装置能将化学能完全转化为电能
B.电池工作时,盐桥中的移向溶液
C.电池工作时,导线中电流流向为
D.负极反应为,发生还原反应
10.某合作学习小组的同学设计如图原电池,盐桥中装有含饱和的胶状物,只起导电和平衡电荷的作用。下列叙述中正确的是( )
A.乙烧杯中发生还原反应
B.盐桥中的电解质可换成饱和KCl溶液
C.电子流动方向:石墨(甲)→a→b→石墨(乙)→盐桥→石墨(甲)
D.电池工作一段时间,甲烧杯中酸性减弱
11.如图装置中,b为标准氢电极,可发生还原反应()或氧化反应(),a、c分别为AgCl/Ag、AgI/Ag电极。实验发现:1与2相连a电极质量减小,2与3相连c电极质量增大。下列说法正确的是( )
A.1与2相连,盐桥①中阳离子向b电极移动
B.2与3相连,电池反应为
C.1与3相连,a电极减小的质量等于c电极增大的质量
D.1与2、2与3相连,两个原电池装置中,电势较低的一极均为b电极
12.现有A、B、C、D和Fe五种金属片,将其分别用导线连接后浸入稀硫酸中(如图),每次实验时,通过灵敏电流计测出电子流动方向如下。
实验分组 所用金属 电子流向
① A、Fe
② C、D
③ A、C
④ B、Fe
⑤ …… ……
根据上述情况,回答下列问题:
(1)上述五种金属的活动性顺序:__________。
(2)在①中,Fe片上观察到的现象是__________。
(3)在②中,溶液中向金属片__________(填“C”或“D”)移动。
(4)如果实验⑤用B、D,则导线中电流方向为_________(填“B→D”或“D→B”)。
(5)已知反应:。请用下列试剂和材料,用上图所示装置,将此反应设计成原电池。
试剂:溶液、溶液、溶液、KSCN溶液、溶液、双氧水、NaOH溶液。
材料:Cu片、Fe片、石墨棒。
设计原电池应选用的试剂和材料是__________。
答案以及解析
1.答案:C
解析:A.锌极材料比铜极活泼,A错误;
B.铜极上氢离子被还原生成氢气,铜极质量不增大,B错误;
C.N极材料比M极活泼,且M极上有银析出,所以质量增加,符合题意,C正确;
D.锌极材料比铁极活泼,D错误;
故选C。
2.答案:C
解析:A(×)潮湿环境中,生铁里的铁、碳与水溶液可构成原电池,能加快铁的生锈。
B(×)铁比锡活泼,镀锡的铁片镀层破损后,在潮湿环境中,可构成原电池,铁作负极,腐蚀速率加快。
C(√)纯镁在空气中与氧气反应,使表面生成致密氧化膜,保护内部镁不再反应,与原电池无关。
D(×)实验室用铁和稀硫酸制备时,加入硫酸铜溶液后,铁与铜离子发生置换反应,在铁表面析出铜,使铁、铜与电解质溶液构成原电池,可加快生成氢气的反应速率。
3.答案:A
解析:A.随着流入正极电子物质的量增多,即反应进行,锌棒不断溶解,锌棒质量不断减小,与图2曲线变化相符,A正确;
B.因为,随着流入正极电子物质的量增多,反应生成的增多,应增大,与图2曲线变化不符,B错误;
C.由于正极反应消耗,随着流入正极电子物质的量增多,溶液中减小,pH应增大,与图2曲线变化不符,C错误;
D.不参与原电池反应,其浓度不变,与图2曲线变化不符,D错误;
故选A。
4.答案:A
解析:A.铁作负极,铜作正极,电解质为可溶性的,能实现该反应,故A正确;
B.正极为铜,负极为铁,电解质溶液为NaCl溶液,不能实现该反应,故B错误;
C.正极为铁,负极为铁,不能构成原电池,故C错误;
D.铁作负极,银作正极,电解质为溶液,负极铁失去电子生成二价铁,正极铜离子得到电子生成铜单质,不能实现该反应,故D错误;
故答案选A。
5.答案:C
解析:A.根据原电池构成条件可知,自发进行的氧化还原反应理论上均可设计成原电池,A正确;
B.要形成原电池,必须形成闭合回路,所以必须有电解质溶液或离子导体,B正确;
C.要形成原电池,必须有两个电极,两个电极的活性可以不同,但也可以相同,如燃料电池,C错误;
D.要形成原电池,必须形成闭合回路,电路中才能产生电流,才能对外提供电能,D正确;故答案选C。
6.答案:C
解析:本题主要考查原电池的原理。由反应可知,金属活动性,且此置换反应能在水溶液中发生。
C项,有反应可知,X、Y用导线连接后,可形成原电池,有电流产生,故C项正确;
A项,金属Cu放入盐的溶液中,发生铜置换银的反应,但是金属铜和金属银和水都不反应,故A项错误;
B项,属于非电解质,X、Y连接后,无法形成原电池,故B项错误;
D项,由X与Y做电极形成的原电池中,X不一定是负极,Y不一定是正极,如Fe、Cu、浓硝酸形成的原电池中Fe作正极,故D项错误。
综上所述,本题正确答案为C。
7.答案:A
解析:a与b相连时,电流由a流向b,电流方向从正极到负极,故a为正极,b为负极;负极金属活动性更强,因此;
c与d相连时,d极质量减少,质量减少的电极是负极,故d为负极,c为正极;金属活动性:;
a与c相连时,c极产生气泡,产生气泡的电极是正极(被还原为),故c为正极,a为负极,金属活动性:;
a与d相连时,移向a极,原电池中阴离子向负极迁移,故a为负极,d为正极,金属活动性:;
由上述关系可得:,对应选项A。
8.答案:B
解析:A.Cu为正极,发生还原反应,析出Cu,A错误;
B.原电池工作时,阳离子向正极移动,阴离子向负极移动,盐桥中的会移向溶液,B正确;
C.取出盐桥后,不是闭合回路,没有形成原电池,电流计不发生偏转,C错误;
D.Cu为正极,发生还原反应,析出Cu附着在Cu电极上,故铜片质量增加,D错误;
故选B。
9.答案:B
解析:A.该装置具备原电池的构成条件,因此形成了原电池,能将化学能转化为电能,但不能将化学能完全转化为电能,A错误;
B.电池工作时,盐桥中的移向电源的正极,即移向溶液,B正确;
C.电池工作时,导线中电流流向为,C错误;
D.负极反应为,发生氧化反应,D错误;
故选B。
10.答案:D
解析:A.据分析,乙烧杯中在b侧乙烧杯失电子发生氧化反应生成,A错误;
B.高锰酸钾溶液可以氧化氯离子,故不能换成饱和KCl溶液,B错误;
C.b侧是负极、a侧是正极,电池工作时,电子流动方向:石墨(乙)→b→a→石墨(甲),C错误;
D.a侧是正极,电极反应为,消耗氢离子,电池工作一段时间,甲烧杯中酸性减弱,D正确;
故选D。
11.答案:B
解析:A.由分析可知,1与2相连,a为正极,b为负极,盐桥①中阳离子向a电极移动,A错误;
B.2与3相连,右侧两池构成原电池,c电极质量增大,Ag转化为AgI,说明c为负极,b为正极,生成氢气,电池反应为,B正确;
C.1与3相连,由于AgI更难溶,AgCl转化为AgI,a极为正极,AgCl转化为Ag,a极质量减小,b极为负极,Ag转化为AgI,b极质量增加,a电极减小的质量小于c电极增大的质量,C错误;
D.1与2相连,b为负极,电势较低;2与3相连,c为负极,电势较低,D错误;
故选B。
12、
(1)答案:D>C>A>Fe>B
解析:原电池工作时,电子从负极经导线流向正极,以稀硫酸为电解质溶液时负极较活泼,由电子流向可知金属活动性:A>Fe、D>C、C>A、Fe>B,则金属活动性:D>C>A>Fe>B。
(2)答案:有无色气泡生成
解析:在①中,Fe为正极,氢离子得电子生成氢气,可观察到Fe片上有无色气泡生成。
(3)答案:C
解析:在②中,溶液中向正极移动,即向C移动。
(4)答案:B→D
解析:如果实验⑤用B、D,因活泼性B
解析:根据反应设计原电池,Cu被氧化,应为负极,正极可为石墨棒,电解质溶液为氯化铁溶液。
