1.2.1研究物质的基本方法——高一化学鲁科版(2019)必修一同步课时作业(含解析)
文档属性
| 名称 | 1.2.1研究物质的基本方法——高一化学鲁科版(2019)必修一同步课时作业(含解析) |  | |
| 格式 | docx | ||
| 文件大小 | 329.0KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 鲁科版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2025-07-02 21:01:44 | ||
图片预览




文档简介
1.2.1研究物质的基本方法
1.下列对于金属Na性质的描述,不正确的是( )
A.硬度小 B.有金属光泽 C.有强还原性 D.密度比水大
2.下列有关钠及其化合物的说法错误的是( )
A.Na的硬度较小
B.Na与的反应是放热反应
C.Na露置于空气中最终生成NaOH
D.具有强氧化性
3.下列对金属钠的叙述正确的是( )
A.少量金属钠应该保存在煤油中
B.金属钠在空气中燃烧,生成
C.火灾现场有大量金属钠存放时,可用水灭火
D.将一小粒金属钠放入硫酸铜溶液中,可置换出铜
4.一块绿豆大小的钠块加入到盛有一定量滴加少量酚酞的水的烧杯中,反应现象十分丰富。下列是该实验可能的现象:
①钠浮在水面上;
②钠球四处游动;
③有大量气泡产生;
④钠熔成银白色金属小球;
⑤发出轻微的响声;
⑥气体燃烧,产生黄色火焰;
⑦溶液变红。
描述正确的有( )
A.4项 B.5项 C.6项 D.7项
5.钠与水反应的微型实验装置如图所示。下列说法不正确的是( )
A.肥皂液可用于收集反应产生的
B.反应时,钠块熔为小球,说明钠的硬度小
C.钠块在煤油和水交界处上下跳动,直至消失
D.反应后试管中液体分层,下层呈红色
6.下列有关钠的叙述,正确的是( )
①钠在空气中燃烧生成氧化钠
②金属钠有强还原性
③钠与硫酸铜溶液反应,可以置换出铜
④金属钠可以保存在煤油中
⑤钠原子的最外层上只有一个电子,所以在化合物中钠的化合价显+1价
A.①②④ B.②③⑤ C.①④⑤ D.②④⑤
7.钠与氧气发生下列反应:
①
②
下列说法不正确的是( )
A.新切开的金属钠表面很快变暗,主要发生了反应①
B.钠在空气中燃烧生成淡黄色固体,主要发生了反应②
C.和中阳离子与阴离子个数比均为2:1
D.和与水反应所得产物完全相同
8.有研究发现:某温度下,钠完全燃烧的产物是白色的过氧化钠固体,极少量的超氧化钠的生成使产物表现为淡黄色固体。有学习小组设计了一套基于“烟囱效应”(促进空气流动)的实验装置(如图所示)来探究钠的燃烧反应。下列关于该实验的说法错误的是( )
A.管内的空气被加热,密度降低,从玻璃管右侧逸出,产生压力差,促进外部空气从左管道进入
B.加热过程中,先观察到产生白色气体,之后在右侧玻璃管中出现白色固体,这是产生的过氧化钠气体遇冷凝华为固体
C.基于“烟囱效应”,右侧玻璃管越短越好
D.最终玻璃管中残留的固体可以用水进行清洗
9.将钠和碳分别置于如图所示的两个盛满氧气的集气瓶中,燃烧完毕冷却至室温后,打开装置中的两个弹簧夹,盛水的试剂瓶中的实验现象是( )
A.左导管液面上升,右导管液面无明显变化
B.左导管液面无明显变化,右导管液面上升
C.左、右导管液面均上升
D.左、右导管液面均下降
10.下列离子方程式正确的是( )
A.钠与水反应:
B.碳酸氢钠溶液与氢氧化钠溶液混合:
C.稀硫酸和氢氧化钡溶液反应:
D.Fe与盐酸反应:
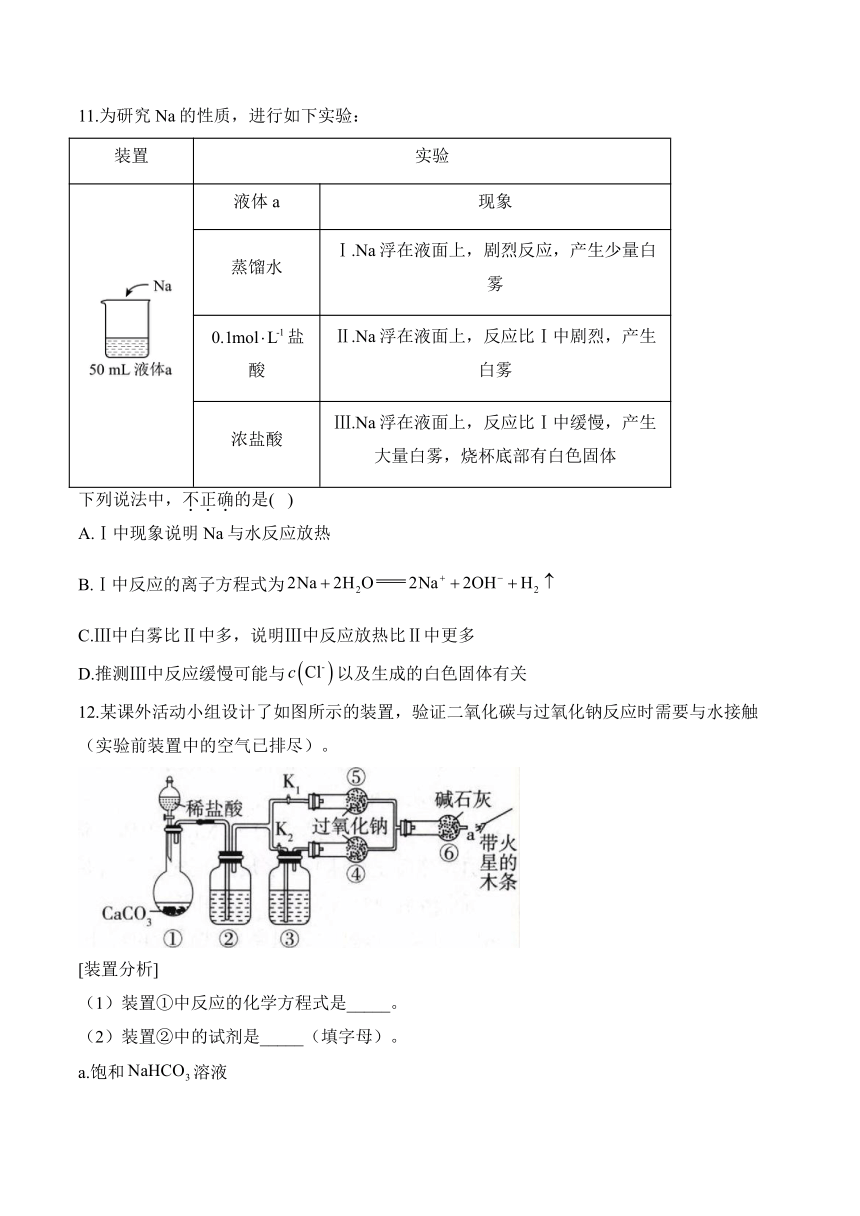
11.为研究Na的性质,进行如下实验:
装置 实验
液体a 现象
蒸馏水 Ⅰ.Na浮在液面上,剧烈反应,产生少量白雾
盐酸 Ⅱ.Na浮在液面上,反应比Ⅰ中剧烈,产生白雾
浓盐酸 Ⅲ.Na浮在液面上,反应比Ⅰ中缓慢,产生大量白雾,烧杯底部有白色固体
下列说法中,不正确的是( )
A.Ⅰ中现象说明Na与水反应放热
B.Ⅰ中反应的离子方程式为
C.Ⅲ中白雾比Ⅱ中多,说明Ⅲ中反应放热比Ⅱ中更多
D.推测Ⅲ中反应缓慢可能与以及生成的白色固体有关
12.某课外活动小组设计了如图所示的装置,验证二氧化碳与过氧化钠反应时需要与水接触(实验前装置中的空气已排尽)。
[装置分析]
(1)装置①中反应的化学方程式是_____。
(2)装置②中的试剂是_____(填字母)。
a.饱和溶液
b.饱和溶液
c.浓
(3)装置③中的试剂是_____。
[进行实验]
步骤1:打开弹簧夹,关闭,打开分液漏斗活塞,加入稀盐酸,将带火星的木条放在a处。
步骤2:打开弹簧夹,关闭,打开分液漏斗活塞,加入稀盐酸,将带火星的木条放在a处。
(4)步骤1和步骤2中,a处带火星的木条产生的实验现象分别是_____。
(5)过氧化钠与二氧化碳反应的化学方程式是_____。
[实验反思]
(6)有同学提出质疑:“上述实验不足以证明有水存在时过氧化钠与二氧化碳发生了化学反应。”其理由是_____。
(7)需要补充的实验操作:取装置⑤中反应后的少量固体,_____。
答案以及解析
1.答案:D
解析:A.钠单质可用刀切开,说明钠的硬度小,A不符合题意;
B.钠作为金属单质,具有金属的通性,故钠具有金属光泽,B不符合题意;
C.钠的最外层只有一个电子,易失去电子,具有强还原性,C不符合题意;
D.钠与水反应时,钠单质浮在水面上,说明钠的密度比水小,D符合题意;
故选D。
2.答案:C
解析:A.钠可以用小刀切,说明Na的硬度较小,故A正确;
B.Na与的反应生成氢气和氢氧化钠,该反应是放热反应,故B正确;
C.Na露置于空气中先变为氧化钠,氧化钠和水反应生成NaOH,NaOH潮解变为氢氧化钠溶液,氢氧化钠和二氧化碳反应生成碳酸钠溶液,碳酸钠溶液中水分蒸发变为十水碳酸钠,十水碳酸钠失去水分变为碳酸钠,故C错误;
D.中氧-1价,易降低,因此具有强氧化性,故D正确。
综上所述,答案为C。
3.答案:A
解析:A.钠易和水、氧气反应,钠的密度大于煤油,且和煤油不反应,所以少量钠能保存在煤油中,故A正确;
B.钠在空气中燃烧生成,故B错误;
C.钠燃烧生成过氧化钠,过氧化钠和水、二氧化碳反应生成氧气,促进钠燃烧,故C错误;
D.将一小粒金属钠放入硫酸铜溶液中,Na先和水反应生成的氢氧化钠,再与硫酸铜生成氢氧化铜蓝色沉淀和硫酸钠,置换不出铜,故D错误;
故选A。
4.答案:B
解析:①钠和水反应,因为钠的密度比水小,所以钠浮在水面上,①正确;
②因为生成氢气,推动钠球四处游动,②正确;
③钠与水反应生成气体,但钠会浮在水面上,看不到气泡,③错误;
④因为反应放热,且钠的熔点低,所以钠熔成银白色金属小球,④正确;
⑤反应剧烈,生成的氢气,发出轻微的响声,⑤正确;
⑥燃烧产生黄色火焰是由于金属钠的燃烧,⑥错误;
⑦生成氢氧化钠,酚酞溶液变红,⑦正确;
故符合实验事实的现象有:①②④⑤⑦共五项,故选B。
5.答案:B
解析:A.钠和水反应产生氢气,氢气从支管导出时会吹出肥皂泡,故肥皂液可用于收集反应产生的,A正确;
B.反应时,钠块熔为小球,说明钠的熔点低,B不正确;
C.据分析,钠块在煤油和水交界处上下跳动,直至消失,C正确;
D.反应生成的氢氧化钠溶液与煤油互不相溶,煤油密度小在上层,结合分析可知,反应后试管中液体分层,下层呈红色,D正确;
选B。
6.答案:D
解析:①钠在空气中燃烧生成过氧化钠,不是氧化钠,错误;②钠原子最外层只有一个电子,这个电子受到原子核的吸引力小,容易失去,因此金属钠在反应中容易失电子,具有强还原性,正确;③金属钠和硫酸铜溶液反应时,是Na先和水反应,不会置换出金属Cu,错误;④金属钠易和空气的成分反应,因其密度比煤油大,与煤油不发生反应,因此常保存在煤油中以隔绝空气,正确;⑤钠原子最外层只有一个电子,易失去电子形成+1价Na+离子,正确.故正确的说法是②④⑤,选项D正确。
7.答案:D
解析:A.新切开的金属钠表面很快变暗是那和空气中的氧气反应生成白色固体氧化钠,则新切开的金属钠表面很快变暗,主要发生了反应①,故A正确;
B.钠在空气中燃烧生成淡黄色固体发生的反应为钠在氧气中燃烧生成过氧化钠,反应的化学方程式为,则钠在空气中燃烧生成淡黄色固体,主要发生了反应②故B正确;
C.氧化钠是钠离子和氧离子构成,过氧化钠是钠离子和过氧根离子构成,则氧化钠和过氧化钠中阳离子与阴离子个数比均为2:1,故C正确;
D.氧化钠与水反应生成氢氧化钠,过氧化钠与水反应生成氢氧化钠和氧气,则两者与水反应所得产物不完全相同,故D错误;
故选D。
8.答案:C
解析:管内的空气被加热,密度减小,小于管外空气的密度,从玻璃管上口即右侧逸出,产生压强差,促进外部空气从下口即左管进入,A正确;
结合题意可知,钠在水平管内燃烧生成白色的过氧化钠气体,流动的空气将过氧化钠气体带到右侧,在右侧遇冷凝华为固体,所以加热过程中,先观察到产生白色气体,之后在右侧玻璃管中出现白色固体,B正确;
“烟囱效应”的原理是产生压强差促进空气流动,则右侧玻璃管较长更容易观察到右侧有白色的过氧化钠生成,C错误;
过氧化钠与水反应生成氢氧化钠和氧气而溶解,故最终玻璃管中残留的固体可以用水进行清洗,D正确。
9.答案:A
解析:钠与氧气反应生成过氧化钠固体,燃烧消耗使左瓶内气体体积减小,压强减小;碳与氧气反应生成二氧化碳气体,燃烧完毕冷却至室温后,右瓶中气体的体积不变,气体压强不变;当燃烧完毕后同时打开装置中的两个活塞,中间广口瓶中的水只会沿导气管进入左瓶中,因此会看到左导管液面上升,右导管液面无明显变化,故合理选项是A。
10.答案:D
解析:A.金属Na与反应生成NaOH和氢气,反应离子方程式为,故A错误;
B.碳酸氢钠溶液与氢氧化钠溶液反应生成碳酸钠和水,离子方程式为:,故B错误;
C.稀硫酸和氢氧化钡溶液反应生成硫酸钡沉淀和水,离子方程式为:,故C错误;
D.Fe与盐酸反应生成氯化亚铁和氢气,离子方程式为:,故D正确;
故选D
11.答案:C
解析:A.Ⅰ中Na投入到蒸馏水中,可与水发生反应,产生少量白雾,说明剧烈,且放热,A正确;
B.Ⅰ中Na投入到蒸馏水中,可与水发生反应,反应的离子方程式为,B正确;
C.浓盐酸易挥发,所以对照实验Ⅲ和Ⅱ,钠与氢离子反应放热,除了有挥发的水蒸气以外,还有HCl,它在空气中与水蒸气结合,呈现更多的白雾,C错误;
D.实验Ⅲ和Ⅱ对照可知,反应的实质是钠与氢离子反应,之所以反应缓慢,可能与以及生成的白色固体有关,D正确;
故选C。
12.答案:(1)
(2)a
(3)浓硫酸
(4)步骤1中带火星的木条不复燃,步骤2中带火星的木条复燃
(5)
(6)经过⑤处的气体中有水,水也可与反应产生使带火星的木条复燃
(7)加入稀盐酸,将产生的气体通入澄清石灰水中
解析:装置①为与稀盐酸反应制备二氧化碳的装置,装置②的作用是除去二氧化碳中的氯化氢气体,装置③的作用是除去二氧化碳中的水蒸气。装置④和⑤用来验证二氧化碳与过氧化钠反应时需要与水接触。带火星的木条能检验氧气,二氧化碳不支持燃烧,也不能燃烧,当二氧化碳通过过氧化钠时,不可能全部反应,所以应该除去未反应的二氧化碳,再用带火星的木条来检验是否产生了氧气,否则氧气浓度过低会导致带火星的木条不复燃,则装置⑥的作用是吸收过量的二氧化碳,防止干扰氧气的检验。
(4)步骤1中,通过过氧化钠的二氧化碳中不含有水蒸气,干燥的二氧化碳不能和过氧化钠反应,没有氧气生成,a处带火星的木条不复燃;步骤2中,通过过氧化钠的二氧化碳中含有水蒸气,含有水蒸气的二氧化碳能和过氧化钠反应,有氧气生成,a处带火星的木条复燃。
(5)过氧化钠与二氧化碳反应生成碳酸钠和氧气,反应的化学方程式为。
(6)因水也能和过氧化钠反应生成氧气,所以不能证明是二氧化碳和过氧化钠发生反应产生了氧气。
(7)二氧化碳和过氧化钠反应有碳酸钠生成,装置⑤中反应后的固体有碳酸钠,稀盐酸和碳酸钠反应可生成二氧化碳,二氧化碳能使澄清石灰水变浑浊。
1.下列对于金属Na性质的描述,不正确的是( )
A.硬度小 B.有金属光泽 C.有强还原性 D.密度比水大
2.下列有关钠及其化合物的说法错误的是( )
A.Na的硬度较小
B.Na与的反应是放热反应
C.Na露置于空气中最终生成NaOH
D.具有强氧化性
3.下列对金属钠的叙述正确的是( )
A.少量金属钠应该保存在煤油中
B.金属钠在空气中燃烧,生成
C.火灾现场有大量金属钠存放时,可用水灭火
D.将一小粒金属钠放入硫酸铜溶液中,可置换出铜
4.一块绿豆大小的钠块加入到盛有一定量滴加少量酚酞的水的烧杯中,反应现象十分丰富。下列是该实验可能的现象:
①钠浮在水面上;
②钠球四处游动;
③有大量气泡产生;
④钠熔成银白色金属小球;
⑤发出轻微的响声;
⑥气体燃烧,产生黄色火焰;
⑦溶液变红。
描述正确的有( )
A.4项 B.5项 C.6项 D.7项
5.钠与水反应的微型实验装置如图所示。下列说法不正确的是( )
A.肥皂液可用于收集反应产生的
B.反应时,钠块熔为小球,说明钠的硬度小
C.钠块在煤油和水交界处上下跳动,直至消失
D.反应后试管中液体分层,下层呈红色
6.下列有关钠的叙述,正确的是( )
①钠在空气中燃烧生成氧化钠
②金属钠有强还原性
③钠与硫酸铜溶液反应,可以置换出铜
④金属钠可以保存在煤油中
⑤钠原子的最外层上只有一个电子,所以在化合物中钠的化合价显+1价
A.①②④ B.②③⑤ C.①④⑤ D.②④⑤
7.钠与氧气发生下列反应:
①
②
下列说法不正确的是( )
A.新切开的金属钠表面很快变暗,主要发生了反应①
B.钠在空气中燃烧生成淡黄色固体,主要发生了反应②
C.和中阳离子与阴离子个数比均为2:1
D.和与水反应所得产物完全相同
8.有研究发现:某温度下,钠完全燃烧的产物是白色的过氧化钠固体,极少量的超氧化钠的生成使产物表现为淡黄色固体。有学习小组设计了一套基于“烟囱效应”(促进空气流动)的实验装置(如图所示)来探究钠的燃烧反应。下列关于该实验的说法错误的是( )
A.管内的空气被加热,密度降低,从玻璃管右侧逸出,产生压力差,促进外部空气从左管道进入
B.加热过程中,先观察到产生白色气体,之后在右侧玻璃管中出现白色固体,这是产生的过氧化钠气体遇冷凝华为固体
C.基于“烟囱效应”,右侧玻璃管越短越好
D.最终玻璃管中残留的固体可以用水进行清洗
9.将钠和碳分别置于如图所示的两个盛满氧气的集气瓶中,燃烧完毕冷却至室温后,打开装置中的两个弹簧夹,盛水的试剂瓶中的实验现象是( )
A.左导管液面上升,右导管液面无明显变化
B.左导管液面无明显变化,右导管液面上升
C.左、右导管液面均上升
D.左、右导管液面均下降
10.下列离子方程式正确的是( )
A.钠与水反应:
B.碳酸氢钠溶液与氢氧化钠溶液混合:
C.稀硫酸和氢氧化钡溶液反应:
D.Fe与盐酸反应:
11.为研究Na的性质,进行如下实验:
装置 实验
液体a 现象
蒸馏水 Ⅰ.Na浮在液面上,剧烈反应,产生少量白雾
盐酸 Ⅱ.Na浮在液面上,反应比Ⅰ中剧烈,产生白雾
浓盐酸 Ⅲ.Na浮在液面上,反应比Ⅰ中缓慢,产生大量白雾,烧杯底部有白色固体
下列说法中,不正确的是( )
A.Ⅰ中现象说明Na与水反应放热
B.Ⅰ中反应的离子方程式为
C.Ⅲ中白雾比Ⅱ中多,说明Ⅲ中反应放热比Ⅱ中更多
D.推测Ⅲ中反应缓慢可能与以及生成的白色固体有关
12.某课外活动小组设计了如图所示的装置,验证二氧化碳与过氧化钠反应时需要与水接触(实验前装置中的空气已排尽)。
[装置分析]
(1)装置①中反应的化学方程式是_____。
(2)装置②中的试剂是_____(填字母)。
a.饱和溶液
b.饱和溶液
c.浓
(3)装置③中的试剂是_____。
[进行实验]
步骤1:打开弹簧夹,关闭,打开分液漏斗活塞,加入稀盐酸,将带火星的木条放在a处。
步骤2:打开弹簧夹,关闭,打开分液漏斗活塞,加入稀盐酸,将带火星的木条放在a处。
(4)步骤1和步骤2中,a处带火星的木条产生的实验现象分别是_____。
(5)过氧化钠与二氧化碳反应的化学方程式是_____。
[实验反思]
(6)有同学提出质疑:“上述实验不足以证明有水存在时过氧化钠与二氧化碳发生了化学反应。”其理由是_____。
(7)需要补充的实验操作:取装置⑤中反应后的少量固体,_____。
答案以及解析
1.答案:D
解析:A.钠单质可用刀切开,说明钠的硬度小,A不符合题意;
B.钠作为金属单质,具有金属的通性,故钠具有金属光泽,B不符合题意;
C.钠的最外层只有一个电子,易失去电子,具有强还原性,C不符合题意;
D.钠与水反应时,钠单质浮在水面上,说明钠的密度比水小,D符合题意;
故选D。
2.答案:C
解析:A.钠可以用小刀切,说明Na的硬度较小,故A正确;
B.Na与的反应生成氢气和氢氧化钠,该反应是放热反应,故B正确;
C.Na露置于空气中先变为氧化钠,氧化钠和水反应生成NaOH,NaOH潮解变为氢氧化钠溶液,氢氧化钠和二氧化碳反应生成碳酸钠溶液,碳酸钠溶液中水分蒸发变为十水碳酸钠,十水碳酸钠失去水分变为碳酸钠,故C错误;
D.中氧-1价,易降低,因此具有强氧化性,故D正确。
综上所述,答案为C。
3.答案:A
解析:A.钠易和水、氧气反应,钠的密度大于煤油,且和煤油不反应,所以少量钠能保存在煤油中,故A正确;
B.钠在空气中燃烧生成,故B错误;
C.钠燃烧生成过氧化钠,过氧化钠和水、二氧化碳反应生成氧气,促进钠燃烧,故C错误;
D.将一小粒金属钠放入硫酸铜溶液中,Na先和水反应生成的氢氧化钠,再与硫酸铜生成氢氧化铜蓝色沉淀和硫酸钠,置换不出铜,故D错误;
故选A。
4.答案:B
解析:①钠和水反应,因为钠的密度比水小,所以钠浮在水面上,①正确;
②因为生成氢气,推动钠球四处游动,②正确;
③钠与水反应生成气体,但钠会浮在水面上,看不到气泡,③错误;
④因为反应放热,且钠的熔点低,所以钠熔成银白色金属小球,④正确;
⑤反应剧烈,生成的氢气,发出轻微的响声,⑤正确;
⑥燃烧产生黄色火焰是由于金属钠的燃烧,⑥错误;
⑦生成氢氧化钠,酚酞溶液变红,⑦正确;
故符合实验事实的现象有:①②④⑤⑦共五项,故选B。
5.答案:B
解析:A.钠和水反应产生氢气,氢气从支管导出时会吹出肥皂泡,故肥皂液可用于收集反应产生的,A正确;
B.反应时,钠块熔为小球,说明钠的熔点低,B不正确;
C.据分析,钠块在煤油和水交界处上下跳动,直至消失,C正确;
D.反应生成的氢氧化钠溶液与煤油互不相溶,煤油密度小在上层,结合分析可知,反应后试管中液体分层,下层呈红色,D正确;
选B。
6.答案:D
解析:①钠在空气中燃烧生成过氧化钠,不是氧化钠,错误;②钠原子最外层只有一个电子,这个电子受到原子核的吸引力小,容易失去,因此金属钠在反应中容易失电子,具有强还原性,正确;③金属钠和硫酸铜溶液反应时,是Na先和水反应,不会置换出金属Cu,错误;④金属钠易和空气的成分反应,因其密度比煤油大,与煤油不发生反应,因此常保存在煤油中以隔绝空气,正确;⑤钠原子最外层只有一个电子,易失去电子形成+1价Na+离子,正确.故正确的说法是②④⑤,选项D正确。
7.答案:D
解析:A.新切开的金属钠表面很快变暗是那和空气中的氧气反应生成白色固体氧化钠,则新切开的金属钠表面很快变暗,主要发生了反应①,故A正确;
B.钠在空气中燃烧生成淡黄色固体发生的反应为钠在氧气中燃烧生成过氧化钠,反应的化学方程式为,则钠在空气中燃烧生成淡黄色固体,主要发生了反应②故B正确;
C.氧化钠是钠离子和氧离子构成,过氧化钠是钠离子和过氧根离子构成,则氧化钠和过氧化钠中阳离子与阴离子个数比均为2:1,故C正确;
D.氧化钠与水反应生成氢氧化钠,过氧化钠与水反应生成氢氧化钠和氧气,则两者与水反应所得产物不完全相同,故D错误;
故选D。
8.答案:C
解析:管内的空气被加热,密度减小,小于管外空气的密度,从玻璃管上口即右侧逸出,产生压强差,促进外部空气从下口即左管进入,A正确;
结合题意可知,钠在水平管内燃烧生成白色的过氧化钠气体,流动的空气将过氧化钠气体带到右侧,在右侧遇冷凝华为固体,所以加热过程中,先观察到产生白色气体,之后在右侧玻璃管中出现白色固体,B正确;
“烟囱效应”的原理是产生压强差促进空气流动,则右侧玻璃管较长更容易观察到右侧有白色的过氧化钠生成,C错误;
过氧化钠与水反应生成氢氧化钠和氧气而溶解,故最终玻璃管中残留的固体可以用水进行清洗,D正确。
9.答案:A
解析:钠与氧气反应生成过氧化钠固体,燃烧消耗使左瓶内气体体积减小,压强减小;碳与氧气反应生成二氧化碳气体,燃烧完毕冷却至室温后,右瓶中气体的体积不变,气体压强不变;当燃烧完毕后同时打开装置中的两个活塞,中间广口瓶中的水只会沿导气管进入左瓶中,因此会看到左导管液面上升,右导管液面无明显变化,故合理选项是A。
10.答案:D
解析:A.金属Na与反应生成NaOH和氢气,反应离子方程式为,故A错误;
B.碳酸氢钠溶液与氢氧化钠溶液反应生成碳酸钠和水,离子方程式为:,故B错误;
C.稀硫酸和氢氧化钡溶液反应生成硫酸钡沉淀和水,离子方程式为:,故C错误;
D.Fe与盐酸反应生成氯化亚铁和氢气,离子方程式为:,故D正确;
故选D
11.答案:C
解析:A.Ⅰ中Na投入到蒸馏水中,可与水发生反应,产生少量白雾,说明剧烈,且放热,A正确;
B.Ⅰ中Na投入到蒸馏水中,可与水发生反应,反应的离子方程式为,B正确;
C.浓盐酸易挥发,所以对照实验Ⅲ和Ⅱ,钠与氢离子反应放热,除了有挥发的水蒸气以外,还有HCl,它在空气中与水蒸气结合,呈现更多的白雾,C错误;
D.实验Ⅲ和Ⅱ对照可知,反应的实质是钠与氢离子反应,之所以反应缓慢,可能与以及生成的白色固体有关,D正确;
故选C。
12.答案:(1)
(2)a
(3)浓硫酸
(4)步骤1中带火星的木条不复燃,步骤2中带火星的木条复燃
(5)
(6)经过⑤处的气体中有水,水也可与反应产生使带火星的木条复燃
(7)加入稀盐酸,将产生的气体通入澄清石灰水中
解析:装置①为与稀盐酸反应制备二氧化碳的装置,装置②的作用是除去二氧化碳中的氯化氢气体,装置③的作用是除去二氧化碳中的水蒸气。装置④和⑤用来验证二氧化碳与过氧化钠反应时需要与水接触。带火星的木条能检验氧气,二氧化碳不支持燃烧,也不能燃烧,当二氧化碳通过过氧化钠时,不可能全部反应,所以应该除去未反应的二氧化碳,再用带火星的木条来检验是否产生了氧气,否则氧气浓度过低会导致带火星的木条不复燃,则装置⑥的作用是吸收过量的二氧化碳,防止干扰氧气的检验。
(4)步骤1中,通过过氧化钠的二氧化碳中不含有水蒸气,干燥的二氧化碳不能和过氧化钠反应,没有氧气生成,a处带火星的木条不复燃;步骤2中,通过过氧化钠的二氧化碳中含有水蒸气,含有水蒸气的二氧化碳能和过氧化钠反应,有氧气生成,a处带火星的木条复燃。
(5)过氧化钠与二氧化碳反应生成碳酸钠和氧气,反应的化学方程式为。
(6)因水也能和过氧化钠反应生成氧气,所以不能证明是二氧化碳和过氧化钠发生反应产生了氧气。
(7)二氧化碳和过氧化钠反应有碳酸钠生成,装置⑤中反应后的固体有碳酸钠,稀盐酸和碳酸钠反应可生成二氧化碳,二氧化碳能使澄清石灰水变浑浊。
