1.2.2研究物质性质的程序——高一化学鲁科版(2019)必修一同步课时作业(含解析)
文档属性
| 名称 | 1.2.2研究物质性质的程序——高一化学鲁科版(2019)必修一同步课时作业(含解析) |  | |
| 格式 | docx | ||
| 文件大小 | 573.3KB | ||
| 资源类型 | 教案 | ||
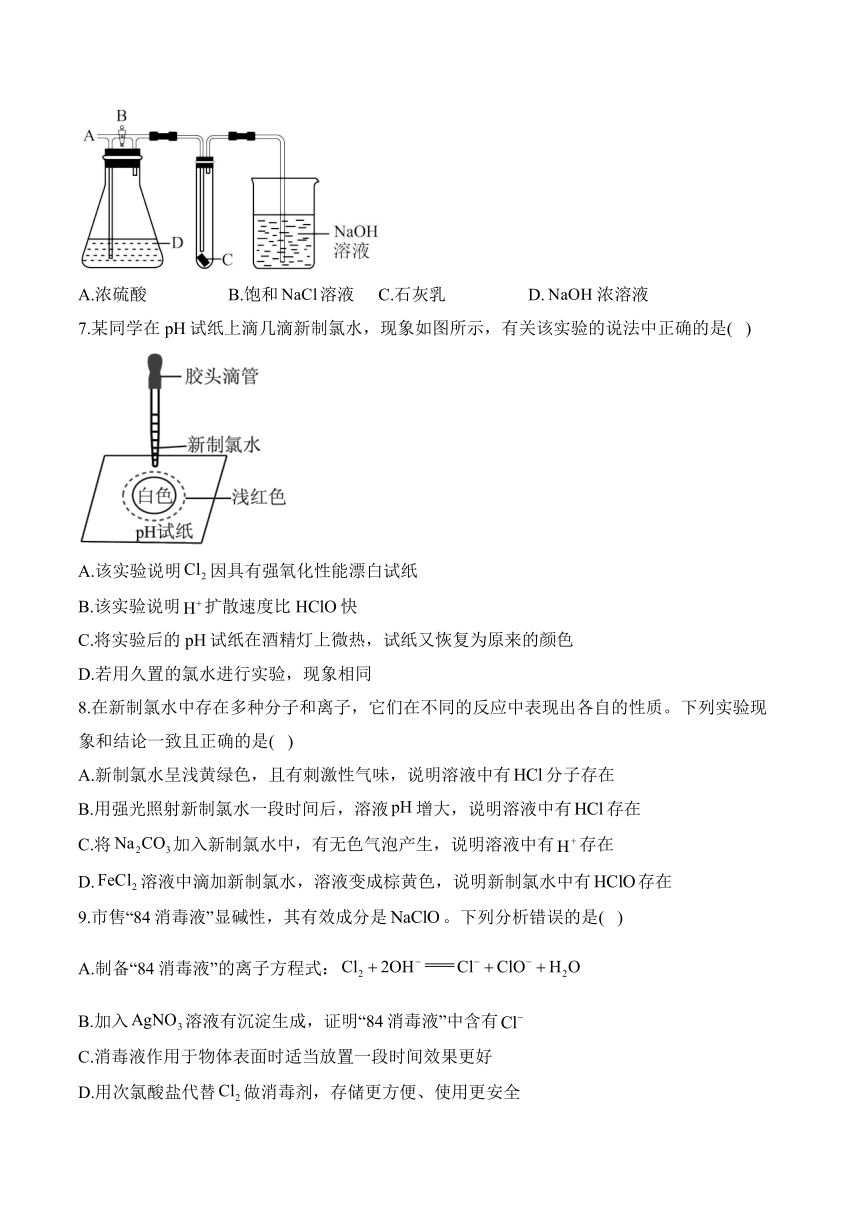
| 版本资源 | 鲁科版(2019) | ||
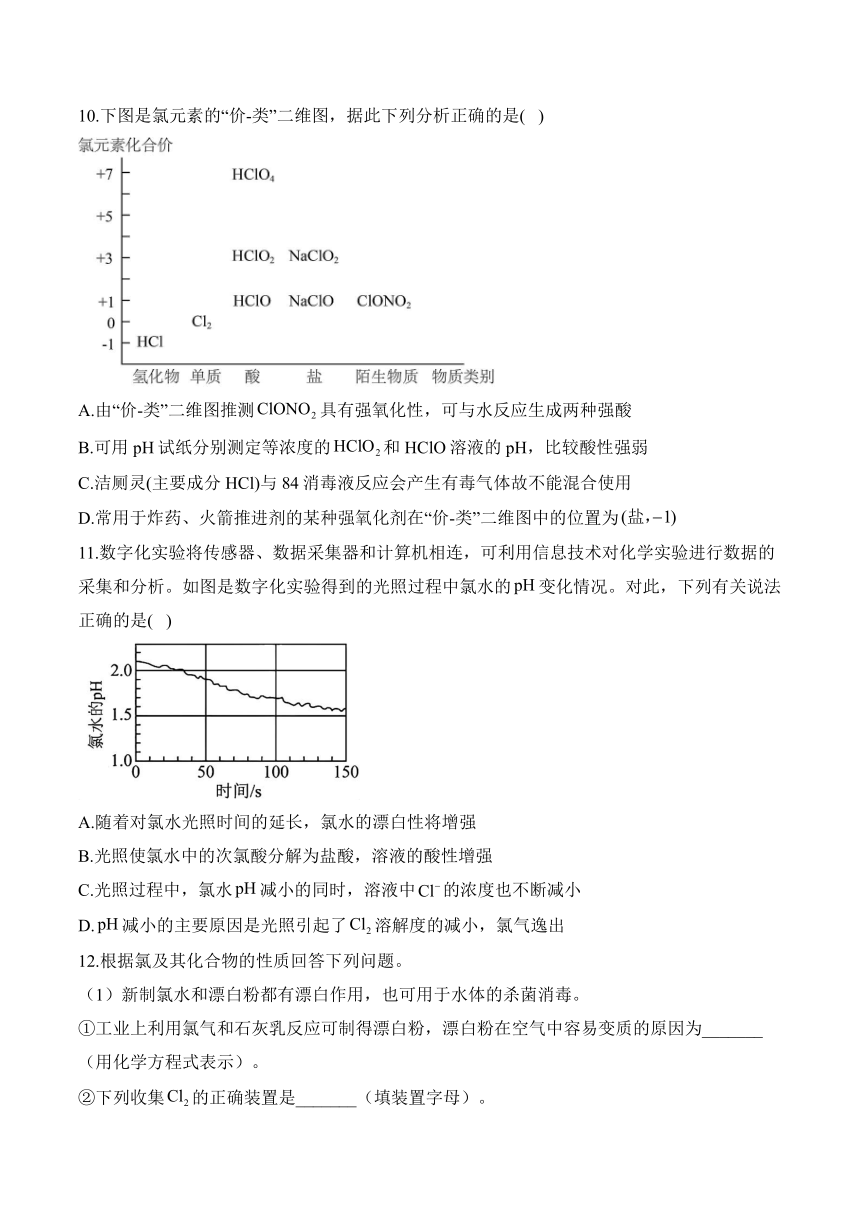
| 科目 | 化学 | ||
| 更新时间 | 2025-07-03 09:10:55 | ||
图片预览

文档简介
1.2.2研究物质性质的程序
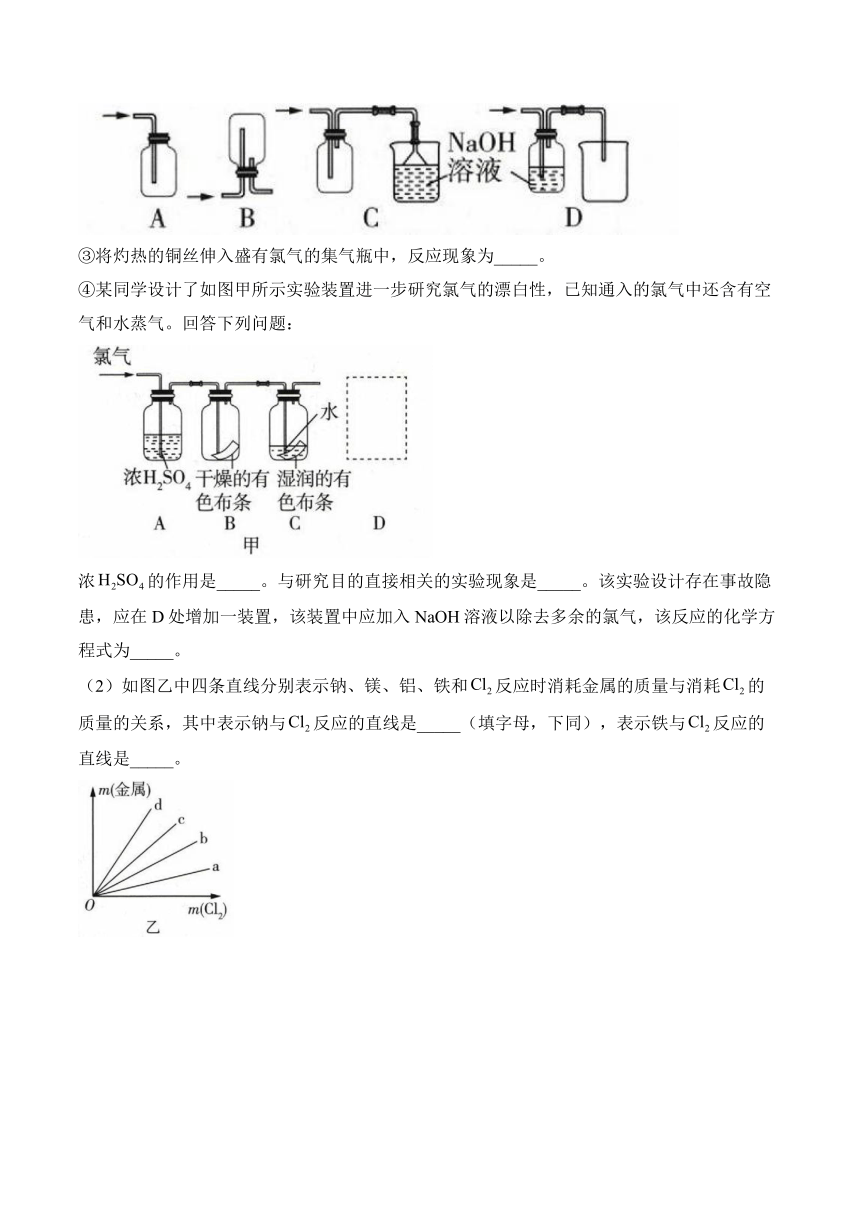
1.下列物质与反应,能发出苍白色火焰的是( )
A. B.Na C.Fe D.Cu
2.下列关于氯气的叙述中,不正确的是( )
A.无色有刺激性气味的气体 B.能溶于水
C.常温常压下密度比空气的大 D.可与金属钠反应
3.潮湿的氯气能使有色布条褪色是由于它能生成( )
A.氯气 B.次氯酸 C.次氯酸根 D.氯化氢
4.下列说法不正确的是( )
A.观察氯水的颜色,发现氯水呈黄绿色,说明氯水中存在
B.氢气可以在氯气中燃烧,产生苍白色火焰,瓶口有白雾生成
C.钠在氯气中燃烧,产生棕黄色烟
D.工业上漂白粉是由氯气通入冷的石灰乳中制得
5.时,1体积的水可溶解约2体积的氯气。下列实验现象不能证明氯气与水发生了化学反应的是( )
A.试管内液面上升 B.出现白色沉淀
C.仅湿润布条褪色 D.新制氯水
6.一种检验某气体化学性质的实验装置如图,图中B为开关。如先关闭B,在A处缓缓通入潮湿的氯气,C处红色布条颜色没有变化;当打开B时,C处红色布条颜色褪去。则D瓶中盛有的溶液不可能是( )
A.浓硫酸 B.饱和溶液 C.石灰乳 D.浓溶液
7.某同学在pH试纸上滴几滴新制氯水,现象如图所示,有关该实验的说法中正确的是( )
A.该实验说明因具有强氧化性能漂白试纸
B.该实验说明扩散速度比HClO快
C.将实验后的pH试纸在酒精灯上微热,试纸又恢复为原来的颜色
D.若用久置的氯水进行实验,现象相同
8.在新制氯水中存在多种分子和离子,它们在不同的反应中表现出各自的性质。下列实验现象和结论一致且正确的是( )
A.新制氯水呈浅黄绿色,且有刺激性气味,说明溶液中有分子存在
B.用强光照射新制氯水一段时间后,溶液增大,说明溶液中有存在
C.将加入新制氯水中,有无色气泡产生,说明溶液中有存在
D.溶液中滴加新制氯水,溶液变成棕黄色,说明新制氯水中有存在
9.市售“84消毒液”显碱性,其有效成分是。下列分析错误的是( )
A.制备“84消毒液”的离子方程式:
B.加入溶液有沉淀生成,证明“84消毒液”中含有
C.消毒液作用于物体表面时适当放置一段时间效果更好
D.用次氯酸盐代替做消毒剂,存储更方便、使用更安全
10.下图是氯元素的“价-类”二维图,据此下列分析正确的是( )
A.由“价-类”二维图推测具有强氧化性,可与水反应生成两种强酸
B.可用pH试纸分别测定等浓度的和HClO溶液的pH,比较酸性强弱
C.洁厕灵(主要成分HCl)与84消毒液反应会产生有毒气体故不能混合使用
D.常用于炸药、火箭推进剂的某种强氧化剂在“价-类”二维图中的位置为
11.数字化实验将传感器、数据采集器和计算机相连,可利用信息技术对化学实验进行数据的采集和分析。如图是数字化实验得到的光照过程中氯水的变化情况。对此,下列有关说法正确的是( )
A.随着对氯水光照时间的延长,氯水的漂白性将增强
B.光照使氯水中的次氯酸分解为盐酸,溶液的酸性增强
C.光照过程中,氯水减小的同时,溶液中的浓度也不断减小
D.减小的主要原因是光照引起了溶解度的减小,氯气逸出
12.根据氯及其化合物的性质回答下列问题。
(1)新制氯水和漂白粉都有漂白作用,也可用于水体的杀菌消毒。
①工业上利用氯气和石灰乳反应可制得漂白粉,漂白粉在空气中容易变质的原因为_______(用化学方程式表示)。
②下列收集的正确装置是_______(填装置字母)。
③将灼热的铜丝伸入盛有氯气的集气瓶中,反应现象为_____。
④某同学设计了如图甲所示实验装置进一步研究氯气的漂白性,已知通入的氯气中还含有空气和水蒸气。回答下列问题:
浓的作用是_____。与研究目的直接相关的实验现象是_____。该实验设计存在事故隐患,应在D处增加一装置,该装置中应加入NaOH溶液以除去多余的氯气,该反应的化学方程式为_____。
(2)如图乙中四条直线分别表示钠、镁、铝、铁和反应时消耗金属的质量与消耗的质量的关系,其中表示钠与反应的直线是_____(填字母,下同),表示铁与反应的直线是_____。
答案以及解析
1.答案:A
解析:A.纯净的在的集气瓶中安静地燃烧,发出苍白色火焰,瓶口有白雾出现,A符合题意;
B.Na与在加热条件下发生反应,呈现黄色火焰,B不符合题意;
C.Fe与在加热条件下发生反应,生成棕褐色的烟,不会发出苍白色火焰,C不符合题意;
D.Cu与在加热条件下发生反应,生成棕黄色的烟,不会发出苍白色火焰,D不符合题意;
故选A。
2.答案:A
解析:A.氯气为黄绿色气体,A错误;
B.氯气可以与水反应生成HCl和HClO,能溶于水,B正确;
C.氯气的相对分子质量为71,空气的平均相对分子质量约为29,相同条件下,气体的密度之比等于其相对分子质量之比,故相同条件下氯气的密度比空气的大,C正确;
D.可与金属钠反应生成氯化钠,D正确;
故选A。
3.答案:B
解析:氯气与水反应生成次氯酸,次氯酸具有强氧化性,能使有色布条褪色;故答案选B。
4.答案:C
解析:A.氯气与水的反应为可逆反应,氯水呈黄绿色,说明氯水中存在分子,A正确;
B.氢气在氯气中安静燃烧,火焰为苍白色,瓶口有白雾生成,B正确;
C.钠在氯气中燃烧,发出黄光、产生大量白烟,C错误;
D.氯气通入石灰乳制得以主要成分为氯化钙、次氯酸钙的漂白粉,D正确;
故选C。
5.答案:A
解析:A.由题目信息可知,氯气能溶于水,也可以使试管内液面上升,不能证明氯气和水发生了反应,A错误;
B.硝酸酸化的硝酸银溶液中产生白色沉淀,说明产生了氯离子,从而证明氯气和水发生了反应,B错误;
C.干燥的氯气不能使干燥的红布条褪色,仅湿润的红布条褪色,说明产生了漂白性物质,证明氯气和水发生了反应,C错误;
D.新制氯水,说明产生了氢离子,说明生成了酸性物质,证明氯气和水发生了反应,D正确;
故选A。
6.答案:B
解析:A.浓硫酸干燥氯气,因此C中通入干燥的氯气,不能使红色布条褪色,打开B时,湿润的氯气将C处红色布条颜色褪去,D可能是浓硫酸,故A不符合题意;
B.饱和溶液,氯气通入后在通入到C处,红色布条褪色,因此D中不能盛装饱和食盐水,故B符合题意;
C.石灰乳和氯气反应,消耗氯气,因此C不能使红色布条褪色,关闭B,湿润的氯气将C处红色布条颜色褪去,D可能是石灰乳,故C不符合题意;
D.浓溶液与氯气反应,消耗氯气,因此C不能使红色布条褪色,关闭B,湿润的氯气将C处红色布条颜色褪去,D可能是浓的氢氧化钠溶液,故D不符合题意。
综上所述,答案为B。
7.答案:B
解析:A.氯气分子不具有漂白性,氯气与水反应生成次氯酸具有漂白性,故A错误;
B.由实验可知,滴加氯水的区域变白色,而周围变成浅红色,可说明的扩散速度比HClO分子快,故B正确;
C.次氯酸的漂白性不具有可逆性,加热不能恢复到原来的颜色,故C错误;
D.久置的氯水主要成分为稀盐酸,无漂白性,故D错误;
故答案选B。
8.答案:C
解析:新制氯水呈浅黄绿色,说明氯水中含,A错误;光照时HClO转化为HCl和,溶液酸性增强,即pH减小,B错误;发生的反应为,可说明溶液中有,C正确;也可把氧化为,不能说明新制氯水中有,D错误。
9.答案:B
解析:A.制备84消毒液将通入到NaOH溶液中生成NaCl、NaClO和水,离子方程式为,A正确;
B.“84消毒液”显碱性,加入溶液有沉淀生成,可能是氢氧化银,不一定是AgCl,无法证明“84消毒液”中含有,B错误;
C.“84”消毒液在空气中放置一段时间,与空气中的二氧化碳和水反应生成次氯酸,漂白效果更好,反应的离子方程式为:,HClO浓度增大,漂白效果增强,C正确;
D.氯气是有毒气体,次氯酸盐性质稳定,用次氯酸盐代替做消毒剂,存储更方便、使用更安全,D正确;
故选B。
10.答案:C
解析:A.中Cl为+1价、N为+5价,O为-2价,+1价的Cl和+5价的N都有强氧化性,所以具有强氧化性,可水解生成硝酸和次氯酸,但次氯酸属于弱酸,A错误;
B.HClO具有漂白性,不能用pH试纸测定HClO溶液的pH,B错误;
C.洁厕灵(主要成分:HCl)与“84”消毒液(主要成分NaClO)混合发生反应,产生有毒气体氯气,可能发生危险发生中毒事故,C正确;
D.“价-类”二维图中的位置(盐,-1)表示氯元素-1价的盐,该盐中氯元素没有氧化性,D错误;
故答案为:C。
11.答案:B
解析:A.随着对氯水光照时间的延长,氯水中分解,氯水的漂白性减弱,A错误;
B.不稳定,光照下分解生成和,溶液中浓度增加,酸性增强,B正确;
C.光照下,分解生成和,溶液中浓度增加,溶液的减小,C错误;
D.减小的主要原因是,光照下,分解生成和,溶液中浓度减小,促进反应的平衡向正向移动,溶液中浓度增大,浓度增大,D错误;
故选B。
12.答案:(1)①;②C;③剧烈燃烧,产生棕黄色的烟;④干燥氯气B中干燥的有色布条无明显变化,C中湿润的有色布条褪色
(2)d;c
解析:(1)①漂白粉在空气中容易变质的原因是次氯酸钙与空气中的二氧化碳和水蒸气反应生成碳酸钙和次氯酸,次氯酸在光照下可分解成氯化氢和氧气。②集气瓶中使用单孔橡胶塞塞紧,只能进气,不能排气,则瓶内压强增大到一定程度会将橡胶塞弹出,A项错误;的密度比空气的大,应从短管口进,B项错误;该装置既能收集,又能进行尾气处理且防倒吸,C项正确;Cl2能与NaOH反应,收集不到,D项错误。③将灼热的铜丝伸入盛有氯气的集气瓶中,反应现象为剧烈燃烧,产生棕黄色的烟。④浓的作用是干燥氯气,干燥的氯气不具有漂白性,氯气与水反应生成的次氯酸具有漂白性,能使有色布条褪色,故与研究目的直接相关的实验现象是B中干燥的有色布条无明显变化,C中湿润的有色布条褪色;用NaOH溶液除去多余氯气的化学方程式为。
(2)钠、镁、铝、铁与反应的化学方程式分别为、、、,消耗等质量的时所需金属的质量大小关系为,故表示钠与反应的直线是d,表示铁与反应的直线是c。
1.下列物质与反应,能发出苍白色火焰的是( )
A. B.Na C.Fe D.Cu
2.下列关于氯气的叙述中,不正确的是( )
A.无色有刺激性气味的气体 B.能溶于水
C.常温常压下密度比空气的大 D.可与金属钠反应
3.潮湿的氯气能使有色布条褪色是由于它能生成( )
A.氯气 B.次氯酸 C.次氯酸根 D.氯化氢
4.下列说法不正确的是( )
A.观察氯水的颜色,发现氯水呈黄绿色,说明氯水中存在
B.氢气可以在氯气中燃烧,产生苍白色火焰,瓶口有白雾生成
C.钠在氯气中燃烧,产生棕黄色烟
D.工业上漂白粉是由氯气通入冷的石灰乳中制得
5.时,1体积的水可溶解约2体积的氯气。下列实验现象不能证明氯气与水发生了化学反应的是( )
A.试管内液面上升 B.出现白色沉淀
C.仅湿润布条褪色 D.新制氯水
6.一种检验某气体化学性质的实验装置如图,图中B为开关。如先关闭B,在A处缓缓通入潮湿的氯气,C处红色布条颜色没有变化;当打开B时,C处红色布条颜色褪去。则D瓶中盛有的溶液不可能是( )
A.浓硫酸 B.饱和溶液 C.石灰乳 D.浓溶液
7.某同学在pH试纸上滴几滴新制氯水,现象如图所示,有关该实验的说法中正确的是( )
A.该实验说明因具有强氧化性能漂白试纸
B.该实验说明扩散速度比HClO快
C.将实验后的pH试纸在酒精灯上微热,试纸又恢复为原来的颜色
D.若用久置的氯水进行实验,现象相同
8.在新制氯水中存在多种分子和离子,它们在不同的反应中表现出各自的性质。下列实验现象和结论一致且正确的是( )
A.新制氯水呈浅黄绿色,且有刺激性气味,说明溶液中有分子存在
B.用强光照射新制氯水一段时间后,溶液增大,说明溶液中有存在
C.将加入新制氯水中,有无色气泡产生,说明溶液中有存在
D.溶液中滴加新制氯水,溶液变成棕黄色,说明新制氯水中有存在
9.市售“84消毒液”显碱性,其有效成分是。下列分析错误的是( )
A.制备“84消毒液”的离子方程式:
B.加入溶液有沉淀生成,证明“84消毒液”中含有
C.消毒液作用于物体表面时适当放置一段时间效果更好
D.用次氯酸盐代替做消毒剂,存储更方便、使用更安全
10.下图是氯元素的“价-类”二维图,据此下列分析正确的是( )
A.由“价-类”二维图推测具有强氧化性,可与水反应生成两种强酸
B.可用pH试纸分别测定等浓度的和HClO溶液的pH,比较酸性强弱
C.洁厕灵(主要成分HCl)与84消毒液反应会产生有毒气体故不能混合使用
D.常用于炸药、火箭推进剂的某种强氧化剂在“价-类”二维图中的位置为
11.数字化实验将传感器、数据采集器和计算机相连,可利用信息技术对化学实验进行数据的采集和分析。如图是数字化实验得到的光照过程中氯水的变化情况。对此,下列有关说法正确的是( )
A.随着对氯水光照时间的延长,氯水的漂白性将增强
B.光照使氯水中的次氯酸分解为盐酸,溶液的酸性增强
C.光照过程中,氯水减小的同时,溶液中的浓度也不断减小
D.减小的主要原因是光照引起了溶解度的减小,氯气逸出
12.根据氯及其化合物的性质回答下列问题。
(1)新制氯水和漂白粉都有漂白作用,也可用于水体的杀菌消毒。
①工业上利用氯气和石灰乳反应可制得漂白粉,漂白粉在空气中容易变质的原因为_______(用化学方程式表示)。
②下列收集的正确装置是_______(填装置字母)。
③将灼热的铜丝伸入盛有氯气的集气瓶中,反应现象为_____。
④某同学设计了如图甲所示实验装置进一步研究氯气的漂白性,已知通入的氯气中还含有空气和水蒸气。回答下列问题:
浓的作用是_____。与研究目的直接相关的实验现象是_____。该实验设计存在事故隐患,应在D处增加一装置,该装置中应加入NaOH溶液以除去多余的氯气,该反应的化学方程式为_____。
(2)如图乙中四条直线分别表示钠、镁、铝、铁和反应时消耗金属的质量与消耗的质量的关系,其中表示钠与反应的直线是_____(填字母,下同),表示铁与反应的直线是_____。
答案以及解析
1.答案:A
解析:A.纯净的在的集气瓶中安静地燃烧,发出苍白色火焰,瓶口有白雾出现,A符合题意;
B.Na与在加热条件下发生反应,呈现黄色火焰,B不符合题意;
C.Fe与在加热条件下发生反应,生成棕褐色的烟,不会发出苍白色火焰,C不符合题意;
D.Cu与在加热条件下发生反应,生成棕黄色的烟,不会发出苍白色火焰,D不符合题意;
故选A。
2.答案:A
解析:A.氯气为黄绿色气体,A错误;
B.氯气可以与水反应生成HCl和HClO,能溶于水,B正确;
C.氯气的相对分子质量为71,空气的平均相对分子质量约为29,相同条件下,气体的密度之比等于其相对分子质量之比,故相同条件下氯气的密度比空气的大,C正确;
D.可与金属钠反应生成氯化钠,D正确;
故选A。
3.答案:B
解析:氯气与水反应生成次氯酸,次氯酸具有强氧化性,能使有色布条褪色;故答案选B。
4.答案:C
解析:A.氯气与水的反应为可逆反应,氯水呈黄绿色,说明氯水中存在分子,A正确;
B.氢气在氯气中安静燃烧,火焰为苍白色,瓶口有白雾生成,B正确;
C.钠在氯气中燃烧,发出黄光、产生大量白烟,C错误;
D.氯气通入石灰乳制得以主要成分为氯化钙、次氯酸钙的漂白粉,D正确;
故选C。
5.答案:A
解析:A.由题目信息可知,氯气能溶于水,也可以使试管内液面上升,不能证明氯气和水发生了反应,A错误;
B.硝酸酸化的硝酸银溶液中产生白色沉淀,说明产生了氯离子,从而证明氯气和水发生了反应,B错误;
C.干燥的氯气不能使干燥的红布条褪色,仅湿润的红布条褪色,说明产生了漂白性物质,证明氯气和水发生了反应,C错误;
D.新制氯水,说明产生了氢离子,说明生成了酸性物质,证明氯气和水发生了反应,D正确;
故选A。
6.答案:B
解析:A.浓硫酸干燥氯气,因此C中通入干燥的氯气,不能使红色布条褪色,打开B时,湿润的氯气将C处红色布条颜色褪去,D可能是浓硫酸,故A不符合题意;
B.饱和溶液,氯气通入后在通入到C处,红色布条褪色,因此D中不能盛装饱和食盐水,故B符合题意;
C.石灰乳和氯气反应,消耗氯气,因此C不能使红色布条褪色,关闭B,湿润的氯气将C处红色布条颜色褪去,D可能是石灰乳,故C不符合题意;
D.浓溶液与氯气反应,消耗氯气,因此C不能使红色布条褪色,关闭B,湿润的氯气将C处红色布条颜色褪去,D可能是浓的氢氧化钠溶液,故D不符合题意。
综上所述,答案为B。
7.答案:B
解析:A.氯气分子不具有漂白性,氯气与水反应生成次氯酸具有漂白性,故A错误;
B.由实验可知,滴加氯水的区域变白色,而周围变成浅红色,可说明的扩散速度比HClO分子快,故B正确;
C.次氯酸的漂白性不具有可逆性,加热不能恢复到原来的颜色,故C错误;
D.久置的氯水主要成分为稀盐酸,无漂白性,故D错误;
故答案选B。
8.答案:C
解析:新制氯水呈浅黄绿色,说明氯水中含,A错误;光照时HClO转化为HCl和,溶液酸性增强,即pH减小,B错误;发生的反应为,可说明溶液中有,C正确;也可把氧化为,不能说明新制氯水中有,D错误。
9.答案:B
解析:A.制备84消毒液将通入到NaOH溶液中生成NaCl、NaClO和水,离子方程式为,A正确;
B.“84消毒液”显碱性,加入溶液有沉淀生成,可能是氢氧化银,不一定是AgCl,无法证明“84消毒液”中含有,B错误;
C.“84”消毒液在空气中放置一段时间,与空气中的二氧化碳和水反应生成次氯酸,漂白效果更好,反应的离子方程式为:,HClO浓度增大,漂白效果增强,C正确;
D.氯气是有毒气体,次氯酸盐性质稳定,用次氯酸盐代替做消毒剂,存储更方便、使用更安全,D正确;
故选B。
10.答案:C
解析:A.中Cl为+1价、N为+5价,O为-2价,+1价的Cl和+5价的N都有强氧化性,所以具有强氧化性,可水解生成硝酸和次氯酸,但次氯酸属于弱酸,A错误;
B.HClO具有漂白性,不能用pH试纸测定HClO溶液的pH,B错误;
C.洁厕灵(主要成分:HCl)与“84”消毒液(主要成分NaClO)混合发生反应,产生有毒气体氯气,可能发生危险发生中毒事故,C正确;
D.“价-类”二维图中的位置(盐,-1)表示氯元素-1价的盐,该盐中氯元素没有氧化性,D错误;
故答案为:C。
11.答案:B
解析:A.随着对氯水光照时间的延长,氯水中分解,氯水的漂白性减弱,A错误;
B.不稳定,光照下分解生成和,溶液中浓度增加,酸性增强,B正确;
C.光照下,分解生成和,溶液中浓度增加,溶液的减小,C错误;
D.减小的主要原因是,光照下,分解生成和,溶液中浓度减小,促进反应的平衡向正向移动,溶液中浓度增大,浓度增大,D错误;
故选B。
12.答案:(1)①;②C;③剧烈燃烧,产生棕黄色的烟;④干燥氯气B中干燥的有色布条无明显变化,C中湿润的有色布条褪色
(2)d;c
解析:(1)①漂白粉在空气中容易变质的原因是次氯酸钙与空气中的二氧化碳和水蒸气反应生成碳酸钙和次氯酸,次氯酸在光照下可分解成氯化氢和氧气。②集气瓶中使用单孔橡胶塞塞紧,只能进气,不能排气,则瓶内压强增大到一定程度会将橡胶塞弹出,A项错误;的密度比空气的大,应从短管口进,B项错误;该装置既能收集,又能进行尾气处理且防倒吸,C项正确;Cl2能与NaOH反应,收集不到,D项错误。③将灼热的铜丝伸入盛有氯气的集气瓶中,反应现象为剧烈燃烧,产生棕黄色的烟。④浓的作用是干燥氯气,干燥的氯气不具有漂白性,氯气与水反应生成的次氯酸具有漂白性,能使有色布条褪色,故与研究目的直接相关的实验现象是B中干燥的有色布条无明显变化,C中湿润的有色布条褪色;用NaOH溶液除去多余氯气的化学方程式为。
(2)钠、镁、铝、铁与反应的化学方程式分别为、、、,消耗等质量的时所需金属的质量大小关系为,故表示钠与反应的直线是d,表示铁与反应的直线是c。
