1.2.1电解质的电离——高一化学人教版(2019)必修一同步课时作业(含解析)
文档属性
| 名称 | 1.2.1电解质的电离——高一化学人教版(2019)必修一同步课时作业(含解析) |  | |
| 格式 | docx | ||
| 文件大小 | 343.3KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2025-07-03 09:11:46 | ||
图片预览




文档简介
1.2.1电解质的电离——高一化学人教版(2019)必修一同步课时作业
1.下列物质不属于电解质的是( )
A.蔗糖 B.氢氧化钠 C.碳酸钙 D.硫酸钾
2.下列物质中不能导电的是( )
A.钠单质 B.硫酸溶液 C.乙醇 D.熔融
3.下列物质在水中电离方程式正确的是( )
A. B.
C. D.
4.下列关于电解质的叙述正确的是( )
A.溶于水得到的溶液能导电的化合物都是电解质
B.溶液在电流作用下电离成与
C.硫酸溶液的导电性一定比醋酸溶液导电性强
D.氧化镁虽然不溶于水,但是熔融状态下能发生电离,所以氧化镁是电解质
5.根据中学对电解质、非电解质的定义判断下列叙述正确的是( )
A.石墨有较好的导电性,因此它属于电解质
B.实验测定的水溶液均能导电,所以均是电解质
C.蔗糖在水溶液里和熔融状态下均不能导电,所以蔗糖属于非电解质
D.实验测定液态HCl、固体NaCl均不能导电,所以HCl、NaCl均是非电解质
6.导体中自由的带电微粒在电场作用下发生定向移动从而形成电流,如金属铜、熔融的NaCl、NaCl溶液都是导体。下列说法正确的是( )
A.因为金属有较好的导电性,所以它属于电解质
B.电解质都能电离产生离子,因此都属于导体
C.水分子或加热至熔融态都会使氯化钠发生电离
D.液态氯化氢不能导电,故氯化氢不属于电解质
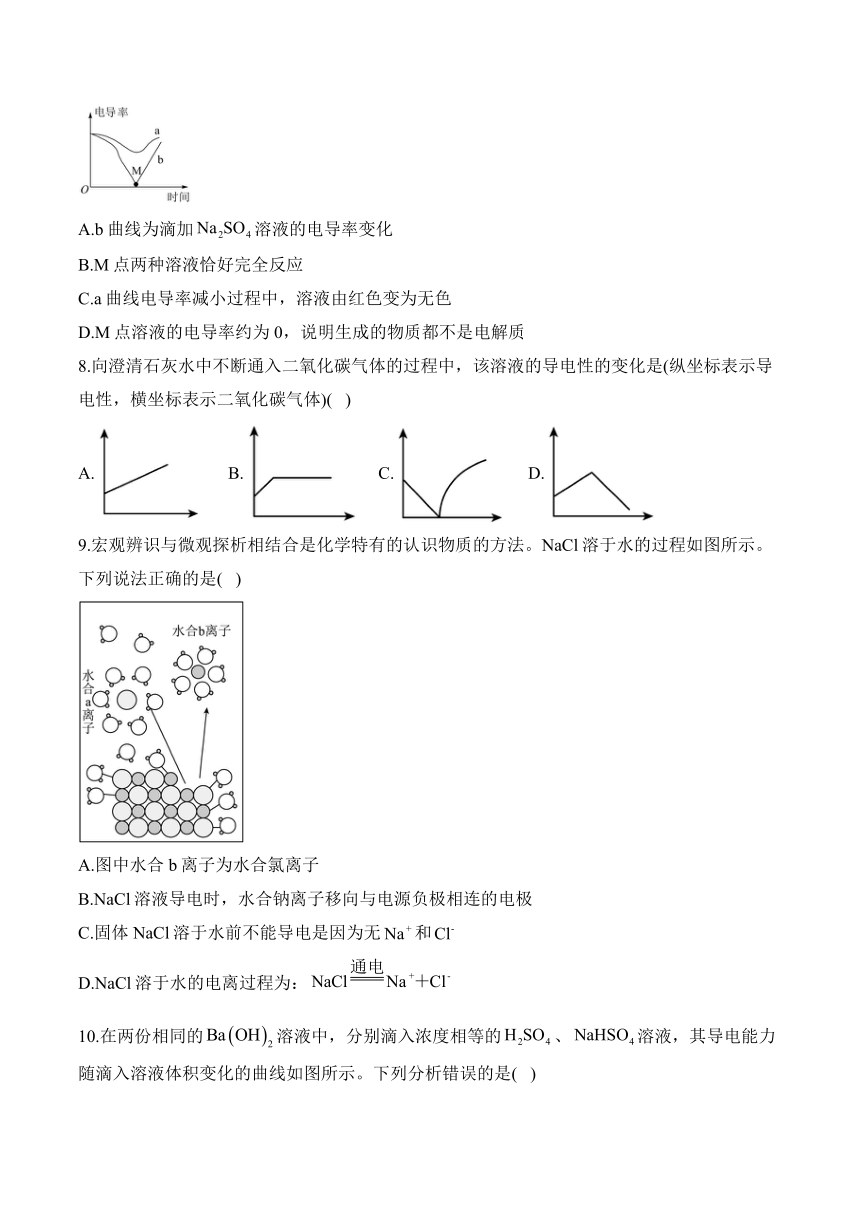
7.现有两等份含有酚酞的溶液,分别滴加稀、溶液,滴加速率始终相同,测得溶液的电导率随时间变化如图所示(单位体积溶液中离子所带电荷总数越多,电导率越大)。下列说法正确的是( )
A.b曲线为滴加溶液的电导率变化
B.M点两种溶液恰好完全反应
C.a曲线电导率减小过程中,溶液由红色变为无色
D.M点溶液的电导率约为0,说明生成的物质都不是电解质
8.向澄清石灰水中不断通入二氧化碳气体的过程中,该溶液的导电性的变化是(纵坐标表示导电性,横坐标表示二氧化碳气体)( )
A. B. C. D.
9.宏观辨识与微观探析相结合是化学特有的认识物质的方法。NaCl溶于水的过程如图所示。下列说法正确的是( )
A.图中水合b离子为水合氯离子
B.NaCl溶液导电时,水合钠离子移向与电源负极相连的电极
C.固体NaCl溶于水前不能导电是因为无和
D.NaCl溶于水的电离过程为:
10.在两份相同的溶液中,分别滴入浓度相等的、溶液,其导电能力随滴入溶液体积变化的曲线如图所示。下列分析错误的是( )
A.a、b两点均沉淀完全,a点对应溶液显中性,b点溶液显碱性
B.反应的离子方程式为:
C.d点所加溶液体积是a点的两倍
D.b→d反应的离子方程式为:
11.向溶液中滴入几滴酚酞溶液,然后匀速逐滴加入稀硫酸,测得混合溶液的电导率变化的曲线如图。下列说法不正确的是( )
A.若向原溶液中滴加和硫酸浓度相同的硫酸钠溶液,预测电导率变化图相同
B.实验中观察到溶液由红色变成无色,并产生白色沉淀
C.B点时溶液与稀硫酸恰好完全反应
D.B点之后电导率增加的原因是混合溶液中和的浓度增加
12.现有下列物质①碳酸氢钠晶体;②氧化钠;③二氧化碳;④铝;⑤液氧;⑥熔融;⑦稀硫酸;⑧酒精;⑨氯化氢;⑩氨水; 碳酸钠溶液; 氢氧化钡溶液; 硫酸氢钠晶体。
(1)以上物质能导电的是__________;属于电解质的是__________;属于非电解质的是__________。
(2)写出物质 溶于水的电离方程式:__________。
(3)写出④与⑦反应的离子方程式__________。
(4)上述物质中有两种物质之间可发生离子反应:,该离子反应对应的化学方程式为__________。
(5)将足量的③通入澄清石灰水中,发生总反应的离子方程式为__________。
答案以及解析
1.答案:A
解析:电解质:蔗糖为非电解质,其他均为电解质。
2.答案:C
解析:A.钠单质含有可自由移动的电子,能导电,A不符合题意;
B.硫酸溶液有可自由移动的离子,能导电,B不符合题意;
C.乙醇不含可自由移动的离子或电子,不能导电,C符合题意;
D.熔融有可自由移动的离子,能导电,D不符合题意;
故选C。
3.答案:D
解析:A.硫酸氢钠是强酸的酸式盐,在水中电离方程式为,A错误;
B.碳酸钠是盐,电离方程式为,B错误;
C.氢氧化钠是一元强碱,电离方程式为,C错误;
D.氯化钡是盐,电离方程式为,D正确;
答案选D。
4.答案:D
解析:A.溶于水得到的溶液能导电的化合物不一定都是电解质,例如二氧化碳等酸性氧化物由分子构成、在液态时不导电,溶于水生成酸溶液会导电、但二氧化碳等酸性氧化物自身不提供自由离子,故酸性氧化物属于非电解质,故A错误;
B.氯化钠溶液在通电的条件下发生电解,生成氯气、氢气以及氢氧化钠,电离不需要通电,故B错误;
C.电解质溶液的导电性与溶液中离子浓度以及离子所带电荷多少有关,与酸性强弱无关,则硫酸溶液的导电性不一定比醋酸溶液导电性强,故C错误;
D.电解质的定义为:在水溶液里或熔融状态下自身能导电的化合物叫作电解质,氧化镁虽然不溶于水,但是熔融状态下能发生电离,所以氧化镁是电解质,故D正确;
故答案选D。
5.答案:C
解析:A.在水溶液或熔融状态下能导电的化合物是电解质,石墨是单质,既不是电解质也不是非电解质,A错误;
B.、的水溶液均能导电,溶液中的离子是由、电离产生的,不是、电离的,所以、是非电解质,B错误;
C.蔗糖在水溶液里和熔融状态下均不能导电的化合物,属于非电解质,C正确;
D.液态HCl、固体NaCl均不能导电,但它们在水溶液里能电离出自由移动的离子而导电,故两者均是电解质,D错误;
故选C。
6.答案:C
解析:A.电解质一定是化合物,金属是单质,不属于电解质,A错误;
B.电解质没有电离时不导电,不属于导体,B错误;
C.氯化钠溶于水或熔融状态下都能导电,即都能发生电离,C正确;
D.虽然液态氯化氢不能导电,但其溶于水能导电,故HCl属于电解质,D错误;
故答案选C。
7.答案:B
解析:A.b曲线M点导电性几乎为0,所以为滴加溶液的电导率变化,故A错误;
B.b曲线M点导电性几乎为0,溶液中离子浓度几乎为0,M点两种溶液恰好完全反应,故B正确;
C.a曲线电导率减小过程中,发生反应溶液和反应生成硫酸钡沉淀和氢氧化钠,溶液始终为碱性,溶液始终呈红色,故C错误;
D.M点溶液,生成物为硫酸钡和水,硫酸钡、水都是电解质,故D错误;
选B。
8.答案:C
解析:根据题意知,随着不断通入,发生的化学反应为:①;②;当不足量或恰好反应时,发生的反应是①,碳酸钙是沉淀,水是弱电解质,随着反应的进行导致溶液中离子浓度逐渐减小,导电能力逐渐减弱;当继续通入二氧化碳时发生的反应是②,生成的碳酸氢钙是强电解质,易溶于水,能电离出自由移动的离子,溶液中离子浓度逐渐增大,导电能力逐渐增强;当溶液饱和时,离子浓度最大,导电能力最强,继续通入二氧化碳对导电能力几乎无影响;
正确选项C。
9.答案:B
解析:A.氯离子半径大于钠离子半径,且靠近氯离子一侧的氢原子,靠近钠离子一侧的是氧原子,则水合b离子为水合钠离子,水合a离子为水合氯离子,A项错误;
B.水合离子为带电电荷,其定向运动,产生电流,是水溶液导电的原因,NaCl溶液导电时,水合钠离子移向与电源负极相连的电极,B项正确;
C.氯化钠固体中存在和,和之间存在强烈的相互作用(离子键),则离子不能自由移动,故固体NaCl溶于水前不能导电,C项错误;
D.由图可知NaCl在水分子作用下就发生电离,不需要通电,NaCl溶于水发生电离:,D项错误;
故选B。
10.答案:B
解析:溶液和溶液反应方程式分别为,、,溶液导电能力与离子浓度成正比,根据图知,曲线①在a点溶液导电能力接近0,说明该点溶液离子浓度最小,应该为溶液和的反应,则曲线②为溶液和溶液的反应,根据图知,a点为溶液和恰好反应,溶液的物质的量浓度相等,则b点发生;c点,①中稀硫酸过量,溶质为硫酸,②中反应后溶质为NaOH、;a点①中硫酸和氢氧化钡恰好完全反应,溶液中只含水;d点②中溶质为。
A.a点①中硫酸和氢氧化钡恰好完全反应,溶液中只含水,因此呈中性,b点发生,此时溶质为氢氧化钠,因此溶液呈碱性,A正确;
B.由分析可知,曲线①对应的离子方程式为,曲线②对应的b点时加入的与物质的量之比为1:1,此时恰好沉淀完,而被中和一半,对应离子方程式为:,继续加入,对应的离子方程式为,B错误;
C.由分析可知,a点和按物质的量之比为1:1恰好完全反应,d点是和按物质的量之比为2:1恰好完全反应,则d点所加溶液体积是a点的两倍,C正确;
D.由选项B可知,b→d反应的离子方程式为:,D正确;
故选B。
11.答案:A
解析:A.用硫酸钠溶液代替重复上述实验,生成的氢氧化钠溶于水完全电离成自由移动的离子能导电,溶液导电能力随时间变化与图2不同,A错误;
B.硫酸和氢氧化钡反应生成硫酸钡沉淀和水,碱性变弱直至为酸性,故观察到溶液由红色变成无色,并产生白色沉淀,B正确;
C.B时刻溶液与稀硫酸恰好完全反应,C正确;
D.B点两者恰好反应,之后硫酸过量,故电导率增加的原因是混合溶液中和的浓度增加,D正确;
故选A。
12.答案:(1)④⑥⑦⑩ ;①②⑥⑨ ;③⑧
(2)
(3)
(4)
(5)
解析:在水中或者熔融状态下能导电的化合物是电解质;在水中和熔融状态下都不能导电的化合物是非电解质;酸碱盐和金属氧化物为电解质,非金属氧化物、某些有机物等是非电解质;单质、混合物既不是电解质也不是非电解质;
①碳酸氢钠晶体为电解质,不导电;
②氧化钠为电解质,不导电;
③二氧化碳为非电解质,不导电;
④铝是单质,既不是电解质也不是非电解质,导电;
⑤液氧是单质,既不是电解质也不是非电解质,不导电;
⑥熔融为电解质,导电;
⑦稀硫酸是混合物,既不是电解质也不是非电解质,导电;
⑧酒精为非电解质,不导电;
⑨氯化氢为电解质,不导电;
⑩氨水是混合物,既不是电解质也不是非电解质,导电;
碳酸钠溶液是混合物,既不是电解质也不是非电解质,导电;
氢氧化钡溶液是混合物,既不是电解质也不是非电解质,导电;
硫酸氢钠晶体为电解质,不导电;
(1)根据以上分析可知:能导电的物质是④⑥⑦⑩ ;属于电解质的是:①②⑥⑨ ;属于非电解质的是:③⑧。
(2)是强电解质,在水溶液中电离出和硫酸根离子,电离方程式为:。
(3)铝与稀硫酸反应生成硫酸铝和氢气,离子方程式为;
(4)该离子方程式表示强酸与强碱反应生成可溶性盐和水,则化学方程式为;
(5)足量的通入澄清的石灰水生成和水,反应的离子方程式为:。
1.下列物质不属于电解质的是( )
A.蔗糖 B.氢氧化钠 C.碳酸钙 D.硫酸钾
2.下列物质中不能导电的是( )
A.钠单质 B.硫酸溶液 C.乙醇 D.熔融
3.下列物质在水中电离方程式正确的是( )
A. B.
C. D.
4.下列关于电解质的叙述正确的是( )
A.溶于水得到的溶液能导电的化合物都是电解质
B.溶液在电流作用下电离成与
C.硫酸溶液的导电性一定比醋酸溶液导电性强
D.氧化镁虽然不溶于水,但是熔融状态下能发生电离,所以氧化镁是电解质
5.根据中学对电解质、非电解质的定义判断下列叙述正确的是( )
A.石墨有较好的导电性,因此它属于电解质
B.实验测定的水溶液均能导电,所以均是电解质
C.蔗糖在水溶液里和熔融状态下均不能导电,所以蔗糖属于非电解质
D.实验测定液态HCl、固体NaCl均不能导电,所以HCl、NaCl均是非电解质
6.导体中自由的带电微粒在电场作用下发生定向移动从而形成电流,如金属铜、熔融的NaCl、NaCl溶液都是导体。下列说法正确的是( )
A.因为金属有较好的导电性,所以它属于电解质
B.电解质都能电离产生离子,因此都属于导体
C.水分子或加热至熔融态都会使氯化钠发生电离
D.液态氯化氢不能导电,故氯化氢不属于电解质
7.现有两等份含有酚酞的溶液,分别滴加稀、溶液,滴加速率始终相同,测得溶液的电导率随时间变化如图所示(单位体积溶液中离子所带电荷总数越多,电导率越大)。下列说法正确的是( )
A.b曲线为滴加溶液的电导率变化
B.M点两种溶液恰好完全反应
C.a曲线电导率减小过程中,溶液由红色变为无色
D.M点溶液的电导率约为0,说明生成的物质都不是电解质
8.向澄清石灰水中不断通入二氧化碳气体的过程中,该溶液的导电性的变化是(纵坐标表示导电性,横坐标表示二氧化碳气体)( )
A. B. C. D.
9.宏观辨识与微观探析相结合是化学特有的认识物质的方法。NaCl溶于水的过程如图所示。下列说法正确的是( )
A.图中水合b离子为水合氯离子
B.NaCl溶液导电时,水合钠离子移向与电源负极相连的电极
C.固体NaCl溶于水前不能导电是因为无和
D.NaCl溶于水的电离过程为:
10.在两份相同的溶液中,分别滴入浓度相等的、溶液,其导电能力随滴入溶液体积变化的曲线如图所示。下列分析错误的是( )
A.a、b两点均沉淀完全,a点对应溶液显中性,b点溶液显碱性
B.反应的离子方程式为:
C.d点所加溶液体积是a点的两倍
D.b→d反应的离子方程式为:
11.向溶液中滴入几滴酚酞溶液,然后匀速逐滴加入稀硫酸,测得混合溶液的电导率变化的曲线如图。下列说法不正确的是( )
A.若向原溶液中滴加和硫酸浓度相同的硫酸钠溶液,预测电导率变化图相同
B.实验中观察到溶液由红色变成无色,并产生白色沉淀
C.B点时溶液与稀硫酸恰好完全反应
D.B点之后电导率增加的原因是混合溶液中和的浓度增加
12.现有下列物质①碳酸氢钠晶体;②氧化钠;③二氧化碳;④铝;⑤液氧;⑥熔融;⑦稀硫酸;⑧酒精;⑨氯化氢;⑩氨水; 碳酸钠溶液; 氢氧化钡溶液; 硫酸氢钠晶体。
(1)以上物质能导电的是__________;属于电解质的是__________;属于非电解质的是__________。
(2)写出物质 溶于水的电离方程式:__________。
(3)写出④与⑦反应的离子方程式__________。
(4)上述物质中有两种物质之间可发生离子反应:,该离子反应对应的化学方程式为__________。
(5)将足量的③通入澄清石灰水中,发生总反应的离子方程式为__________。
答案以及解析
1.答案:A
解析:电解质:蔗糖为非电解质,其他均为电解质。
2.答案:C
解析:A.钠单质含有可自由移动的电子,能导电,A不符合题意;
B.硫酸溶液有可自由移动的离子,能导电,B不符合题意;
C.乙醇不含可自由移动的离子或电子,不能导电,C符合题意;
D.熔融有可自由移动的离子,能导电,D不符合题意;
故选C。
3.答案:D
解析:A.硫酸氢钠是强酸的酸式盐,在水中电离方程式为,A错误;
B.碳酸钠是盐,电离方程式为,B错误;
C.氢氧化钠是一元强碱,电离方程式为,C错误;
D.氯化钡是盐,电离方程式为,D正确;
答案选D。
4.答案:D
解析:A.溶于水得到的溶液能导电的化合物不一定都是电解质,例如二氧化碳等酸性氧化物由分子构成、在液态时不导电,溶于水生成酸溶液会导电、但二氧化碳等酸性氧化物自身不提供自由离子,故酸性氧化物属于非电解质,故A错误;
B.氯化钠溶液在通电的条件下发生电解,生成氯气、氢气以及氢氧化钠,电离不需要通电,故B错误;
C.电解质溶液的导电性与溶液中离子浓度以及离子所带电荷多少有关,与酸性强弱无关,则硫酸溶液的导电性不一定比醋酸溶液导电性强,故C错误;
D.电解质的定义为:在水溶液里或熔融状态下自身能导电的化合物叫作电解质,氧化镁虽然不溶于水,但是熔融状态下能发生电离,所以氧化镁是电解质,故D正确;
故答案选D。
5.答案:C
解析:A.在水溶液或熔融状态下能导电的化合物是电解质,石墨是单质,既不是电解质也不是非电解质,A错误;
B.、的水溶液均能导电,溶液中的离子是由、电离产生的,不是、电离的,所以、是非电解质,B错误;
C.蔗糖在水溶液里和熔融状态下均不能导电的化合物,属于非电解质,C正确;
D.液态HCl、固体NaCl均不能导电,但它们在水溶液里能电离出自由移动的离子而导电,故两者均是电解质,D错误;
故选C。
6.答案:C
解析:A.电解质一定是化合物,金属是单质,不属于电解质,A错误;
B.电解质没有电离时不导电,不属于导体,B错误;
C.氯化钠溶于水或熔融状态下都能导电,即都能发生电离,C正确;
D.虽然液态氯化氢不能导电,但其溶于水能导电,故HCl属于电解质,D错误;
故答案选C。
7.答案:B
解析:A.b曲线M点导电性几乎为0,所以为滴加溶液的电导率变化,故A错误;
B.b曲线M点导电性几乎为0,溶液中离子浓度几乎为0,M点两种溶液恰好完全反应,故B正确;
C.a曲线电导率减小过程中,发生反应溶液和反应生成硫酸钡沉淀和氢氧化钠,溶液始终为碱性,溶液始终呈红色,故C错误;
D.M点溶液,生成物为硫酸钡和水,硫酸钡、水都是电解质,故D错误;
选B。
8.答案:C
解析:根据题意知,随着不断通入,发生的化学反应为:①;②;当不足量或恰好反应时,发生的反应是①,碳酸钙是沉淀,水是弱电解质,随着反应的进行导致溶液中离子浓度逐渐减小,导电能力逐渐减弱;当继续通入二氧化碳时发生的反应是②,生成的碳酸氢钙是强电解质,易溶于水,能电离出自由移动的离子,溶液中离子浓度逐渐增大,导电能力逐渐增强;当溶液饱和时,离子浓度最大,导电能力最强,继续通入二氧化碳对导电能力几乎无影响;
正确选项C。
9.答案:B
解析:A.氯离子半径大于钠离子半径,且靠近氯离子一侧的氢原子,靠近钠离子一侧的是氧原子,则水合b离子为水合钠离子,水合a离子为水合氯离子,A项错误;
B.水合离子为带电电荷,其定向运动,产生电流,是水溶液导电的原因,NaCl溶液导电时,水合钠离子移向与电源负极相连的电极,B项正确;
C.氯化钠固体中存在和,和之间存在强烈的相互作用(离子键),则离子不能自由移动,故固体NaCl溶于水前不能导电,C项错误;
D.由图可知NaCl在水分子作用下就发生电离,不需要通电,NaCl溶于水发生电离:,D项错误;
故选B。
10.答案:B
解析:溶液和溶液反应方程式分别为,、,溶液导电能力与离子浓度成正比,根据图知,曲线①在a点溶液导电能力接近0,说明该点溶液离子浓度最小,应该为溶液和的反应,则曲线②为溶液和溶液的反应,根据图知,a点为溶液和恰好反应,溶液的物质的量浓度相等,则b点发生;c点,①中稀硫酸过量,溶质为硫酸,②中反应后溶质为NaOH、;a点①中硫酸和氢氧化钡恰好完全反应,溶液中只含水;d点②中溶质为。
A.a点①中硫酸和氢氧化钡恰好完全反应,溶液中只含水,因此呈中性,b点发生,此时溶质为氢氧化钠,因此溶液呈碱性,A正确;
B.由分析可知,曲线①对应的离子方程式为,曲线②对应的b点时加入的与物质的量之比为1:1,此时恰好沉淀完,而被中和一半,对应离子方程式为:,继续加入,对应的离子方程式为,B错误;
C.由分析可知,a点和按物质的量之比为1:1恰好完全反应,d点是和按物质的量之比为2:1恰好完全反应,则d点所加溶液体积是a点的两倍,C正确;
D.由选项B可知,b→d反应的离子方程式为:,D正确;
故选B。
11.答案:A
解析:A.用硫酸钠溶液代替重复上述实验,生成的氢氧化钠溶于水完全电离成自由移动的离子能导电,溶液导电能力随时间变化与图2不同,A错误;
B.硫酸和氢氧化钡反应生成硫酸钡沉淀和水,碱性变弱直至为酸性,故观察到溶液由红色变成无色,并产生白色沉淀,B正确;
C.B时刻溶液与稀硫酸恰好完全反应,C正确;
D.B点两者恰好反应,之后硫酸过量,故电导率增加的原因是混合溶液中和的浓度增加,D正确;
故选A。
12.答案:(1)④⑥⑦⑩ ;①②⑥⑨ ;③⑧
(2)
(3)
(4)
(5)
解析:在水中或者熔融状态下能导电的化合物是电解质;在水中和熔融状态下都不能导电的化合物是非电解质;酸碱盐和金属氧化物为电解质,非金属氧化物、某些有机物等是非电解质;单质、混合物既不是电解质也不是非电解质;
①碳酸氢钠晶体为电解质,不导电;
②氧化钠为电解质,不导电;
③二氧化碳为非电解质,不导电;
④铝是单质,既不是电解质也不是非电解质,导电;
⑤液氧是单质,既不是电解质也不是非电解质,不导电;
⑥熔融为电解质,导电;
⑦稀硫酸是混合物,既不是电解质也不是非电解质,导电;
⑧酒精为非电解质,不导电;
⑨氯化氢为电解质,不导电;
⑩氨水是混合物,既不是电解质也不是非电解质,导电;
碳酸钠溶液是混合物,既不是电解质也不是非电解质,导电;
氢氧化钡溶液是混合物,既不是电解质也不是非电解质,导电;
硫酸氢钠晶体为电解质,不导电;
(1)根据以上分析可知:能导电的物质是④⑥⑦⑩ ;属于电解质的是:①②⑥⑨ ;属于非电解质的是:③⑧。
(2)是强电解质,在水溶液中电离出和硫酸根离子,电离方程式为:。
(3)铝与稀硫酸反应生成硫酸铝和氢气,离子方程式为;
(4)该离子方程式表示强酸与强碱反应生成可溶性盐和水,则化学方程式为;
(5)足量的通入澄清的石灰水生成和水,反应的离子方程式为:。
