苏教版高中化学必修二 课件:专题二第一单元化学反应速率和限度(共46张PPT)
文档属性
| 名称 | 苏教版高中化学必修二 课件:专题二第一单元化学反应速率和限度(共46张PPT) |  | |
| 格式 | zip | ||
| 文件大小 | 589.6KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 苏教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2016-07-03 13:23:19 | ||
图片预览











文档简介
课件46张PPT。专题2化学反应与能量第一单元 化学反应的
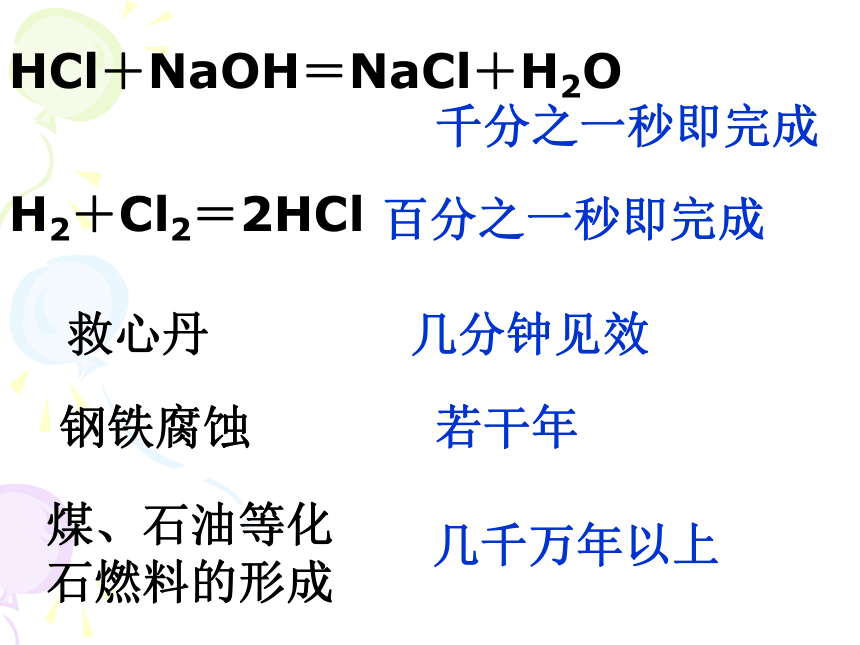
速率和限度化学反应有快有慢:HCl+NaOH=NaCl+H2O千分之一秒即完成H2+Cl2=2HCl百分之一秒即完成救心丹几分钟见效钢铁腐蚀若干年煤、石油等化石燃料的形成几千万年以上定义: 化学反应速率用单位时间(如每秒,每分,每小时)内反应物浓度的减小或生成物浓度的增大来表示。计算式:一、化学反应速率 (物质的量浓度)练习巩固= 0.3mol/(L·s)v (NH3) ==例题:反应4NH3+5O2 4NO+6H2O 在5升的密闭容器中进行,30秒后,NO 的物质的量增加了0.3mol,此反应的平均反应速率用NO来表示为多少?问题1:若用O2的浓度变化来表示此反应速率是多少? 若用NH3 来表示呢?问题2:此反应化学反应速率用不同物质表示为什么数值不同?数值上有何规律?v(NO)=0.002mol/L·sv(O2)=0.0025mol/L·sv(NH3)=0.002mol/L·s化学反应速率的特点—①同一反应,可用不同物质在单位时间
内浓度的变化来表示,但必须指明是
用哪种反应物或哪种生成物来表示。
②用不同物质在单位时间内浓度变化表
示时,速率比等于方程式中的系数比
③均取正值,且是某一段时间内的平均
速率。练习向一个容积为1L的密闭容器中放入2moLSO2和1moLO2,在一定条件下反应,2S末,测得容器内有0.8moLSO2,求2S内SO2,O2,SO3的反应速率和反应速率比.练习2在一定条件下,mA+nB=pC的反应中,各物质的化学反应速率为V(A)=amol·L-1·s-1,
V(B)=a/2mol·L-1·s-1,
V(C)=amol·L-1·s-1,
则该反应的化学方程式是 。2A+B=2C练习
则该反应速率的快慢顺序为:反应 A + 3B = 2C + 2D 在四种不同条件下的反应速率为:(1)ν(A)=0.3mol/(L·s )(2) ν(B)=0.6mol/(L·s)(3) ν(C)=0.4mol/(L·s)(4) ν(D)=0.45mol/(L·s)(1)>(4)>(2)=(3)反思:比较反应的快慢,应取同一参照物 在相同条件下,等质量(金属颗粒大小相
同)的下列金属与足量1mol/L 盐酸反应时,
速率最快的是
A 镁 B 铝 C 钠 D 铁二、影响化学反应速率的因素§化学反应速率是由反应物的性质决定的;
内因是主要因素外因因素:实验2-5产生气泡速率增大,
带火星火柴 复燃升高温度,
反应速率增大有气泡冒出产生气泡速率减小降低温度,
反应速率减小规律:当其它条件不变时,升高温度,化学反应速率增大。降低温度,化学反应速率减小。
实验测得,温度每升高10度,化学反应速率通常增大原来的2~4倍。
注意:温度对反应速率的影响不受反应物状态的限制。
(1)温度对化学反应速率的影响实验2-6气泡冒出速率增大气泡冒出速率增大有气泡冒出,较慢MnO2能加快
反应速率FeCl3能加快
反应速率无催化剂
反应较慢外因因素:规律:催化剂能改变化学反应的速率。
有的催化剂能加快化学反应的速率,叫正催化剂;有的催化剂能减慢化学反应速率,叫负催化剂。在实践中,如没有特殊说明,凡说催化剂都是指正催化剂。
催化剂中毒:催化剂的催化性能往往因接触少量的杂质而明显下降甚至遭破坏,这种现象叫催化剂中毒。
催化剂只有在一定的温度下才能最大限度的显示其催化作用,不同的催化剂对温度的要求不一样。(2)催化剂对化学反应速率的影响规律:当其它条件不变时,增大反应物的浓度,化学反应速率增大。减小反应物的浓度,化学反应速率减慢。(3)浓度对化学反应速率的影响规律:当其它条件不变时,增大固体反应物的表面积,化学反应速率增大。减小固体反应物的表面积,化学反应速率减慢。(4)固体反应物的表面积对化学反应速率的 影响(5)其他条件对化学反应速率的影响练习: 1、在2L的密闭容器中,发生下列反应: 3A(g)+ B(g)=2C(g)+D(g)。若最初加入的A 和B 都是4mol,在前10s A 的平均反应速率为0.12mol/(L·s),则10s时,容器中B的物质的量为 。 3.2mol 某温度时在2L容器中X、Y、Z三种物质的物质的量随时间的变化曲线如图所示。由图中数据分析:
1、反应开始2min内的X、Y、Z的化学反应速率
2、该反应的化学方程式为:___________。把镁条投入到盛有盐酸的敞口容器中,产
生氢气的速率变化如图,分析其原因: 练习:在25℃时,向100mL含HCl 14.6g的盐酸中,放入5.6g铁粉,反应进行到2s时收集到氢气1.12L(标况),之后反应又进行了4s,铁粉全溶解。若不考虑体积变化,则:
(1)前2s内用FeCl2表示的平均反应速率为 ;
(2)后4s内用HCl表示的平均反应速率为 ;
(3)前2s与后4s比较,反应速率 较快,其原因可能 。0.25mol/L·s0.25mol/L·s前2s前2s时段盐酸浓度比后4s时段大 为了研究碳酸钙与稀盐酸反应的反应速率,一位同学通过实验测定反应中生成的CO2气体体积随反应时间变化的情况,绘制如图曲线。请分析讨论以下问题。(1)在0~t1、t1~t2、t2~t3各相同的时间段里,反应速率最大的是__________时间段,收集到气体最多的是_________时间段。(2)试分析三个时间段里,反应速率不同的可能原因(该反应是放热反应)。
(3)在t4后,为什么收集到的气体的体积不再增加? ⑵开始时C(H+)大,该反应的反应速率大; t1—t2由于反应放热温度升高,所以速率迅速增大;最后是因为C(H+)减小了,反应速率减慢.第二章化学反应与能量第三节 化学反应的
速率和限度思考? 我们知道在化学反应中,反应物之间是按照化学方程式中的系数比进行反应的,那么,在实际反应中,反应物能否按相应的计量关系完全转化为生成物呢?§ 氯水是氯气的水溶液,氯气能与水反应,而且这是一个可逆反应。请大家回忆氯水中含有哪些微粒。氯水的成份:
分子:Cl2 、HClO 、H2O
离子:H+ 、 Cl- 、ClO- 等什么叫做可逆反应? 在同一条件下,既向正反应方向进行,
同时又向逆反应方向进行的反应.典型的可逆反应有:启示:化学反应是有限度的,有些能进行地较彻底,有些反应是不彻底的,甚至是可逆的。N2 + H2 NH3 在一固定容积的密闭容器里,加1molN2和
3mol H2 (合适催化剂),能发生什么反应?(1)开始时c(N2) 、c(H2)大, c(NH3) =0开始阶段有什么特征?只有正反应,v(逆)=0N2 + H2 NH3(2)瞬间后c(N2) 、c(H2 )变小 , c(NH3)≠0瞬间过后有什么特征?正逆反应都进行,v(逆) ≠0,v(正)> v(逆) (3)c(N2) 、c(H2)逐渐变小,c(NH3)逐渐增大,
三种物质的浓度达到一个特定值。一定时间段内有什么特征?v(正)= v(逆) ≠0N2 + H2 NH3 由于v(正)= v(逆) ≠0,虽然正、逆反应都在进行,但各种物质的百分含量、浓度都不会发生变化. 从外表上看,反应好象“停止”。
可逆反应的这种特殊状态就是我们今天要研究的化学平衡状态。(1)0~t1:v(正)>v(逆)(2)t1: v(正)=v(逆)平衡状态交流与讨论1、定义 在一定条件下的可逆反应中,当正反应速率和逆反应速率相等,反应混合物中各组分的浓度保持不变的状态。前提(适用范围):可逆反应内在本质:v(正)= v(逆) ≠0外在标志:反应混合物中各组分
的浓度保持不变二、化学平衡状态2、化学平衡状态的特征(3)动:动态平衡(v(正)= v(逆) ≠0)(2)等:v(正)= v(逆) (4)定:反应混合物中各组分的浓度保持 定,各组分的含量保持不变。(5)变:条件改变,原平衡被破坏,在新
的条件下建立新的平衡。(1)逆此条件下进行到什么时候达到了这个反应的限度?
此时的反应是否停止了?
此时为何3种物质的浓度保持不变? 某温度和压强下的密闭容器中,2SO2+O2 2SO3练习
可逆反应达到平衡的重要特征( )
A.反应停止了
B.正、逆反应速率都为零
C.反应物和生成物的浓度相等
D.正、逆反应的速率相等D对于可逆反应M+N Q达到平衡状态时,
下列说法正确的是( ) A. M、N、Q三种物质的浓度一定相等
B. M、N全部变成了Q
C. M、N、Q的浓度都保持不变
D. 反应已经停止C下列说法可以证明反应N2+3H2 2NH3
已达平衡状态的是 ( )
A.1个N≡N键断裂的同时,有3个H-H键形成
B.1个N≡N键断裂的同时,有3个H-H键断裂
C.1个N≡N键断裂的同时,有6个N-H键断裂
D.1个N≡N键断裂的同时,有6个N-H键形成A、C 随堂练习在一定温度下,可逆反应A(g)+3B(g) 2C(g)
达到平衡的标志是( )
A. A的生成速率与C分解的速率相等
B. 单位时间内生成nmolA,同时生3nmolB
C. A、B、C的浓度不再变化
D. A、B、C的分子数比为1:3:2C14CO2 + C CO,达到化学平衡后,
平衡混合物中含14C的粒子有 。14CO2、14C、14CO3、化学平衡状态的判定对于可逆反应m A(g) n B(g) + p C(g) 在一定条件下达到平衡状态有以下几个标志(1)A的生成速率和分解速率相等(2)单位时间生成n mol B和p mol C的同时,生成m mol A(3)A、B、C的物质的量不再改变(4)A、B、C的浓度不再改变(5)A、B、C的百分含量不再改变练习:
在密闭容器中充入4mol HI,在一定温度下,反应
2HI (g) H2 (g)+I2 (g)
达到平衡时,有30%的HI分解,则
平衡时混合气体中氢气的物质的量为多少,
混合气体总物质的量为多少? 化学平衡计算的一般步骤: “三步曲”1.写出有关平衡的化学方程式2.找出各物质的 起始量 转化量 平衡量3 根据已知条件列式反应物的转化率在合成氨工业中,由a mol氮气, b mol氢气混合反应达到平衡,有 c mol 氨气生成,则氨气在反应混合物中所占的体积分数为 c / (a+b-c) × 100%三、化学反应条件的控制促进有利的反应、抑制有害的反应定义:可逆反应中,旧化学平衡的破坏,新化学平衡建立过程叫做化学平衡的移动。V正≠V逆V正=V逆≠0条件改变 平衡1 不平衡 平衡2建立新平衡破坏旧平衡V正=V逆≠0一定时间§ 影响化学平衡的条件
一、化学平衡的移动
V正 > V逆 平衡向正反应方向移动V正 = V逆 平衡不移动V正 < V逆 平衡向逆反应方向移动探究实验1
FeCl3 + 3 KSCN Fe(SCN)3 + 3KCl (黄色) (无色) (红色) (无色)现象:向第一支试管里加入几滴 FeCl3 溶液,颜色加深。
向第二支试管里加入几滴 KSCN 溶液,颜色加深。 1、浓度对化学平衡的影响 1、浓度对化学平衡的影响分析t1t2t3应用 增大反应物浓度或减小生成物浓度,平衡向正反应方向移动;增大生成物浓度或减小反应物浓度,平衡向逆反应方向移动;结论 在生产上,往往采用增大容易取得的或成本较低的反应物浓度的方法,使成本较高的原料得到充分利用。2SO2 + O2 2SO3增大反应物的浓度对化学平衡的影响【思考练习】 1、 Fe(NO3)2溶液呈浅绿色,其中存在着下列平衡:Fe2++2H2O Fe(OH)2+2H+ 往该溶液中滴加盐酸,发生的变化( )
(A) 平衡向逆反应方向移动
(B) 平衡向正反应方向移动
(C) 溶液由浅绿色变成黄色
(D) Fe2+物质的量增大 A D 2、温度对化学平衡的影响结论:其它条件不变的情况下,温度升高,平衡向吸热反应方向移动;温度降低,平衡向放热反应方向移动。催化剂对化学平衡无影响催化剂同等程度的加快或减慢正、逆反应速率(V正=V逆);对化学平衡无影响。t时间(b)催化剂能缩短平衡到达的时间合成氨反应3H2+N2 2NH3(放热反应),原平衡体系的温度为50℃,现将体系置于100℃的环境中,
问:(1)平衡向何方向移动?
(2)达平衡后体系温度为多少?
速率和限度化学反应有快有慢:HCl+NaOH=NaCl+H2O千分之一秒即完成H2+Cl2=2HCl百分之一秒即完成救心丹几分钟见效钢铁腐蚀若干年煤、石油等化石燃料的形成几千万年以上定义: 化学反应速率用单位时间(如每秒,每分,每小时)内反应物浓度的减小或生成物浓度的增大来表示。计算式:一、化学反应速率 (物质的量浓度)练习巩固= 0.3mol/(L·s)v (NH3) ==例题:反应4NH3+5O2 4NO+6H2O 在5升的密闭容器中进行,30秒后,NO 的物质的量增加了0.3mol,此反应的平均反应速率用NO来表示为多少?问题1:若用O2的浓度变化来表示此反应速率是多少? 若用NH3 来表示呢?问题2:此反应化学反应速率用不同物质表示为什么数值不同?数值上有何规律?v(NO)=0.002mol/L·sv(O2)=0.0025mol/L·sv(NH3)=0.002mol/L·s化学反应速率的特点—①同一反应,可用不同物质在单位时间
内浓度的变化来表示,但必须指明是
用哪种反应物或哪种生成物来表示。
②用不同物质在单位时间内浓度变化表
示时,速率比等于方程式中的系数比
③均取正值,且是某一段时间内的平均
速率。练习向一个容积为1L的密闭容器中放入2moLSO2和1moLO2,在一定条件下反应,2S末,测得容器内有0.8moLSO2,求2S内SO2,O2,SO3的反应速率和反应速率比.练习2在一定条件下,mA+nB=pC的反应中,各物质的化学反应速率为V(A)=amol·L-1·s-1,
V(B)=a/2mol·L-1·s-1,
V(C)=amol·L-1·s-1,
则该反应的化学方程式是 。2A+B=2C练习
则该反应速率的快慢顺序为:反应 A + 3B = 2C + 2D 在四种不同条件下的反应速率为:(1)ν(A)=0.3mol/(L·s )(2) ν(B)=0.6mol/(L·s)(3) ν(C)=0.4mol/(L·s)(4) ν(D)=0.45mol/(L·s)(1)>(4)>(2)=(3)反思:比较反应的快慢,应取同一参照物 在相同条件下,等质量(金属颗粒大小相
同)的下列金属与足量1mol/L 盐酸反应时,
速率最快的是
A 镁 B 铝 C 钠 D 铁二、影响化学反应速率的因素§化学反应速率是由反应物的性质决定的;
内因是主要因素外因因素:实验2-5产生气泡速率增大,
带火星火柴 复燃升高温度,
反应速率增大有气泡冒出产生气泡速率减小降低温度,
反应速率减小规律:当其它条件不变时,升高温度,化学反应速率增大。降低温度,化学反应速率减小。
实验测得,温度每升高10度,化学反应速率通常增大原来的2~4倍。
注意:温度对反应速率的影响不受反应物状态的限制。
(1)温度对化学反应速率的影响实验2-6气泡冒出速率增大气泡冒出速率增大有气泡冒出,较慢MnO2能加快
反应速率FeCl3能加快
反应速率无催化剂
反应较慢外因因素:规律:催化剂能改变化学反应的速率。
有的催化剂能加快化学反应的速率,叫正催化剂;有的催化剂能减慢化学反应速率,叫负催化剂。在实践中,如没有特殊说明,凡说催化剂都是指正催化剂。
催化剂中毒:催化剂的催化性能往往因接触少量的杂质而明显下降甚至遭破坏,这种现象叫催化剂中毒。
催化剂只有在一定的温度下才能最大限度的显示其催化作用,不同的催化剂对温度的要求不一样。(2)催化剂对化学反应速率的影响规律:当其它条件不变时,增大反应物的浓度,化学反应速率增大。减小反应物的浓度,化学反应速率减慢。(3)浓度对化学反应速率的影响规律:当其它条件不变时,增大固体反应物的表面积,化学反应速率增大。减小固体反应物的表面积,化学反应速率减慢。(4)固体反应物的表面积对化学反应速率的 影响(5)其他条件对化学反应速率的影响练习: 1、在2L的密闭容器中,发生下列反应: 3A(g)+ B(g)=2C(g)+D(g)。若最初加入的A 和B 都是4mol,在前10s A 的平均反应速率为0.12mol/(L·s),则10s时,容器中B的物质的量为 。 3.2mol 某温度时在2L容器中X、Y、Z三种物质的物质的量随时间的变化曲线如图所示。由图中数据分析:
1、反应开始2min内的X、Y、Z的化学反应速率
2、该反应的化学方程式为:___________。把镁条投入到盛有盐酸的敞口容器中,产
生氢气的速率变化如图,分析其原因: 练习:在25℃时,向100mL含HCl 14.6g的盐酸中,放入5.6g铁粉,反应进行到2s时收集到氢气1.12L(标况),之后反应又进行了4s,铁粉全溶解。若不考虑体积变化,则:
(1)前2s内用FeCl2表示的平均反应速率为 ;
(2)后4s内用HCl表示的平均反应速率为 ;
(3)前2s与后4s比较,反应速率 较快,其原因可能 。0.25mol/L·s0.25mol/L·s前2s前2s时段盐酸浓度比后4s时段大 为了研究碳酸钙与稀盐酸反应的反应速率,一位同学通过实验测定反应中生成的CO2气体体积随反应时间变化的情况,绘制如图曲线。请分析讨论以下问题。(1)在0~t1、t1~t2、t2~t3各相同的时间段里,反应速率最大的是__________时间段,收集到气体最多的是_________时间段。(2)试分析三个时间段里,反应速率不同的可能原因(该反应是放热反应)。
(3)在t4后,为什么收集到的气体的体积不再增加? ⑵开始时C(H+)大,该反应的反应速率大; t1—t2由于反应放热温度升高,所以速率迅速增大;最后是因为C(H+)减小了,反应速率减慢.第二章化学反应与能量第三节 化学反应的
速率和限度思考? 我们知道在化学反应中,反应物之间是按照化学方程式中的系数比进行反应的,那么,在实际反应中,反应物能否按相应的计量关系完全转化为生成物呢?§ 氯水是氯气的水溶液,氯气能与水反应,而且这是一个可逆反应。请大家回忆氯水中含有哪些微粒。氯水的成份:
分子:Cl2 、HClO 、H2O
离子:H+ 、 Cl- 、ClO- 等什么叫做可逆反应? 在同一条件下,既向正反应方向进行,
同时又向逆反应方向进行的反应.典型的可逆反应有:启示:化学反应是有限度的,有些能进行地较彻底,有些反应是不彻底的,甚至是可逆的。N2 + H2 NH3 在一固定容积的密闭容器里,加1molN2和
3mol H2 (合适催化剂),能发生什么反应?(1)开始时c(N2) 、c(H2)大, c(NH3) =0开始阶段有什么特征?只有正反应,v(逆)=0N2 + H2 NH3(2)瞬间后c(N2) 、c(H2 )变小 , c(NH3)≠0瞬间过后有什么特征?正逆反应都进行,v(逆) ≠0,v(正)> v(逆) (3)c(N2) 、c(H2)逐渐变小,c(NH3)逐渐增大,
三种物质的浓度达到一个特定值。一定时间段内有什么特征?v(正)= v(逆) ≠0N2 + H2 NH3 由于v(正)= v(逆) ≠0,虽然正、逆反应都在进行,但各种物质的百分含量、浓度都不会发生变化. 从外表上看,反应好象“停止”。
可逆反应的这种特殊状态就是我们今天要研究的化学平衡状态。(1)0~t1:v(正)>v(逆)(2)t1: v(正)=v(逆)平衡状态交流与讨论1、定义 在一定条件下的可逆反应中,当正反应速率和逆反应速率相等,反应混合物中各组分的浓度保持不变的状态。前提(适用范围):可逆反应内在本质:v(正)= v(逆) ≠0外在标志:反应混合物中各组分
的浓度保持不变二、化学平衡状态2、化学平衡状态的特征(3)动:动态平衡(v(正)= v(逆) ≠0)(2)等:v(正)= v(逆) (4)定:反应混合物中各组分的浓度保持 定,各组分的含量保持不变。(5)变:条件改变,原平衡被破坏,在新
的条件下建立新的平衡。(1)逆此条件下进行到什么时候达到了这个反应的限度?
此时的反应是否停止了?
此时为何3种物质的浓度保持不变? 某温度和压强下的密闭容器中,2SO2+O2 2SO3练习
可逆反应达到平衡的重要特征( )
A.反应停止了
B.正、逆反应速率都为零
C.反应物和生成物的浓度相等
D.正、逆反应的速率相等D对于可逆反应M+N Q达到平衡状态时,
下列说法正确的是( ) A. M、N、Q三种物质的浓度一定相等
B. M、N全部变成了Q
C. M、N、Q的浓度都保持不变
D. 反应已经停止C下列说法可以证明反应N2+3H2 2NH3
已达平衡状态的是 ( )
A.1个N≡N键断裂的同时,有3个H-H键形成
B.1个N≡N键断裂的同时,有3个H-H键断裂
C.1个N≡N键断裂的同时,有6个N-H键断裂
D.1个N≡N键断裂的同时,有6个N-H键形成A、C 随堂练习在一定温度下,可逆反应A(g)+3B(g) 2C(g)
达到平衡的标志是( )
A. A的生成速率与C分解的速率相等
B. 单位时间内生成nmolA,同时生3nmolB
C. A、B、C的浓度不再变化
D. A、B、C的分子数比为1:3:2C14CO2 + C CO,达到化学平衡后,
平衡混合物中含14C的粒子有 。14CO2、14C、14CO3、化学平衡状态的判定对于可逆反应m A(g) n B(g) + p C(g) 在一定条件下达到平衡状态有以下几个标志(1)A的生成速率和分解速率相等(2)单位时间生成n mol B和p mol C的同时,生成m mol A(3)A、B、C的物质的量不再改变(4)A、B、C的浓度不再改变(5)A、B、C的百分含量不再改变练习:
在密闭容器中充入4mol HI,在一定温度下,反应
2HI (g) H2 (g)+I2 (g)
达到平衡时,有30%的HI分解,则
平衡时混合气体中氢气的物质的量为多少,
混合气体总物质的量为多少? 化学平衡计算的一般步骤: “三步曲”1.写出有关平衡的化学方程式2.找出各物质的 起始量 转化量 平衡量3 根据已知条件列式反应物的转化率在合成氨工业中,由a mol氮气, b mol氢气混合反应达到平衡,有 c mol 氨气生成,则氨气在反应混合物中所占的体积分数为 c / (a+b-c) × 100%三、化学反应条件的控制促进有利的反应、抑制有害的反应定义:可逆反应中,旧化学平衡的破坏,新化学平衡建立过程叫做化学平衡的移动。V正≠V逆V正=V逆≠0条件改变 平衡1 不平衡 平衡2建立新平衡破坏旧平衡V正=V逆≠0一定时间§ 影响化学平衡的条件
一、化学平衡的移动
V正 > V逆 平衡向正反应方向移动V正 = V逆 平衡不移动V正 < V逆 平衡向逆反应方向移动探究实验1
FeCl3 + 3 KSCN Fe(SCN)3 + 3KCl (黄色) (无色) (红色) (无色)现象:向第一支试管里加入几滴 FeCl3 溶液,颜色加深。
向第二支试管里加入几滴 KSCN 溶液,颜色加深。 1、浓度对化学平衡的影响 1、浓度对化学平衡的影响分析t1t2t3应用 增大反应物浓度或减小生成物浓度,平衡向正反应方向移动;增大生成物浓度或减小反应物浓度,平衡向逆反应方向移动;结论 在生产上,往往采用增大容易取得的或成本较低的反应物浓度的方法,使成本较高的原料得到充分利用。2SO2 + O2 2SO3增大反应物的浓度对化学平衡的影响【思考练习】 1、 Fe(NO3)2溶液呈浅绿色,其中存在着下列平衡:Fe2++2H2O Fe(OH)2+2H+ 往该溶液中滴加盐酸,发生的变化( )
(A) 平衡向逆反应方向移动
(B) 平衡向正反应方向移动
(C) 溶液由浅绿色变成黄色
(D) Fe2+物质的量增大 A D 2、温度对化学平衡的影响结论:其它条件不变的情况下,温度升高,平衡向吸热反应方向移动;温度降低,平衡向放热反应方向移动。催化剂对化学平衡无影响催化剂同等程度的加快或减慢正、逆反应速率(V正=V逆);对化学平衡无影响。t时间(b)催化剂能缩短平衡到达的时间合成氨反应3H2+N2 2NH3(放热反应),原平衡体系的温度为50℃,现将体系置于100℃的环境中,
问:(1)平衡向何方向移动?
(2)达平衡后体系温度为多少?
