四川省成都华西中学2024-2025学年高一下学期期末模拟考试 化学试题(含答案)
文档属性
| 名称 | 四川省成都华西中学2024-2025学年高一下学期期末模拟考试 化学试题(含答案) |  | |
| 格式 | docx | ||
| 文件大小 | 742.7KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2025-07-04 10:47:11 | ||
图片预览



文档简介
高2024级高一下期末模拟考试
化学试题
注意事项:
1.本试卷分第I卷(选择题)和第II卷(非选择题)两部分。答卷前,考生务必将自己的姓名、准考证号填写在答题卡上。
2.考试时间为75分钟,满分为100分。
3.可能用到的相对原子质量:H-1 O-16 S-32 Cu-64
第I卷(选择题,共48分)
一、选择题(本题包括16个小题,每题3分,共48分。每题只有一个选项最符合题意)
1.我国正处于迈向科技强国的关键阶段。下列关于科技成果的描述不正确的是
A.国产大飞机 C919 机身使用的铝锂合金,属于金属材料,该合金的硬度比纯铝大
B.“天宫二号”的太阳能电池帆板的主要材料是二氧化硅
C.线型结构橡胶可通过硫原子形成网状结构的硫化橡胶,后者化学稳定性更好
D.比亚迪自研的碳陶瓷刹车盘质轻和耐高温,属于新型无机非金属材料
2.下列事实中,不能用勒夏特列原理解释的是
A.夏天打开汽水瓶盖时汽水中产生大量气泡
B.验室中常用排饱和食盐水的方法收集氯气(Cl2+H2OHCl+HClO)
C.唾液可以使淀粉水解速率加快
D.工业上生产硫酸的过程中使用适当过量的空气以提高二氧化硫的利用率
3.设NA为阿伏加德罗常数的值,下列说法正确的是
A.0.5 mol甲烷和乙烯混合物中含氢原子数目为2 NA
B.标准状况下,11.2 L CHCl3中含原子数目为2.5 NA
C.2 mol浓硫酸与足量铜加热条件下发生反应转移的电子数目为2 NA
D.98 g 10%的H2SO4溶液中,所含氧原子数目为0.4 NA
4.下列对实验装置图、实验操作及结论描述正确的是
甲 乙 丙 丁
A.装置甲制取和收集少量的氨气
B.装置乙制取乙酸乙酯
C.装置丙滴入浓硫酸后一段时间,高锰酸钾溶液褪色,说明蔗糖发生了水解反应
D.装置丁可验证金属活动性:M>N
5.下列叙述错误的是
A.反应③一定为非氧化还原反应
B.若A为硝酸,则Y遇空气会变成红棕色
C.若X为S,则适量的Y可防止葡萄酒氧化变质
D.若X为非金属单质,则常温下可用铝制容器盛装A的浓溶液
6.下列图示与对应的叙述相符的是
A.图甲装置,为正极
B.图乙装置,放电时,正极b极表面的被氧化,其质量会增加
C.图丙装置,通入的一极是正极,电极反应式为
D.图丁可以表示足量稀硫酸与锌粉反应,加少量固体产生的变化
7.下列说法不正确的是
A.分子式为C5H10O2且能与碳酸氢钠反应的同分异构体有4种
B.CH4的二氯代物只有一种结构能说明甲烷是正四面体构型
C.分子式为C3H8的有机物的二氯代物的同分异构体有4种
D.C4H10O能与金属钠反应且能氧化为醛的结构有3种
8.下列离子方程式正确的是
A.向Na2SiO3溶液中通入过量CO2:
B.将等物质的量浓度的和NH4HSO4溶液以体积比混合:
C.FeO溶于稀HNO3溶液:
D.向AlCl3溶液中滴加过量NaOH溶液:
9.下列除去杂质的方法正确的是
①除去乙烷中少量的乙烯:把混合气体通入溴水中洗气
②除去乙酸乙酯中少量的乙酸:加入饱和溶液后分液
③除去中少量:把气体通过盛有饱和碳酸钠溶液的洗气瓶
④除去乙醇中少量的水:加足量生石灰,蒸馏
A.①③ B.①④ C.③④ D.②③
10.某温度下,在一恒容密闭容器中进行反应:CaC2O4(s)CaO(s)+CO2(g)+CO(g),下列情况一定能说明反应已达到平衡的是
①容器内压强不随时间而变化 ②单位时间内,消耗1 mol CO2同时生成1 mol CO
③气体的密度不随时间而变化 ④混合气体的平均摩尔质量不随时间而变化
A.①③④ B.②③④ C.①②③ D.①②④
11.在一定条件下,将和投入容积为的密闭容器中,发生如下反应:。末测得此时容器中C和D的浓度为和。下列叙述正确的是
A.
B.时,B的浓度为
C.内B的反应速率为
D.此时A的转化率为
12.对可逆反应2A(s)+3B(g) 2C(g)+2D(g) ΔH<0,在一定条件下达到平衡,下列有关叙述正确的是
①增加A的量,平衡向正反应方向移动 ②升高温度,平衡向逆反应方向移动,正减小
③压强增大一倍,平衡不移动,正、逆不变 ④增大B的浓度,正>逆
⑤加入催化剂,平衡向正反应方向移动
A.①② B.④ C.③ D.④⑤
13.在给定条件下,下列选项中所示的物质间转化均能实现的是( )
A.
B.
C.
D.
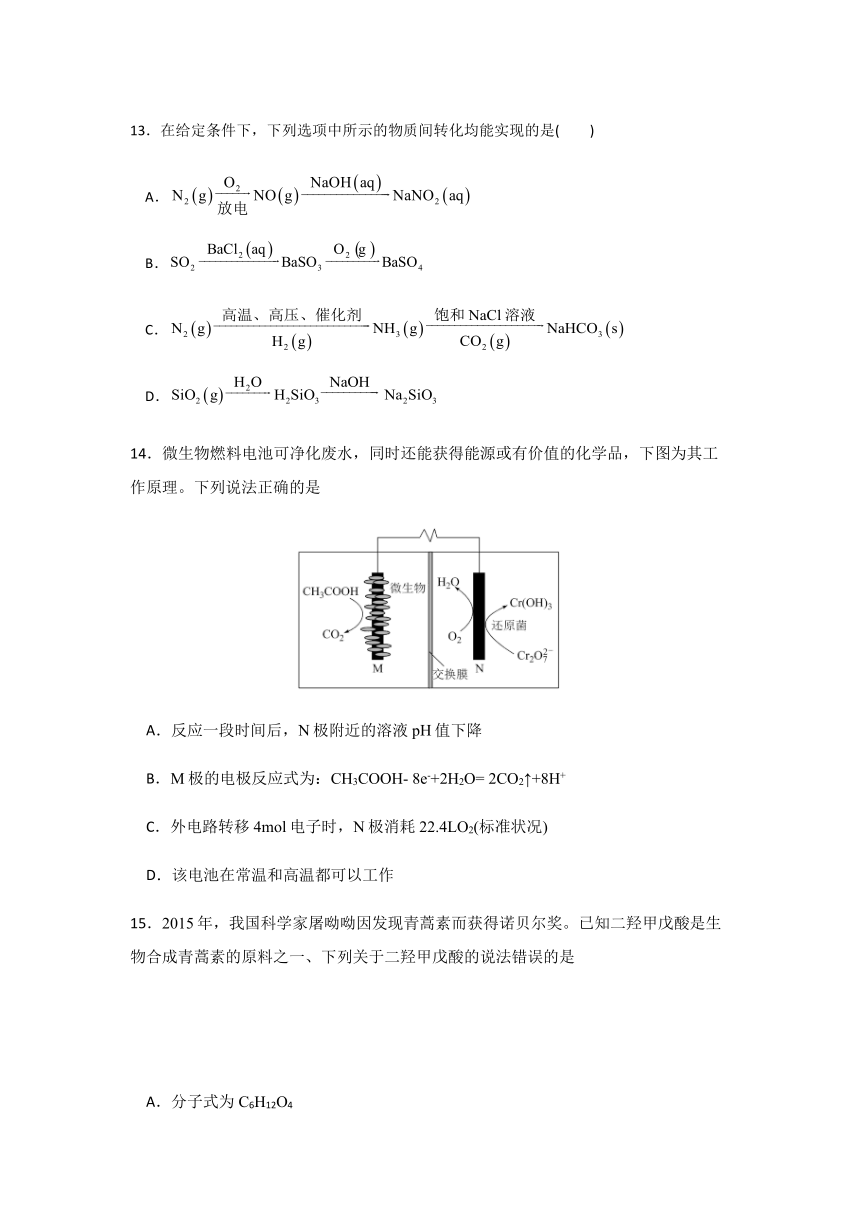
14.微生物燃料电池可净化废水,同时还能获得能源或有价值的化学品,下图为其工作原理。下列说法正确的是
A.反应一段时间后,N极附近的溶液pH值下降
B.M极的电极反应式为: CH3COOH- 8e -+2H2O= 2CO2↑+8H+
C.外电路转移4mol电子时,N极消耗22.4LO2(标准状况)
D.该电池在常温和高温都可以工作
15.2015年,我国科学家屠呦呦因发现青蒿素而获得诺贝尔奖。已知二羟甲戊酸是生物合成青蒿素的原料之一、下列关于二羟甲戊酸的说法错误的是
A.分子式为C6H12O4
B.能与NaHCO3反应生成CO2
C.能发生加成、加聚和取代反应
D.1 mol该有机物与足量Na反应产生33.6 L(标准状况) H2
16.对于反应 ,在温度为、时,平衡体系中体积分数随压强变化的曲线如图所示。下列说法不正确的是
反应速率:A平衡常数:
气体的颜色:A深、C浅
D.混合气体的平均相对分子质量:A第Ⅱ卷(非选择题,共52分)
二、非选择题:本题共4小题,共52分。
17.(12分)硫、氮元素是高中化学学习的两种重要非金属元素,其价-类二维图分别如图。
(1)图中物质“d”的化学式是 。
(2)将一定量的a气体通入下列溶液中,能观察到白色沉淀现象的是________(填标号)。
A.溶液 B.溶液 C.溶液 D.溶液
(3)写出反应③的离子方程式 。
(4)a的水溶液与发生反应可观察到的实验现象是 。
(5)写出c的浓溶液与反应的化学方程式 ,若反应中消耗了铜,
则转移 电子。
(6)如图为合成氨以及氨氧化制硝酸的流程示意图:
已知:用溶液进行尾气处理时的化学反应为:,。为了防止环境污染,用溶液进行尾气处理,若尾气能完全被吸收,则尾气中与的体积必须满足的条件是: ≥ 。
18.(14分)随着全球对可持续发展和环保材料需求的增加,聚丙烯酸乙酯(简称PEA)因其优异的生物降解性和环境友好性,正成为替代传统塑料的理想选择。近期,某科研团队以乙烯、丙烯为原料高效合成聚丙烯酸乙酯()的路线图如下:
(1)乙烯的结构简式为_______,A中所含官能团名称为_______。
(2)反应①、②的反应类型分别为_______、_______。
(3)中所有的碳原子_______一定共平面(填“是”或“否”),产物D可能有_______种结构。
(4)E可制成管道、薄膜等,E的结构简式为_______。
(5)写出物质A催化氧化的反应方程式:_______。
(6)已知B能与NaOH溶液反应,且B的分子式为,写出A与B反应生成C的反应方程式:_______。
19.(12分)某研究性学习小组利用图示装置探究氯气和氨气之间的反应情况。其中A、F分别为氨气和氯气的制取发生装置,C为纯净干燥的氯气与干燥的氨气发生反应的装置。请回答下列问题:
(1)仪器a的名称是_______。
(2)用装置F制取氯气的离子方程式为_______。
(3)请为B处框内选择合适的装置及相应的试剂:_______(填序号)。
A.球形干燥管装碱石灰 B.洗气瓶装浓硫酸
C.球形干燥管装无水 D.球形干燥管装
(4)装置E的作用是_______,装置D和E的位置_______(填“能”或“不能”)调换。
(5)实验中可观察到装置C内出现浓厚的白烟并在容器内壁凝结,另一种生成物是空气的主要成分之一,若有被氧化,则转移的电子数目为_______。
(6)报纸报道了多起卫生间清洗时,因混合使用“洁厕灵”(主要成分是盐酸)与“84”消毒液(主要成分是)发生氯气中毒的事件。试根据你的化学知识分析,原因是_______(用离子方程式表示)。
20.(14分)甲醛在医药方面有重要用途。工业上可利用反应Ⅰ:CH3OH(g)HCHO(g)+H2(g)来合成甲醛。
(1)反应Ⅱ 2CH3OH(g)+O2(g)2HCHO(g)+2H2O(g) ΔH2=-313.2 kJ·mol-1
反应Ⅲ 2H2(g)+O2(g)2H2O(g) ΔH3=-483.6 kJ·mol-1
反应Ⅰ的ΔH1= kJ·mol-1。
(2)利用反应Ⅰ合成甲醛时,为增大化学反应速率,同时提高CH3OH的平衡转化率,可采取的措施为 。
(3)T ℃时,向体积恒为2 L的密闭容器中充入8 mol CH3OH(g)发生反应Ⅰ,5 min后反应达到平衡,测得混合体系中HCHO(g)的体积分数为20%。
①下列事实不能说明该反应已达到化学平衡状态的是 (填序号)。
A.v正(HCHO)=v逆(H2) B.c(CH3OH)∶c(HCHO)∶c(H2)=1∶1∶1
C.混合气体的平均相对分子质量不变 D.混合气体的密度不变
②5 min内,v(CH3OH)= mol·L-1·min-1。
③其他条件不变时,向已达平衡的反应体系中充入1 mol CH3OH(g)和1 mol H2(g),
此时v正 (填“大于”“小于”或“等于”)v逆。
(4)甲醇是优质的清洁燃料,可制作碱性甲醇燃料电池,工作原理如下图所示;
①电极A 为燃料电池的 (填“正”或“负”)极,B电极反应式为 。
②当电路中通过2mol电子时,消耗O2的体积为 L(标准状况)。
高2024级高一下期末模拟考试
化学答案
1~16 BCADA ADBBC DBCBC C
17.(12分)(1)H2SO3(1分) (2)A
(3)3NO2+H2O=2H++2+NO
(4)溶液变浑浊,产生淡黄色沉淀
(5) Cu+2H2SO4(浓)CuSO4+SO2↑+2H2O 2(1分) (6)≥1
18.(14分)(1) ①. (1分) ②.羟基 (1分)
(2) ①.加成反应(1分) ②.取代反应 (1分)
(3) ①.是 ②.2
(4) (5)
(6)
19.(12分)(1)分液漏斗 (1分)
(2) (3)A
(4) ①.除去氯气中混有的 ②.不能 (1分)
(5)
(6)
20.(12分)(1)+85.2 (2) 升高温度
(3) BD 0.2 小于
(4) 负极(1分) O2+2H2O+4e-= 4 OH- (1分) 11.2
化学试题
注意事项:
1.本试卷分第I卷(选择题)和第II卷(非选择题)两部分。答卷前,考生务必将自己的姓名、准考证号填写在答题卡上。
2.考试时间为75分钟,满分为100分。
3.可能用到的相对原子质量:H-1 O-16 S-32 Cu-64
第I卷(选择题,共48分)
一、选择题(本题包括16个小题,每题3分,共48分。每题只有一个选项最符合题意)
1.我国正处于迈向科技强国的关键阶段。下列关于科技成果的描述不正确的是
A.国产大飞机 C919 机身使用的铝锂合金,属于金属材料,该合金的硬度比纯铝大
B.“天宫二号”的太阳能电池帆板的主要材料是二氧化硅
C.线型结构橡胶可通过硫原子形成网状结构的硫化橡胶,后者化学稳定性更好
D.比亚迪自研的碳陶瓷刹车盘质轻和耐高温,属于新型无机非金属材料
2.下列事实中,不能用勒夏特列原理解释的是
A.夏天打开汽水瓶盖时汽水中产生大量气泡
B.验室中常用排饱和食盐水的方法收集氯气(Cl2+H2OHCl+HClO)
C.唾液可以使淀粉水解速率加快
D.工业上生产硫酸的过程中使用适当过量的空气以提高二氧化硫的利用率
3.设NA为阿伏加德罗常数的值,下列说法正确的是
A.0.5 mol甲烷和乙烯混合物中含氢原子数目为2 NA
B.标准状况下,11.2 L CHCl3中含原子数目为2.5 NA
C.2 mol浓硫酸与足量铜加热条件下发生反应转移的电子数目为2 NA
D.98 g 10%的H2SO4溶液中,所含氧原子数目为0.4 NA
4.下列对实验装置图、实验操作及结论描述正确的是
甲 乙 丙 丁
A.装置甲制取和收集少量的氨气
B.装置乙制取乙酸乙酯
C.装置丙滴入浓硫酸后一段时间,高锰酸钾溶液褪色,说明蔗糖发生了水解反应
D.装置丁可验证金属活动性:M>N
5.下列叙述错误的是
A.反应③一定为非氧化还原反应
B.若A为硝酸,则Y遇空气会变成红棕色
C.若X为S,则适量的Y可防止葡萄酒氧化变质
D.若X为非金属单质,则常温下可用铝制容器盛装A的浓溶液
6.下列图示与对应的叙述相符的是
A.图甲装置,为正极
B.图乙装置,放电时,正极b极表面的被氧化,其质量会增加
C.图丙装置,通入的一极是正极,电极反应式为
D.图丁可以表示足量稀硫酸与锌粉反应,加少量固体产生的变化
7.下列说法不正确的是
A.分子式为C5H10O2且能与碳酸氢钠反应的同分异构体有4种
B.CH4的二氯代物只有一种结构能说明甲烷是正四面体构型
C.分子式为C3H8的有机物的二氯代物的同分异构体有4种
D.C4H10O能与金属钠反应且能氧化为醛的结构有3种
8.下列离子方程式正确的是
A.向Na2SiO3溶液中通入过量CO2:
B.将等物质的量浓度的和NH4HSO4溶液以体积比混合:
C.FeO溶于稀HNO3溶液:
D.向AlCl3溶液中滴加过量NaOH溶液:
9.下列除去杂质的方法正确的是
①除去乙烷中少量的乙烯:把混合气体通入溴水中洗气
②除去乙酸乙酯中少量的乙酸:加入饱和溶液后分液
③除去中少量:把气体通过盛有饱和碳酸钠溶液的洗气瓶
④除去乙醇中少量的水:加足量生石灰,蒸馏
A.①③ B.①④ C.③④ D.②③
10.某温度下,在一恒容密闭容器中进行反应:CaC2O4(s)CaO(s)+CO2(g)+CO(g),下列情况一定能说明反应已达到平衡的是
①容器内压强不随时间而变化 ②单位时间内,消耗1 mol CO2同时生成1 mol CO
③气体的密度不随时间而变化 ④混合气体的平均摩尔质量不随时间而变化
A.①③④ B.②③④ C.①②③ D.①②④
11.在一定条件下,将和投入容积为的密闭容器中,发生如下反应:。末测得此时容器中C和D的浓度为和。下列叙述正确的是
A.
B.时,B的浓度为
C.内B的反应速率为
D.此时A的转化率为
12.对可逆反应2A(s)+3B(g) 2C(g)+2D(g) ΔH<0,在一定条件下达到平衡,下列有关叙述正确的是
①增加A的量,平衡向正反应方向移动 ②升高温度,平衡向逆反应方向移动,正减小
③压强增大一倍,平衡不移动,正、逆不变 ④增大B的浓度,正>逆
⑤加入催化剂,平衡向正反应方向移动
A.①② B.④ C.③ D.④⑤
13.在给定条件下,下列选项中所示的物质间转化均能实现的是( )
A.
B.
C.
D.
14.微生物燃料电池可净化废水,同时还能获得能源或有价值的化学品,下图为其工作原理。下列说法正确的是
A.反应一段时间后,N极附近的溶液pH值下降
B.M极的电极反应式为: CH3COOH- 8e -+2H2O= 2CO2↑+8H+
C.外电路转移4mol电子时,N极消耗22.4LO2(标准状况)
D.该电池在常温和高温都可以工作
15.2015年,我国科学家屠呦呦因发现青蒿素而获得诺贝尔奖。已知二羟甲戊酸是生物合成青蒿素的原料之一、下列关于二羟甲戊酸的说法错误的是
A.分子式为C6H12O4
B.能与NaHCO3反应生成CO2
C.能发生加成、加聚和取代反应
D.1 mol该有机物与足量Na反应产生33.6 L(标准状况) H2
16.对于反应 ,在温度为、时,平衡体系中体积分数随压强变化的曲线如图所示。下列说法不正确的是
反应速率:A
气体的颜色:A深、C浅
D.混合气体的平均相对分子质量:A
二、非选择题:本题共4小题,共52分。
17.(12分)硫、氮元素是高中化学学习的两种重要非金属元素,其价-类二维图分别如图。
(1)图中物质“d”的化学式是 。
(2)将一定量的a气体通入下列溶液中,能观察到白色沉淀现象的是________(填标号)。
A.溶液 B.溶液 C.溶液 D.溶液
(3)写出反应③的离子方程式 。
(4)a的水溶液与发生反应可观察到的实验现象是 。
(5)写出c的浓溶液与反应的化学方程式 ,若反应中消耗了铜,
则转移 电子。
(6)如图为合成氨以及氨氧化制硝酸的流程示意图:
已知:用溶液进行尾气处理时的化学反应为:,。为了防止环境污染,用溶液进行尾气处理,若尾气能完全被吸收,则尾气中与的体积必须满足的条件是: ≥ 。
18.(14分)随着全球对可持续发展和环保材料需求的增加,聚丙烯酸乙酯(简称PEA)因其优异的生物降解性和环境友好性,正成为替代传统塑料的理想选择。近期,某科研团队以乙烯、丙烯为原料高效合成聚丙烯酸乙酯()的路线图如下:
(1)乙烯的结构简式为_______,A中所含官能团名称为_______。
(2)反应①、②的反应类型分别为_______、_______。
(3)中所有的碳原子_______一定共平面(填“是”或“否”),产物D可能有_______种结构。
(4)E可制成管道、薄膜等,E的结构简式为_______。
(5)写出物质A催化氧化的反应方程式:_______。
(6)已知B能与NaOH溶液反应,且B的分子式为,写出A与B反应生成C的反应方程式:_______。
19.(12分)某研究性学习小组利用图示装置探究氯气和氨气之间的反应情况。其中A、F分别为氨气和氯气的制取发生装置,C为纯净干燥的氯气与干燥的氨气发生反应的装置。请回答下列问题:
(1)仪器a的名称是_______。
(2)用装置F制取氯气的离子方程式为_______。
(3)请为B处框内选择合适的装置及相应的试剂:_______(填序号)。
A.球形干燥管装碱石灰 B.洗气瓶装浓硫酸
C.球形干燥管装无水 D.球形干燥管装
(4)装置E的作用是_______,装置D和E的位置_______(填“能”或“不能”)调换。
(5)实验中可观察到装置C内出现浓厚的白烟并在容器内壁凝结,另一种生成物是空气的主要成分之一,若有被氧化,则转移的电子数目为_______。
(6)报纸报道了多起卫生间清洗时,因混合使用“洁厕灵”(主要成分是盐酸)与“84”消毒液(主要成分是)发生氯气中毒的事件。试根据你的化学知识分析,原因是_______(用离子方程式表示)。
20.(14分)甲醛在医药方面有重要用途。工业上可利用反应Ⅰ:CH3OH(g)HCHO(g)+H2(g)来合成甲醛。
(1)反应Ⅱ 2CH3OH(g)+O2(g)2HCHO(g)+2H2O(g) ΔH2=-313.2 kJ·mol-1
反应Ⅲ 2H2(g)+O2(g)2H2O(g) ΔH3=-483.6 kJ·mol-1
反应Ⅰ的ΔH1= kJ·mol-1。
(2)利用反应Ⅰ合成甲醛时,为增大化学反应速率,同时提高CH3OH的平衡转化率,可采取的措施为 。
(3)T ℃时,向体积恒为2 L的密闭容器中充入8 mol CH3OH(g)发生反应Ⅰ,5 min后反应达到平衡,测得混合体系中HCHO(g)的体积分数为20%。
①下列事实不能说明该反应已达到化学平衡状态的是 (填序号)。
A.v正(HCHO)=v逆(H2) B.c(CH3OH)∶c(HCHO)∶c(H2)=1∶1∶1
C.混合气体的平均相对分子质量不变 D.混合气体的密度不变
②5 min内,v(CH3OH)= mol·L-1·min-1。
③其他条件不变时,向已达平衡的反应体系中充入1 mol CH3OH(g)和1 mol H2(g),
此时v正 (填“大于”“小于”或“等于”)v逆。
(4)甲醇是优质的清洁燃料,可制作碱性甲醇燃料电池,工作原理如下图所示;
①电极A 为燃料电池的 (填“正”或“负”)极,B电极反应式为 。
②当电路中通过2mol电子时,消耗O2的体积为 L(标准状况)。
高2024级高一下期末模拟考试
化学答案
1~16 BCADA ADBBC DBCBC C
17.(12分)(1)H2SO3(1分) (2)A
(3)3NO2+H2O=2H++2+NO
(4)溶液变浑浊,产生淡黄色沉淀
(5) Cu+2H2SO4(浓)CuSO4+SO2↑+2H2O 2(1分) (6)≥1
18.(14分)(1) ①. (1分) ②.羟基 (1分)
(2) ①.加成反应(1分) ②.取代反应 (1分)
(3) ①.是 ②.2
(4) (5)
(6)
19.(12分)(1)分液漏斗 (1分)
(2) (3)A
(4) ①.除去氯气中混有的 ②.不能 (1分)
(5)
(6)
20.(12分)(1)+85.2 (2) 升高温度
(3) BD 0.2 小于
(4) 负极(1分) O2+2H2O+4e-= 4 OH- (1分) 11.2
同课章节目录
