2025-2026学年厦门一中《化学》初高中衔接课件:“宏观-微观-符号”三重表征——氧化还原反应(28张)
文档属性
| 名称 | 2025-2026学年厦门一中《化学》初高中衔接课件:“宏观-微观-符号”三重表征——氧化还原反应(28张) |

|
|
| 格式 | pptx | ||
| 文件大小 | 3.1MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 其它版本 | ||
| 科目 | 化学 | ||
| 更新时间 | 2025-07-04 16:18:53 | ||
图片预览





文档简介
(共28张PPT)
“宏观-微观-符号”——氧化还原反应
以下反应属于何种基本反应类型?
SO3+H2O = H2SO4
2Cu+O2+CO2+H2O= Cu2 (OH)2CO3
CaCO3 CaO+CO2↑
2KClO3 2KCl+3O2 ↑
Fe+H2SO4(稀) =FeSO4 + H2↑
Fe2O3+3C 2Fe+3CO↑
Ba(OH)2+H2SO4=BaSO4 ↓+2H2O
AgNO3+NaCl = AgCl↓ + NaNO3
化合反应
分解反应
置换反应
复分解反应
讨论:这个反应属于何种基本反应类型?
Fe2O3+3CO 2Fe+3CO2
不属于四种基本反应类型的任何一种
联想质疑
在初中阶段你已学习过一些关于铜及其化合物的化学反应:铜在加热条件下与氧气反应生成氧化铜,氢气把氧化铜还原为铜,金属铁从CuSO4,溶液中将铜置换出来,NaOH溶液。
与CuSO4溶液反应产生氢氧化铜沉淀。
在这些反应中,铜元素发生了哪些变化?前三个反应与最后一个反应的特征有什么不同?前三个反应的本质是怎样的?含有铜元素的物质在这些反应中各表现出什么性质?
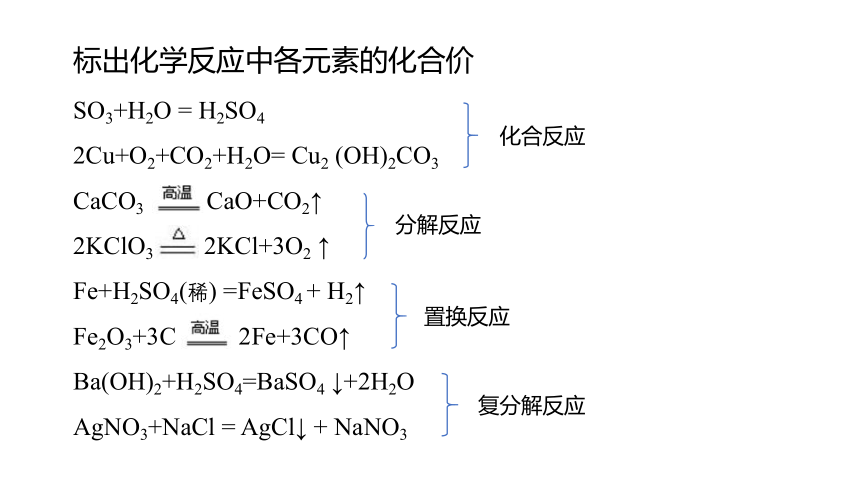
标出化学反应中各元素的化合价
SO3+H2O = H2SO4
2Cu+O2+CO2+H2O= Cu2 (OH)2CO3
CaCO3 CaO+CO2↑
2KClO3 2KCl+3O2 ↑
Fe+H2SO4(稀) =FeSO4 + H2↑
Fe2O3+3C 2Fe+3CO↑
Ba(OH)2+H2SO4=BaSO4 ↓+2H2O
AgNO3+NaCl = AgCl↓ + NaNO3
化合反应
分解反应
置换反应
复分解反应
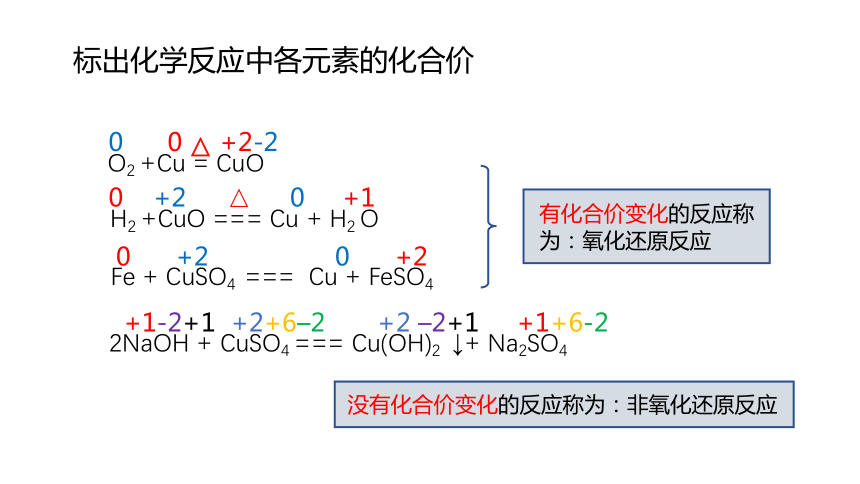
2NaOH + CuSO4 === Cu(OH)2 ↓+ Na2SO4
H2 +CuO === Cu + H2 O
△
Fe + CuSO4 === Cu + FeSO4
+1-2+1 +2+6–2 +2 –2+1 +1+6-2
0 +2 0 +1
0 +2 0 +2
O2 +Cu = CuO
0 0 +2-2
△
标出化学反应中各元素的化合价
没有化合价变化的反应称为:非氧化还原反应
有化合价变化的反应称
为:氧化还原反应
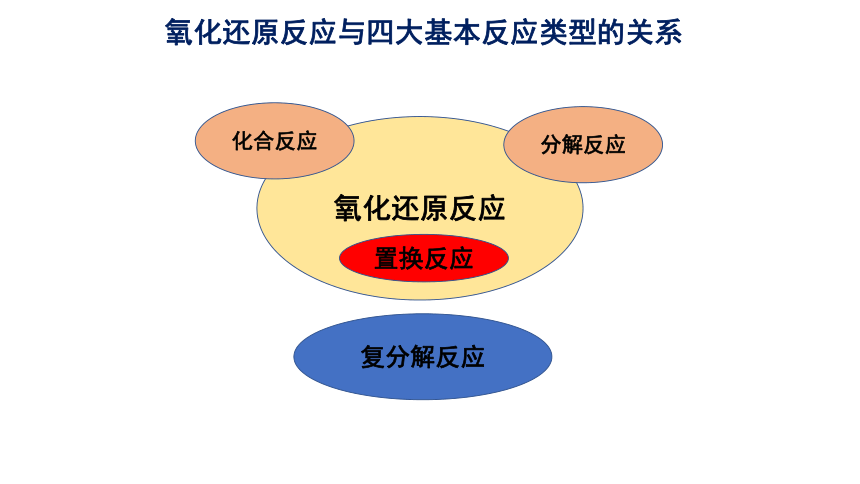
氧化还原反应
置换反应
化合反应
分解反应
复分解反应
氧化还原反应与四大基本反应类型的关系
1.氧化还原反应的特征
反应中有元素化合价变化的化学反应称为氧化还原反应。
(1)特征:
反应过程中有元素化合价变化
反应中无元素化合价变化的化学反应不属于氧化还原反应。
(2)定义:
一、认识氧化还原反应
(3)从化合价升降的角度分析氧化反应、还原反应。
①氧化反应——反应物所含某种(或某些)元素化合价________的反应。
②还原反应——反应物所含某种(或某些)元素化合价________的反应。
升高
降低
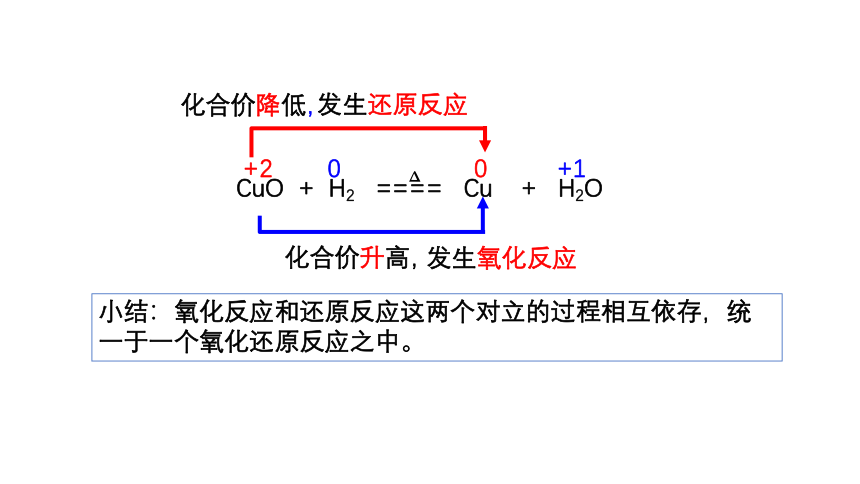
+2 0 0 +1
CuO + H2 ==== Cu + H2O
Δ
化合价降低,
化合价升高,
发生还原反应
发生氧化反应
小结:氧化反应和还原反应这两个对立的过程相互依存,统一于一个氧化还原反应之中。
思考:在氧化还原反应中,元素化合价为什么会变化 ?
1.金属钠可以在氯气中剧烈地燃烧并生成氯化钠。这个反应属于氧化还原反应吗?氯气由氯分子构成,一个氯分子由两个氯原子构成。金属钠由钠原子构成。氯化钠由Na+和Cl-构成。可见在反应过程中,钠原子变成了Na+ ,氯原子变成了Cl- 。钠原子和氯原子是怎样变化为Na+和Cl-并进而形成氯化钠的呢?
交流研讨:
Cl
Na
失去e-
得到e-
Na+
Cl-
Na+
[ Cl ]-
失去e-
得到e-
0 0 +1 -1
2Na+Cl2===2NaCl
点燃
化合价升降的原因:电子的转移
2
2
2.写出铁与CuSO4溶液反应的化学方程式,判断该反应是否属于氧化还原反应。按照图2-3-2所示实验装置进行铁与CuSO4溶液反应的实验,实验现象之一是电流表指针发生偏转。这一实验现象对于你认识铁与CuSO4溶液反应的实质有什么启示?
Fe + CuSO4==== FeSO4 + Cu
0
0
+2
+2
失去e-
得到e-
2.氧化还原反应的实质:
电子的转移
3.根据化合价分析氧化还原反应中的电子转移
在氧化还原反应中,某种元素的一个原子或离子失去电子,则该元素的化合价升高,而且失去电子的数目与化合价升高的数值相等;某种元素的一个原子或离子得到电子,则该元素的化合价降低,而且得到电子的数目与化合价降低的数值相等。氧化还原反应中电子转移的总数与化合价升高或降低的总值是相等的。
元素化合价升高 →原子或离子失电子→发生氧化反应
元素化合价降低 →原子或离子得电子→发生还原反应
4.氧化还原反应的表示方法:
2Na + Cl2 ==== 2NaCl
点燃
0
0
+1
-1
失e-×2,化合价升高,氧化反应
得e-×2,化合价降低,还原反应
2Na + Cl2 ==== 2NaCl
点燃
0
0
+1
-1
2e-
双线桥
单线桥
注意事项
①箭头、箭尾指向化合价变化的同种元素。
②必须注明“得到”或“失去”字样。
③失去电子总数与得到电子总数相等。
注意事项
①单线桥必须画在反应物中。
②箭头指向得电子元素,箭尾指向失电子元素。
③标电子转移的总数,不标“得失”。
二、氧化剂和还原剂
以下氧化还原反应中,化合价升高的元素有哪些,化合价降低的元素有哪些?哪种反应物含有化合价升高的元素,哪种反应物含有化合价降低的元素?
2.氧化性、还原性
还原剂→具有还原性→被氧化→发生氧化反应
氧化剂→具有氧化性→被还原→发生还原反应
+2
0
0
+1
化合价降低,得2e- ×1 ,还原反应
化合价升高,失1e-×2,氧化反应
CuO + H2 ==== Cu + H2O
△
氧化剂
还原剂
1.定义
氧化剂:在氧化还原反应中,所含某种(或某些)元素化合价降低的反应物称为氧化剂
还原剂:在氧化还原反应中,所含某种(或某些)元素化合价升高的反应物称为还原剂
升、失、氧
降、得、还
3.从氧化性、还原性的角度认识和研究物质的性质
(1)所含元素处于较高价态时,元素有降低价态的趋势,该物质可能具有氧化性。
4.常见氧化剂还原剂
(1)常见的氧化剂:氧气、氯气等活泼的非金属单质,硝酸、浓硫酸等含高 价态元素的含氧酸,以及高锰酸钾、氯酸钾、氯化铁等含有较高价态元素的盐。
(2)常见的还原剂:活泼的金属单质,碳单质、氢气等非金属单质,以及一些含有较低价态元素的氧化物(如一氧化碳、二氧化硫等)和盐(如碘化钾、亚硫酸钠、硫酸亚铁等)。
(2)所含元素处于较低价态时,元素有升高价态的趋势,该物质可能具有还原性。
C + H2SO4 --- CO2 + SO2 + H2O
2.氧化还原反应方程式配平的一般步骤
(1)标价态:写出反应物和生成物的化学式,标出发生氧化反应和还原反应的元素化合价。
0 +6 +4 +4
(2)列变化:标出电子转移方向和数目
失去4e-
0 +6 +4 +4
得到2e-
C + H2SO4 --- CO2 + SO2 + H2O
失去4e-×1
0 +6 +4 +4
得到2e- ×2
C + H2SO4 --- CO2 + SO2 + H2O
(4)配系数:确定氧化剂,还原剂,氧化产物,还原产物的系数;用观察法配平其他各物质的化学计量数。
CO2↑ + 2SO2 ↑+ 2H2O
C + 2H2SO4(浓硫酸)
(5)查守恒:检查质量、得失电子、电荷是否守恒
(3)求总数:依据得失电子守恒,使化合价升高和降低的总数相等。
失6e-×1
得1e-×6
0 +5 +6 +4
S + HNO3 — H2SO4 + NO2↑ + H2O
6
6
2
C+ HNO3 NO2 + CO2 + H2O
4
4
2
小试牛刀
1、氧化还原反应的定义:有元素 化合价变化 的化学反应
氧化还原的特征、判断依据
电子的转移
原因
氧化还原的实质
氧化剂+还原剂 ==== 还原产物+氧化产物
2、四对概念
化合价降低,得电子,发生还原反应
化合价升高,失电子,发生氧化反应
氧化性
还原性
还原产物
氧化剂
具有氧化性
得电子
化合价降低
发生还原反应(被还原)
还原剂
具有还原性
失电子
化合价升高
发生氧化反应(被氧化)
氧化产物
反应物
性 质
实 质
特征
反应产物
反 应
失升还还氧氧氧
得降氧氧还还还
氧化还原
1、有关氧化还原反应的下列叙述,正确的是( )
A、失电子的物质做氧化剂
B、有元素化合价升高的的反应是还原反应
C、还原剂失电子越多,其还原性越强
D、氧化还原反应的本质是电子的转移
D
2、下列反应属于氧化还原反应的是( )
A、 CuO + 2HCl === CuCl2+H2O
B、Na2CO3+ 2HCl===2NaCl + CO2 ↑+H2O
C、2KMnO4 === K2MnO4 + MnO2 + O2 ↑
D、Ca(OH)2 + CO2===CaCO3 ↑ + H2O
C
3、下列说法正确的是( )
A、有单质参加的化学反应一定是氧化还原反应
B、单质可由氧化或还原含该元素的化合物来制得
C、在反应中,金属单质一定做氧化剂,非金属单质一定做还原剂
D、金属阳离子被还原一定得到金属单质
×
不一定,如:Fe3+→Fe2+
×
×
√
如:3O2===2O3
B
Thank you
谢 谢 欣 赏
“宏观-微观-符号”——氧化还原反应
以下反应属于何种基本反应类型?
SO3+H2O = H2SO4
2Cu+O2+CO2+H2O= Cu2 (OH)2CO3
CaCO3 CaO+CO2↑
2KClO3 2KCl+3O2 ↑
Fe+H2SO4(稀) =FeSO4 + H2↑
Fe2O3+3C 2Fe+3CO↑
Ba(OH)2+H2SO4=BaSO4 ↓+2H2O
AgNO3+NaCl = AgCl↓ + NaNO3
化合反应
分解反应
置换反应
复分解反应
讨论:这个反应属于何种基本反应类型?
Fe2O3+3CO 2Fe+3CO2
不属于四种基本反应类型的任何一种
联想质疑
在初中阶段你已学习过一些关于铜及其化合物的化学反应:铜在加热条件下与氧气反应生成氧化铜,氢气把氧化铜还原为铜,金属铁从CuSO4,溶液中将铜置换出来,NaOH溶液。
与CuSO4溶液反应产生氢氧化铜沉淀。
在这些反应中,铜元素发生了哪些变化?前三个反应与最后一个反应的特征有什么不同?前三个反应的本质是怎样的?含有铜元素的物质在这些反应中各表现出什么性质?
标出化学反应中各元素的化合价
SO3+H2O = H2SO4
2Cu+O2+CO2+H2O= Cu2 (OH)2CO3
CaCO3 CaO+CO2↑
2KClO3 2KCl+3O2 ↑
Fe+H2SO4(稀) =FeSO4 + H2↑
Fe2O3+3C 2Fe+3CO↑
Ba(OH)2+H2SO4=BaSO4 ↓+2H2O
AgNO3+NaCl = AgCl↓ + NaNO3
化合反应
分解反应
置换反应
复分解反应
2NaOH + CuSO4 === Cu(OH)2 ↓+ Na2SO4
H2 +CuO === Cu + H2 O
△
Fe + CuSO4 === Cu + FeSO4
+1-2+1 +2+6–2 +2 –2+1 +1+6-2
0 +2 0 +1
0 +2 0 +2
O2 +Cu = CuO
0 0 +2-2
△
标出化学反应中各元素的化合价
没有化合价变化的反应称为:非氧化还原反应
有化合价变化的反应称
为:氧化还原反应
氧化还原反应
置换反应
化合反应
分解反应
复分解反应
氧化还原反应与四大基本反应类型的关系
1.氧化还原反应的特征
反应中有元素化合价变化的化学反应称为氧化还原反应。
(1)特征:
反应过程中有元素化合价变化
反应中无元素化合价变化的化学反应不属于氧化还原反应。
(2)定义:
一、认识氧化还原反应
(3)从化合价升降的角度分析氧化反应、还原反应。
①氧化反应——反应物所含某种(或某些)元素化合价________的反应。
②还原反应——反应物所含某种(或某些)元素化合价________的反应。
升高
降低
+2 0 0 +1
CuO + H2 ==== Cu + H2O
Δ
化合价降低,
化合价升高,
发生还原反应
发生氧化反应
小结:氧化反应和还原反应这两个对立的过程相互依存,统一于一个氧化还原反应之中。
思考:在氧化还原反应中,元素化合价为什么会变化 ?
1.金属钠可以在氯气中剧烈地燃烧并生成氯化钠。这个反应属于氧化还原反应吗?氯气由氯分子构成,一个氯分子由两个氯原子构成。金属钠由钠原子构成。氯化钠由Na+和Cl-构成。可见在反应过程中,钠原子变成了Na+ ,氯原子变成了Cl- 。钠原子和氯原子是怎样变化为Na+和Cl-并进而形成氯化钠的呢?
交流研讨:
Cl
Na
失去e-
得到e-
Na+
Cl-
Na+
[ Cl ]-
失去e-
得到e-
0 0 +1 -1
2Na+Cl2===2NaCl
点燃
化合价升降的原因:电子的转移
2
2
2.写出铁与CuSO4溶液反应的化学方程式,判断该反应是否属于氧化还原反应。按照图2-3-2所示实验装置进行铁与CuSO4溶液反应的实验,实验现象之一是电流表指针发生偏转。这一实验现象对于你认识铁与CuSO4溶液反应的实质有什么启示?
Fe + CuSO4==== FeSO4 + Cu
0
0
+2
+2
失去e-
得到e-
2.氧化还原反应的实质:
电子的转移
3.根据化合价分析氧化还原反应中的电子转移
在氧化还原反应中,某种元素的一个原子或离子失去电子,则该元素的化合价升高,而且失去电子的数目与化合价升高的数值相等;某种元素的一个原子或离子得到电子,则该元素的化合价降低,而且得到电子的数目与化合价降低的数值相等。氧化还原反应中电子转移的总数与化合价升高或降低的总值是相等的。
元素化合价升高 →原子或离子失电子→发生氧化反应
元素化合价降低 →原子或离子得电子→发生还原反应
4.氧化还原反应的表示方法:
2Na + Cl2 ==== 2NaCl
点燃
0
0
+1
-1
失e-×2,化合价升高,氧化反应
得e-×2,化合价降低,还原反应
2Na + Cl2 ==== 2NaCl
点燃
0
0
+1
-1
2e-
双线桥
单线桥
注意事项
①箭头、箭尾指向化合价变化的同种元素。
②必须注明“得到”或“失去”字样。
③失去电子总数与得到电子总数相等。
注意事项
①单线桥必须画在反应物中。
②箭头指向得电子元素,箭尾指向失电子元素。
③标电子转移的总数,不标“得失”。
二、氧化剂和还原剂
以下氧化还原反应中,化合价升高的元素有哪些,化合价降低的元素有哪些?哪种反应物含有化合价升高的元素,哪种反应物含有化合价降低的元素?
2.氧化性、还原性
还原剂→具有还原性→被氧化→发生氧化反应
氧化剂→具有氧化性→被还原→发生还原反应
+2
0
0
+1
化合价降低,得2e- ×1 ,还原反应
化合价升高,失1e-×2,氧化反应
CuO + H2 ==== Cu + H2O
△
氧化剂
还原剂
1.定义
氧化剂:在氧化还原反应中,所含某种(或某些)元素化合价降低的反应物称为氧化剂
还原剂:在氧化还原反应中,所含某种(或某些)元素化合价升高的反应物称为还原剂
升、失、氧
降、得、还
3.从氧化性、还原性的角度认识和研究物质的性质
(1)所含元素处于较高价态时,元素有降低价态的趋势,该物质可能具有氧化性。
4.常见氧化剂还原剂
(1)常见的氧化剂:氧气、氯气等活泼的非金属单质,硝酸、浓硫酸等含高 价态元素的含氧酸,以及高锰酸钾、氯酸钾、氯化铁等含有较高价态元素的盐。
(2)常见的还原剂:活泼的金属单质,碳单质、氢气等非金属单质,以及一些含有较低价态元素的氧化物(如一氧化碳、二氧化硫等)和盐(如碘化钾、亚硫酸钠、硫酸亚铁等)。
(2)所含元素处于较低价态时,元素有升高价态的趋势,该物质可能具有还原性。
C + H2SO4 --- CO2 + SO2 + H2O
2.氧化还原反应方程式配平的一般步骤
(1)标价态:写出反应物和生成物的化学式,标出发生氧化反应和还原反应的元素化合价。
0 +6 +4 +4
(2)列变化:标出电子转移方向和数目
失去4e-
0 +6 +4 +4
得到2e-
C + H2SO4 --- CO2 + SO2 + H2O
失去4e-×1
0 +6 +4 +4
得到2e- ×2
C + H2SO4 --- CO2 + SO2 + H2O
(4)配系数:确定氧化剂,还原剂,氧化产物,还原产物的系数;用观察法配平其他各物质的化学计量数。
CO2↑ + 2SO2 ↑+ 2H2O
C + 2H2SO4(浓硫酸)
(5)查守恒:检查质量、得失电子、电荷是否守恒
(3)求总数:依据得失电子守恒,使化合价升高和降低的总数相等。
失6e-×1
得1e-×6
0 +5 +6 +4
S + HNO3 — H2SO4 + NO2↑ + H2O
6
6
2
C+ HNO3 NO2 + CO2 + H2O
4
4
2
小试牛刀
1、氧化还原反应的定义:有元素 化合价变化 的化学反应
氧化还原的特征、判断依据
电子的转移
原因
氧化还原的实质
氧化剂+还原剂 ==== 还原产物+氧化产物
2、四对概念
化合价降低,得电子,发生还原反应
化合价升高,失电子,发生氧化反应
氧化性
还原性
还原产物
氧化剂
具有氧化性
得电子
化合价降低
发生还原反应(被还原)
还原剂
具有还原性
失电子
化合价升高
发生氧化反应(被氧化)
氧化产物
反应物
性 质
实 质
特征
反应产物
反 应
失升还还氧氧氧
得降氧氧还还还
氧化还原
1、有关氧化还原反应的下列叙述,正确的是( )
A、失电子的物质做氧化剂
B、有元素化合价升高的的反应是还原反应
C、还原剂失电子越多,其还原性越强
D、氧化还原反应的本质是电子的转移
D
2、下列反应属于氧化还原反应的是( )
A、 CuO + 2HCl === CuCl2+H2O
B、Na2CO3+ 2HCl===2NaCl + CO2 ↑+H2O
C、2KMnO4 === K2MnO4 + MnO2 + O2 ↑
D、Ca(OH)2 + CO2===CaCO3 ↑ + H2O
C
3、下列说法正确的是( )
A、有单质参加的化学反应一定是氧化还原反应
B、单质可由氧化或还原含该元素的化合物来制得
C、在反应中,金属单质一定做氧化剂,非金属单质一定做还原剂
D、金属阳离子被还原一定得到金属单质
×
不一定,如:Fe3+→Fe2+
×
×
√
如:3O2===2O3
B
Thank you
谢 谢 欣 赏
同课章节目录
