2025-2026学年厦门一中《化学》初高中衔接课件:化学实验之气体制备(20张)
文档属性
| 名称 | 2025-2026学年厦门一中《化学》初高中衔接课件:化学实验之气体制备(20张) |

|
|
| 格式 | pptx | ||
| 文件大小 | 1.5MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 其它版本 | ||
| 科目 | 化学 | ||
| 更新时间 | 2025-07-04 16:25:39 | ||
图片预览





文档简介
(共20张PPT)
第六讲 化学实验之气体的实验室制备
活动1:推陈出新——回顾二氧化碳的实验室制取
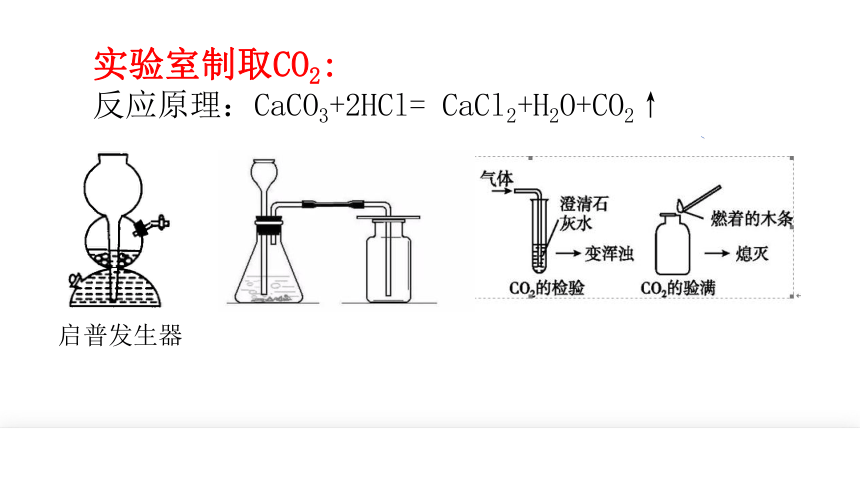
实验室制取CO2:
反应原理:CaCO3+2HCl= CaCl2+H2O+CO2↑
启普发生器
CO2的实验室制备的装置
问题1:这样的装置有什么不足之处?用这样的装置能否制得纯净干燥的二氧化碳?
分析反应原理可知:
CO2中混有的HCl、H2O
问题1:这样的装置有什么不足之处?用这样的装置能否制得纯净干燥的二氧化碳?
通过装有饱和NaHCO3溶液的洗气瓶反应除去CO2中混有的HCl
通过装有浓H2SO4溶液的洗气瓶吸收H2O干燥CO2
洗气瓶
分析反应原理可知:CO2中混有的HCl、H2O
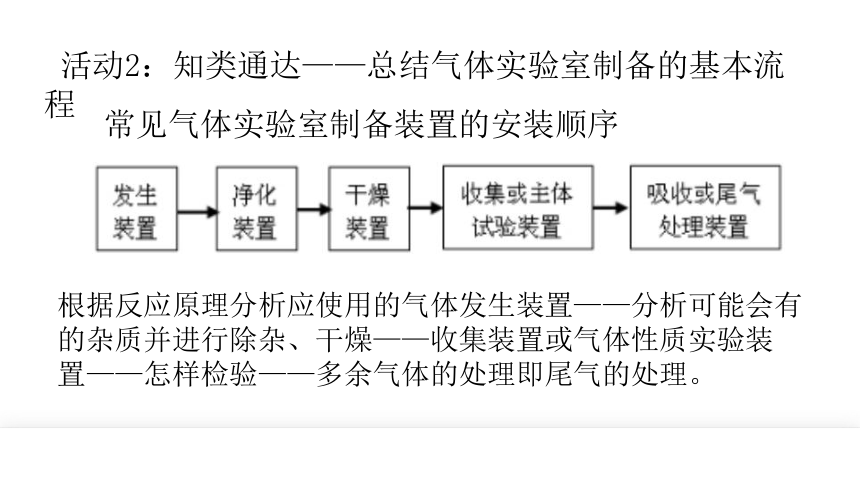
常见气体实验室制备装置的安装顺序
活动2:知类通达——总结气体实验室制备的基本流程
根据反应原理分析应使用的气体发生装置——分析可能会有的杂质并进行除杂、干燥——收集装置或气体性质实验装置——怎样检验——多余气体的处理即尾气的处理。
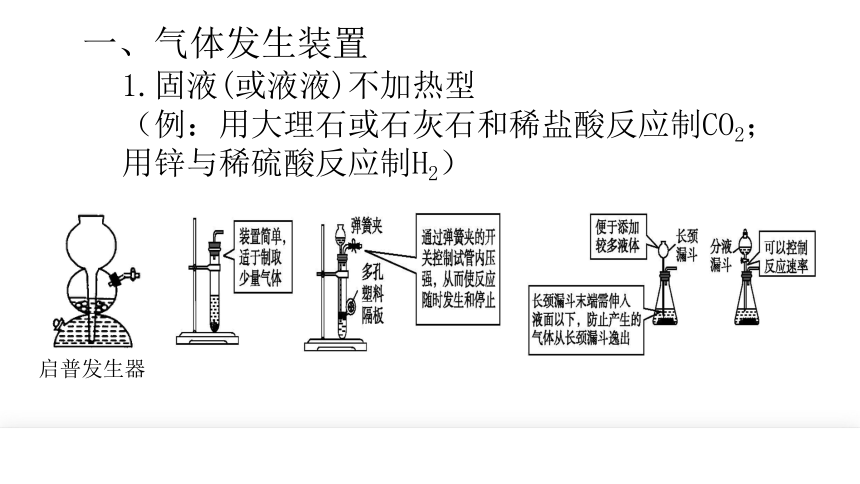
一、气体发生装置
1.固液(或液液)不加热型
(例:用大理石或石灰石和稀盐酸反应制CO2;用锌与稀硫酸反应制H2)
启普发生器
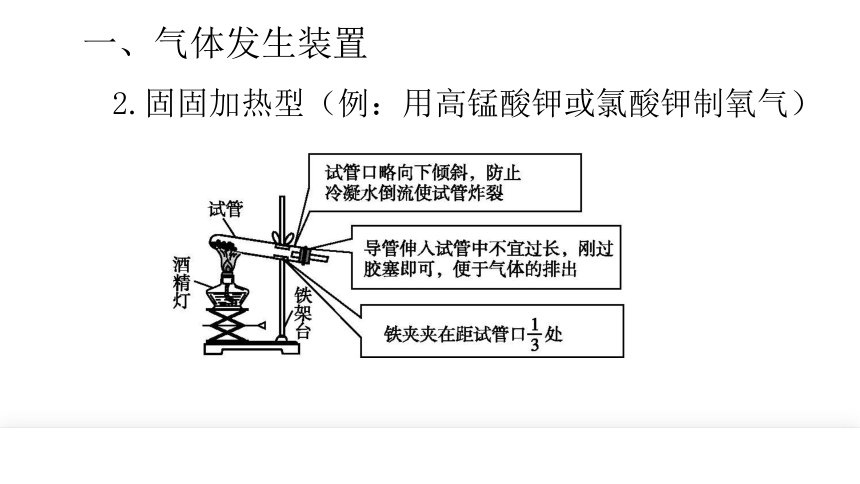
一、气体发生装置
2.固固加热型(例:用高锰酸钾或氯酸钾制氧气)
二、气体除杂净化装置
CO2中混有的HCl、SO2等酸性气体:饱和NaHCO3溶液
CO2中混有的SO2:酸性高锰酸钾溶液Cl2中混有的HCl:饱和NaCl溶液
二、气体净化除杂装置
氧化还原法:
用灼热铜丝网除去O2(2Cu+O2=2CuO)
用加热的CuO除去H2、CO等。
酸碱法:
通过装碱石灰的干燥管除去酸性气体CO2等
(CaO+CO2=CaCO3)
三、气体干燥装置
四、气体收集装置
1.排气集气法
2.排水集气法
五、尾气处理装置
——通常有毒和有污染的尾气必须适当处理
用于NaOH吸收SO2、氯气(气体溶解或反应速度不很快,不易引起倒吸)
收集极易溶且溶解速度很快的气体如HCl、HBr、NH3等(防止倒吸)
五、尾气处理装置
——通常有毒和有污染的尾气必须适当处理
用于处理难以吸收(有毒)且可燃的气体。如H2、CO等
用于收集少量气体然后处理
关键步骤:装置气密性的检查
微热法
原理:升高装置中气体的温度,使气体体积膨胀
操作方法:塞紧橡胶塞,将导气管末端伸入盛水的烧杯中,用手捂热(或用酒精灯微热)烧瓶
现象说明:导气管口有气泡产生,停止微热,冷却后导气管末端形成一段水柱,且保持一段时间不下降
关键步骤:装置气密性的检查
液差法
原理:压缩装置中气体的体积,增大压强
操作方法:塞紧橡胶塞,用止水夹夹住导气管的橡胶管部分,从长颈漏斗向试管中注水
现象说明:长颈漏斗中的液面高于试管中的液面后停止加水,一段时间内液面高度差不变
关键步骤:装置气密性的检查
气压法
原理:封闭气体压强增大,使液滴不能滴下
操作方法:塞紧橡胶塞,关闭止水夹,打开分液漏斗活塞,向烧瓶中加水
现象说明:一段时间后,液滴不能滴下
活动3:类推应用——氯气的实验室制备
固液(或液液)加热型
2.除杂:
3.干燥:
4.收集:
5.尾气处理:
1.实验室制氯气的原理:
MnO2+4HCI(浓) MnCl2+Cl2↑+2H2O
活动3:类推应用——氯气的实验室制备
问题2:B瓶、F瓶中发生的反应?A-F各个装置的作用?
MnO2+4HCI(浓) MnCl2+Cl2↑+2H2O
氯气的实验室制备的装置
谢
谢
第六讲 化学实验之气体的实验室制备
活动1:推陈出新——回顾二氧化碳的实验室制取
实验室制取CO2:
反应原理:CaCO3+2HCl= CaCl2+H2O+CO2↑
启普发生器
CO2的实验室制备的装置
问题1:这样的装置有什么不足之处?用这样的装置能否制得纯净干燥的二氧化碳?
分析反应原理可知:
CO2中混有的HCl、H2O
问题1:这样的装置有什么不足之处?用这样的装置能否制得纯净干燥的二氧化碳?
通过装有饱和NaHCO3溶液的洗气瓶反应除去CO2中混有的HCl
通过装有浓H2SO4溶液的洗气瓶吸收H2O干燥CO2
洗气瓶
分析反应原理可知:CO2中混有的HCl、H2O
常见气体实验室制备装置的安装顺序
活动2:知类通达——总结气体实验室制备的基本流程
根据反应原理分析应使用的气体发生装置——分析可能会有的杂质并进行除杂、干燥——收集装置或气体性质实验装置——怎样检验——多余气体的处理即尾气的处理。
一、气体发生装置
1.固液(或液液)不加热型
(例:用大理石或石灰石和稀盐酸反应制CO2;用锌与稀硫酸反应制H2)
启普发生器
一、气体发生装置
2.固固加热型(例:用高锰酸钾或氯酸钾制氧气)
二、气体除杂净化装置
CO2中混有的HCl、SO2等酸性气体:饱和NaHCO3溶液
CO2中混有的SO2:酸性高锰酸钾溶液Cl2中混有的HCl:饱和NaCl溶液
二、气体净化除杂装置
氧化还原法:
用灼热铜丝网除去O2(2Cu+O2=2CuO)
用加热的CuO除去H2、CO等。
酸碱法:
通过装碱石灰的干燥管除去酸性气体CO2等
(CaO+CO2=CaCO3)
三、气体干燥装置
四、气体收集装置
1.排气集气法
2.排水集气法
五、尾气处理装置
——通常有毒和有污染的尾气必须适当处理
用于NaOH吸收SO2、氯气(气体溶解或反应速度不很快,不易引起倒吸)
收集极易溶且溶解速度很快的气体如HCl、HBr、NH3等(防止倒吸)
五、尾气处理装置
——通常有毒和有污染的尾气必须适当处理
用于处理难以吸收(有毒)且可燃的气体。如H2、CO等
用于收集少量气体然后处理
关键步骤:装置气密性的检查
微热法
原理:升高装置中气体的温度,使气体体积膨胀
操作方法:塞紧橡胶塞,将导气管末端伸入盛水的烧杯中,用手捂热(或用酒精灯微热)烧瓶
现象说明:导气管口有气泡产生,停止微热,冷却后导气管末端形成一段水柱,且保持一段时间不下降
关键步骤:装置气密性的检查
液差法
原理:压缩装置中气体的体积,增大压强
操作方法:塞紧橡胶塞,用止水夹夹住导气管的橡胶管部分,从长颈漏斗向试管中注水
现象说明:长颈漏斗中的液面高于试管中的液面后停止加水,一段时间内液面高度差不变
关键步骤:装置气密性的检查
气压法
原理:封闭气体压强增大,使液滴不能滴下
操作方法:塞紧橡胶塞,关闭止水夹,打开分液漏斗活塞,向烧瓶中加水
现象说明:一段时间后,液滴不能滴下
活动3:类推应用——氯气的实验室制备
固液(或液液)加热型
2.除杂:
3.干燥:
4.收集:
5.尾气处理:
1.实验室制氯气的原理:
MnO2+4HCI(浓) MnCl2+Cl2↑+2H2O
活动3:类推应用——氯气的实验室制备
问题2:B瓶、F瓶中发生的反应?A-F各个装置的作用?
MnO2+4HCI(浓) MnCl2+Cl2↑+2H2O
氯气的实验室制备的装置
谢
谢
同课章节目录
