2025-2026学年厦门一中《化学》初高中衔接课件:宏观与微观的桥梁——物质的量(15张)
文档属性
| 名称 | 2025-2026学年厦门一中《化学》初高中衔接课件:宏观与微观的桥梁——物质的量(15张) |

|
|
| 格式 | pptx | ||
| 文件大小 | 4.7MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 其它版本 | ||
| 科目 | 化学 | ||
| 更新时间 | 2025-07-04 16:24:54 | ||
图片预览






文档简介
(共15张PPT)
宏观与微观的桥梁——物质的量
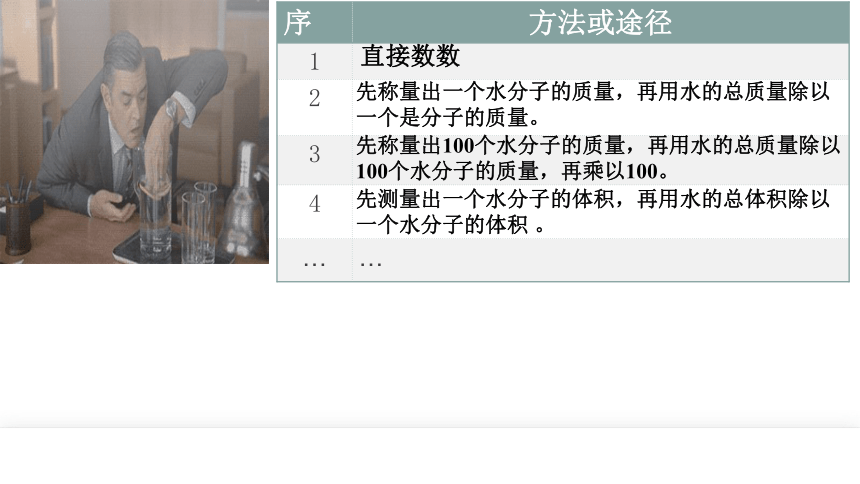
序 方法或途径
1
2
3
4
… …
直接数数
先称量出一个水分子的质量,再用水的总质量除以一个是分子的质量。
先称量出100个水分子的质量,再用水的总质量除以
100个水分子的质量,再乘以100。
先测量出一个水分子的体积,再用水的总体积除以一个水分子的体积 。
宏观物质
质量体积
微观粒子
个 数
?
可见、易称量
不可见难称量
建立模型
模型一:——直接计量(方法一)
模型二:——引入中间物理量换算
(方法二~四)
建立模型
根据方法3,我们把这一微观粒子集体所含
微粒数目暂定为NA个,建立下列数学模型:
物质所含微粒数= ×NA
12g
微粒
?
已知:一个碳原子(12C)的质量为 1.993 × 10-23g
求: 12g 这种碳中所含的碳原子数?
解:
≈ 6.02214076×1023
12g
1.993 × 10-23g
碳原子个数=
[计算]
一、物质的量及其单位——摩尔
1.物质的量(n):是一种物理量,是宏观量与微观的粒子数量联系起来的物理量
注意:
①物质的量是一个基本物理量
②物质的量适用范围:微观粒子 。(原子、分子、离子、质子、中子、电子、原子团)
③物质的量四个字是一个整体,不能拆开,缺一不可!
如长度、时间、质量、电流、温度等物理量相似
2.物质的量的单位:摩尔,符号mol
1 mol 任何粒子所含有的粒子数同0.012kg12C所含碳原子数目相等
3.阿伏加德罗常数(NA):
0.012kg 12C所含碳原子数目为6.02×1023 , 6.02×1023 mol-1称为阿伏加德罗常数。
1971年第14次国际计量大会规定了
七个基本物理量及其单位和符号
物理量 单位名称 单位符号
长度 米 m
质量 千克 kg
时间 秒 s
电流强度 安培 A
热力学温度 开尔文 K
发光强度 坎德拉 cd
物质的量 摩尔 mol
这样规定有什么好处?
① NA个微观粒子所形成的微粒集体的质量在几克 到几百克之间,质量大小适宜,可以称量,便于换算。
② 有利于借助相对原子质量,确定不同种类粒子集体的质量。
4、物质的量(n)、实际微观粒子数(N)和阿伏伽德罗常数(NA )三者的关系。
二、摩尔质量
1mol物质的质量
1mol 任何物质的质量,以克为单位时,其数值都等于它的相对原子质 量或相对分子质量。
2. 摩尔质量
(1)定义:单位物质的量的物质所具有的质量,符号为M。
(2)单位:g mol-1或kg mol-1
(3)数值:数值等于该粒子的相对分子(原子)质量。
(4)摩尔质量与相对分子质量、相对原子质量的关系
类别 摩尔质量 相对分子(或原子)质量
相同点 对于同一物质或微粒来讲,摩尔质量以g mol-1为单位时,二者在数值上相等 符号 M Ar
含义 单位物质的量的物质具有的质量 该分子(或原子)的质量除以一个12C原子质量的1/12所得的数值
单位 g mol-1 1
实例(Na2CO3) 106g mol-1 106
3. 物质的质量(m),物质的量(n),摩尔质量(M)三者之间的关系
三、气体摩尔体积
1、影响物质体积大小的因素
影响因素
粒子大小
粒子数目
粒子间距离
固体或液体体积
气体体积
微观解释:
(1)固体或液体:粒子本身的“直径”远远大于粒子之间的距离,所以决定其体积大小的因素是粒子大小和粒子数目
(2)气体:分子间的距离远远大于分子本身的“直径”,所以T、P相同,任何气体粒子之间的距离可以看成相等的,因此粒子数相同的任何气体都具有相同的体积。也就是说同T、P下,同V的任何气体都含有相同数目粒子。
决
定
决
定
水(液态)
水蒸气(气态)
2、气体摩尔体积
(1)定义:单位物质的量的气体所占的体积,符号:Vm
单位:L ·mol-1 或m3·mol-1
适用范围:气体(单一或混合气体均可用)
(2)标准状况下(0℃,101kPa), 1mol 任何 气体的体积都约占22.4 L/mol。
25℃,101kPa时,气体摩尔体积约为24.5L ·mol-1 。
(3)计算公式:
注意:
①22.4L/mol 使用条件:适用气体,且一般指标准状况,即0℃、101kPa。
② 适用对象:必须是气态物质,单一或混合气体均可用。
※在标准状况下,水、乙醇等都不是气体。
③22.4L气体在标准状况下其物质的量是1mol,非标准状况下,22.4L气体的物质的量可能是1mol也可能不是1mol.
①是否为气体
②是否为标况( 0℃,101kPa)
③是否为1mol
t=0℃或T=273.15K
四、物质的量浓度
1.定义:单位体积溶液里所含溶质B的物质的量叫作溶质B的物质的量浓度。
2.符号:cB
3.单位:mol·L-1或mol·m-3
4.表达式:
注:①B表示溶液中所含的溶质,还可以表示构成溶质分子的其他粒子。
②溶液的体积不等于溶剂的体积(以L为单位),且不同物质(尤其是不同状态的物质的体积是没有加和性的)
③ 溶液的物质的量浓度与所取溶液的体积大小无关。
④用结晶水化合物配制溶液时,其溶质不应包含结晶水。(如CuSO4·5H2O,溶质是CuSO4)
物质的量浓度与质量分数的区别与联系
物质的量浓度 溶质的质量分数
溶质的单位 mol g
溶液的单位 L g
单位 mol·L-1 -
公式
特点 V相同,cB也相同的任何溶液中,所含nB 也相同,但wB 不一定相同 m相同,wB 也相同的任何溶液中,所含mB 相同,但nB 不一定相同。
换算公式 (ρ为g.mL-1 或g.cm-3)
宏观与微观的桥梁——物质的量
序 方法或途径
1
2
3
4
… …
直接数数
先称量出一个水分子的质量,再用水的总质量除以一个是分子的质量。
先称量出100个水分子的质量,再用水的总质量除以
100个水分子的质量,再乘以100。
先测量出一个水分子的体积,再用水的总体积除以一个水分子的体积 。
宏观物质
质量体积
微观粒子
个 数
?
可见、易称量
不可见难称量
建立模型
模型一:——直接计量(方法一)
模型二:——引入中间物理量换算
(方法二~四)
建立模型
根据方法3,我们把这一微观粒子集体所含
微粒数目暂定为NA个,建立下列数学模型:
物质所含微粒数= ×NA
12g
微粒
?
已知:一个碳原子(12C)的质量为 1.993 × 10-23g
求: 12g 这种碳中所含的碳原子数?
解:
≈ 6.02214076×1023
12g
1.993 × 10-23g
碳原子个数=
[计算]
一、物质的量及其单位——摩尔
1.物质的量(n):是一种物理量,是宏观量与微观的粒子数量联系起来的物理量
注意:
①物质的量是一个基本物理量
②物质的量适用范围:微观粒子 。(原子、分子、离子、质子、中子、电子、原子团)
③物质的量四个字是一个整体,不能拆开,缺一不可!
如长度、时间、质量、电流、温度等物理量相似
2.物质的量的单位:摩尔,符号mol
1 mol 任何粒子所含有的粒子数同0.012kg12C所含碳原子数目相等
3.阿伏加德罗常数(NA):
0.012kg 12C所含碳原子数目为6.02×1023 , 6.02×1023 mol-1称为阿伏加德罗常数。
1971年第14次国际计量大会规定了
七个基本物理量及其单位和符号
物理量 单位名称 单位符号
长度 米 m
质量 千克 kg
时间 秒 s
电流强度 安培 A
热力学温度 开尔文 K
发光强度 坎德拉 cd
物质的量 摩尔 mol
这样规定有什么好处?
① NA个微观粒子所形成的微粒集体的质量在几克 到几百克之间,质量大小适宜,可以称量,便于换算。
② 有利于借助相对原子质量,确定不同种类粒子集体的质量。
4、物质的量(n)、实际微观粒子数(N)和阿伏伽德罗常数(NA )三者的关系。
二、摩尔质量
1mol物质的质量
1mol 任何物质的质量,以克为单位时,其数值都等于它的相对原子质 量或相对分子质量。
2. 摩尔质量
(1)定义:单位物质的量的物质所具有的质量,符号为M。
(2)单位:g mol-1或kg mol-1
(3)数值:数值等于该粒子的相对分子(原子)质量。
(4)摩尔质量与相对分子质量、相对原子质量的关系
类别 摩尔质量 相对分子(或原子)质量
相同点 对于同一物质或微粒来讲,摩尔质量以g mol-1为单位时,二者在数值上相等 符号 M Ar
含义 单位物质的量的物质具有的质量 该分子(或原子)的质量除以一个12C原子质量的1/12所得的数值
单位 g mol-1 1
实例(Na2CO3) 106g mol-1 106
3. 物质的质量(m),物质的量(n),摩尔质量(M)三者之间的关系
三、气体摩尔体积
1、影响物质体积大小的因素
影响因素
粒子大小
粒子数目
粒子间距离
固体或液体体积
气体体积
微观解释:
(1)固体或液体:粒子本身的“直径”远远大于粒子之间的距离,所以决定其体积大小的因素是粒子大小和粒子数目
(2)气体:分子间的距离远远大于分子本身的“直径”,所以T、P相同,任何气体粒子之间的距离可以看成相等的,因此粒子数相同的任何气体都具有相同的体积。也就是说同T、P下,同V的任何气体都含有相同数目粒子。
决
定
决
定
水(液态)
水蒸气(气态)
2、气体摩尔体积
(1)定义:单位物质的量的气体所占的体积,符号:Vm
单位:L ·mol-1 或m3·mol-1
适用范围:气体(单一或混合气体均可用)
(2)标准状况下(0℃,101kPa), 1mol 任何 气体的体积都约占22.4 L/mol。
25℃,101kPa时,气体摩尔体积约为24.5L ·mol-1 。
(3)计算公式:
注意:
①22.4L/mol 使用条件:适用气体,且一般指标准状况,即0℃、101kPa。
② 适用对象:必须是气态物质,单一或混合气体均可用。
※在标准状况下,水、乙醇等都不是气体。
③22.4L气体在标准状况下其物质的量是1mol,非标准状况下,22.4L气体的物质的量可能是1mol也可能不是1mol.
①是否为气体
②是否为标况( 0℃,101kPa)
③是否为1mol
t=0℃或T=273.15K
四、物质的量浓度
1.定义:单位体积溶液里所含溶质B的物质的量叫作溶质B的物质的量浓度。
2.符号:cB
3.单位:mol·L-1或mol·m-3
4.表达式:
注:①B表示溶液中所含的溶质,还可以表示构成溶质分子的其他粒子。
②溶液的体积不等于溶剂的体积(以L为单位),且不同物质(尤其是不同状态的物质的体积是没有加和性的)
③ 溶液的物质的量浓度与所取溶液的体积大小无关。
④用结晶水化合物配制溶液时,其溶质不应包含结晶水。(如CuSO4·5H2O,溶质是CuSO4)
物质的量浓度与质量分数的区别与联系
物质的量浓度 溶质的质量分数
溶质的单位 mol g
溶液的单位 L g
单位 mol·L-1 -
公式
特点 V相同,cB也相同的任何溶液中,所含nB 也相同,但wB 不一定相同 m相同,wB 也相同的任何溶液中,所含mB 相同,但nB 不一定相同。
换算公式 (ρ为g.mL-1 或g.cm-3)
同课章节目录
