新疆巴音郭楞蒙古自治州2024-2025学年高二下学期6月期末监测化学试卷(含答案)
文档属性
| 名称 | 新疆巴音郭楞蒙古自治州2024-2025学年高二下学期6月期末监测化学试卷(含答案) |  | |
| 格式 | docx | ||
| 文件大小 | 397.5KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 通用版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2025-07-04 14:36:03 | ||
图片预览


文档简介
2024—2025学年第二学期期末监测
高二年级化学
(考试时间:100分钟 总分:100分)
注意事项:
1.答题时,务必将自己的学校、班级、姓名、准考证号填写在答题卡规定的位置上。
2.答选择题时,必须使用2B铅笔将答题卡上对应题目的答案标号涂黑。如需改动,用橡皮擦擦干净后,再选涂其他答案标号。
3.答非选择题时,必须使用黑色墨水笔或黑色签字笔,将答案书写在答题卡规定的位置上。
4.所有题目必须在答题卡上作答,在试题卷上答题无效。
可能用到的相对原子质量:H 1 C 12 N 14 O 16 Si 28 Zr 91
一、选择题:本题共8小题,每小题2分,共16分。在每小题给出的四个选项中,只有一项符合题目要求。
1.下列有关有机物用途的叙述错误的是( )
A.95%的酒精溶液用于医用消毒 B.苯酚稀溶液可作消毒剂
C.工业上可用淀粉水解制葡萄糖 D.氧炔焰常用于焊接或切割金属
2.《格物粗谈》记载“红柿摘下未熟,每篮用木瓜三枚放入,得气即发,并无涩味。”文中的“气”是指( )
A.甲酸 B.乙烯 C.甲烷 D.乙炔
3.下列化学用语正确的是( )
A.氨基电子式: B.中子数为13的镁原子:
C.H O的空间结构模型: D.的键电子云:
4.下列分子属于非极性分子的是( )
A.CO B.H O C.SO D.O
5.玻璃器皿上沾有一些残留物,其洗涤方法错误的是( )
A.残留在试管内壁上的油脂,用热纯碱溶液洗涤
B.盛放氯化铁溶液试剂瓶内壁的红褐色固体,用氨水洗涤
C.做完银镜实验的试管,用稀硝酸洗涤
D.盛放过苯酚的试剂瓶中残留的苯酚,用酒精洗涤
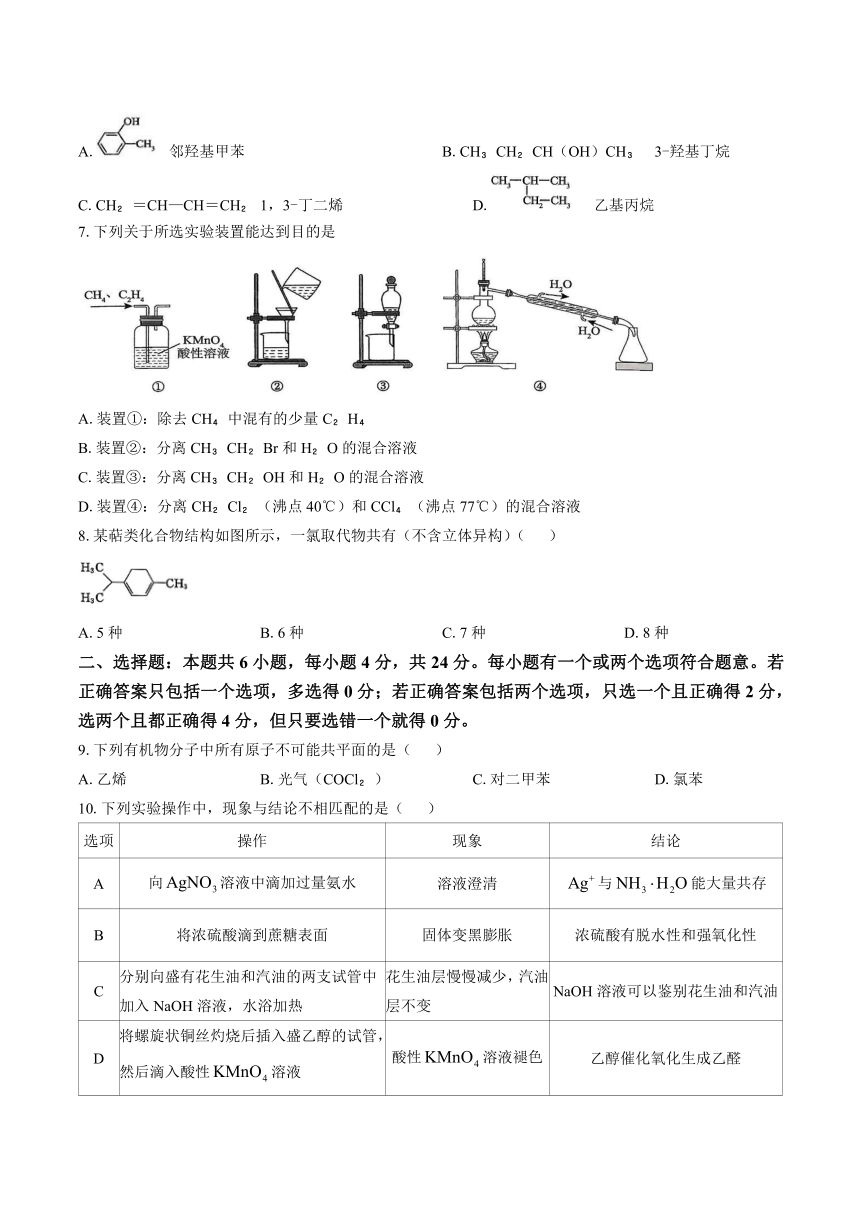
6.下列化合物的命名正确的是( )
A. 邻羟基甲苯 B.CH CH CH(OH)CH 3-羟基丁烷
C.CH =CH—CH=CH 1,3-丁二烯 D. 乙基丙烷
7.下列关于所选实验装置能达到目的是
A.装置①:除去CH 中混有的少量C H
B.装置②:分离CH CH Br和H O的混合溶液
C.装置③:分离CH CH OH和H O的混合溶液
D.装置④:分离CH Cl (沸点40℃)和CCl (沸点77℃)的混合溶液
8.某萜类化合物结构如图所示,一氯取代物共有(不含立体异构)( )
A.5种 B.6种 C.7种 D.8种
二、选择题:本题共6小题,每小题4分,共24分。每小题有一个或两个选项符合题意。若正确答案只包括一个选项,多选得0分;若正确答案包括两个选项,只选一个且正确得2分,选两个且都正确得4分,但只要选错一个就得0分。
9.下列有机物分子中所有原子不可能共平面的是( )
A.乙烯 B.光气(COCl ) C.对二甲苯 D.氯苯
10.下列实验操作中,现象与结论不相匹配的是( )
选项 操作 现象 结论
A 向溶液中滴加过量氨水 溶液澄清 与能大量共存
B 将浓硫酸滴到蔗糖表面 固体变黑膨胀 浓硫酸有脱水性和强氧化性
C 分别向盛有花生油和汽油的两支试管中加入NaOH溶液,水浴加热 花生油层慢慢减少,汽油层不变 NaOH溶液可以鉴别花生油和汽油
D 将螺旋状铜丝灼烧后插入盛乙醇的试管,然后滴入酸性溶液 酸性溶液褪色 乙醇催化氧化生成乙醛
11.一种从植物中提取的天然化合物可用于制作香水,其结构如下图所示,有关该化合物的下列说法正确的是( )
A.分子式为C H O B.存在酚类异构体
C.分子中含有三种官能团 D.既可发生银镜反应又可发生还原反应
12.短周期主族元素W、X、Y的原子序数依次增大,W的最高正价与最低负价代数和为0,W、X、Y形成的化合物甲的结构如图所示。下列说法正确的是( )
A.电负性大小:W>X B.原子半径大小:Y>W>X
C.X、Y形成的化合物为离子化合物 D.甲中阴离子的空间构型为三角锥形
13.水杨酸结构如下所示,过量的下列溶液与水杨酸反应能得到化学式为C H O Na的是( )
A.NaHCO 溶液 B.Na CO 溶液 C.NaOH溶液 D.NaCl溶液
14.下列关于生物大分子的说法中正确的是( )
A.核酸是一种生物大分子,由核苷酸聚合而成,核苷酸最终可以水解成磷酸、己糖和碱基
B.向蛋白质溶液中滴加饱和(NH ) SO 溶液,有固体析出,向固体中加足量蒸馏水,固体溶解
C.氨基酸是组成蛋白质的基本结构单位,分子中含有氨基和羧基,故可以发生消去反应,能与酸、碱反应生成盐
D.淀粉和纤维素是天然高分子化合物,都属于非还原性糖,不能被氢氧化铜氧化
三、非选择题:共5题,共60分。
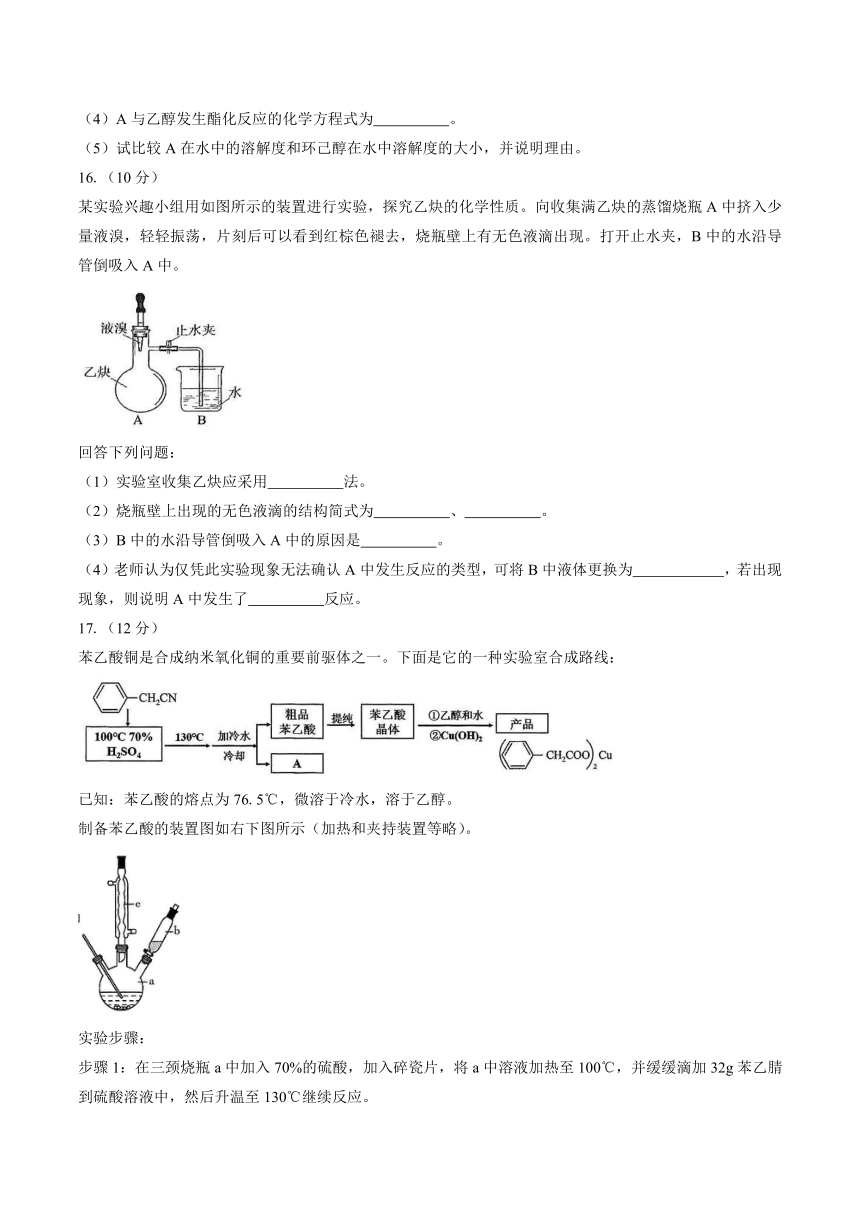
15.(10分)
莽草酸是合成治疗禽流感的药物——达菲的原料之一。有机物A是莽草酸的一种同分异构体。A的结构简式如右图所示,回答下列问题:
(1)A的分子式是 。
(2)A与溴的四氯化碳溶液发生化学反应的官能团名称为 。
(3)在右图中用“*”标出手性碳原子。
(4)A与乙醇发生酯化反应的化学方程式为 。
(5)试比较A在水中的溶解度和环己醇在水中溶解度的大小,并说明理由。
16.(10分)
某实验兴趣小组用如图所示的装置进行实验,探究乙炔的化学性质。向收集满乙炔的蒸馏烧瓶A中挤入少量液溴,轻轻振荡,片刻后可以看到红棕色褪去,烧瓶壁上有无色液滴出现。打开止水夹,B中的水沿导管倒吸入A中。
回答下列问题:
(1)实验室收集乙炔应采用 法。
(2)烧瓶壁上出现的无色液滴的结构简式为 、 。
(3)B中的水沿导管倒吸入A中的原因是 。
(4)老师认为仅凭此实验现象无法确认A中发生反应的类型,可将B中液体更换为 ,若出现 现象,则说明A中发生了 反应。
17.(12分)
苯乙酸铜是合成纳米氧化铜的重要前驱体之一。下面是它的一种实验室合成路线:
已知:苯乙酸的熔点为76.5℃,微溶于冷水,溶于乙醇。
制备苯乙酸的装置图如右下图所示(加热和夹持装置等略)。
实验步骤:
步骤1:在三颈烧瓶a中加入70%的硫酸,加入碎瓷片,将a中溶液加热至100℃,并缓缓滴加32g苯乙腈到硫酸溶液中,然后升温至130℃继续反应。
步骤2:反应结束后向混合液中加适量冷水,分离出苯乙酸粗品,并进行提纯。
步骤3:将得到的苯乙酸晶体加入乙醇与水的混合溶剂中,充分溶解后,加入Cu(OH) 搅拌30min,过滤,滤液静置一段时间,析出苯乙酸铜晶体。
回答下列问题:
(1)苯乙酸的结构简式是 ,仪器c的名称是 。
(2)稀释浓硫酸的操作方法是 。
(3)通过分离步骤1的残留液A可得到一种化肥为 。
(4)步骤2中加入冷水的目的是 ,过滤苯乙酸粗品所需玻璃仪器有漏斗、 、烧杯。
(5)最终得到28g苯乙酸晶体,则苯乙酸的产率是 (计算结果保留一位小数)。
18.(14分)
聚戊二酸丙二醇酯(PPG)是一种可降解的高分子材料,PPG的一种合成路线如下:
已知:
①烃A的分子式为C H ,核磁共振氢谱显示只有一种化学环境的氢;
②D、E为相对分子质量差14的同系物,E是福尔马林的溶质;
回答下列问题:
(1)A的结构简式为 ;F的官能团名称为 。
(2)PPG的合成路线中属于加成反应的是 (填序号)。
(3)按照系统命名法,G的名称为 。
(4)反应②的化学方程式为 。
(5)C的同分异构体中,与C的官能团种类和个数均相同,且核磁共振氢谱显示为2组峰的物质的结构简式为 。
(6)参照上述合成路线。写出以甲苯和D为有机原料制备肉桂醛()的路线(其他无机试剂任选)。
19.(14分)
“液态阳光”由中国科学院液态阳光研究组命名,指利用太阳能、风能等可再生能源分解水制氢,再将空气中的CO 加氢制成CH OH等液体燃料。
回答下列问题:
(1)硅太阳能电池是指以硅为基体材料的太阳能电池。
①写出Si元素位于周期表中的位置 ;其价层电子的轨道表示式是 。
②熔点比较:单晶硅 金刚石(选填“>”“<”或“=”),判断的理由是 。
(2)中杂化的原子为 。
(3)催化剂可实现(高选择性加氢合成(,晶胞结构如图1所示。
①图1中A代表 (填“”或“”)。
②晶胞沿z轴方向在xy平面的投影平面图如图2,如:d点的投影为图2中涂黑的部分,请在图2中涂黑并标注b微粒的位置。
③晶胞的晶胞参数是a pm,用表示阿伏加德罗常数的值,则该晶体的密度为 (用含a、的代数式表示)。
机密启用前
2024—2025学年第二学期期末监测
高二化学参考答案
评分说明:非选择题中,考生如给出其他符合题目要求的答案,同样得分。
一、选择题:本题共8小题,每小题2分,共16分。
题序 1 2 3 4 5 6 7 8
答案 A B D A B C D C
二、选择题:本题共6小题,每小题4分,共24分。每小题有一个或两个选项符合题意。若正确答案只包括一个选项,多选得0分;若正确答案包括两个选项,只选一个且正确得2分,选两个且都正确得4分,但只要选错一个就得0分。
题序 9 10 11 12 13 14
答案 C AD B BC A BD
三、非选择题:共5题,共60分。
15.(10分)
(1)
(2)碳碳双键
(3)
(4)
(5)A在水中的溶液度大于环己醇在水中的溶解度,因为A分子中有三个羟基和一个羧基都可以与水分子形成氢键,其分子极性远大于环己醇,故在水中的溶解度大。
16.(10分)
(1)排水法
(2)、
(3)乙炔气体与液溴反应生成液态产物,烧瓶中气压减小,故打开止水夹后,烧杯中1的水倒吸进入烧瓶。
(4)滴有紫色石蕊的水倒吸进入烧瓶中的石蕊溶液未变色 加成反应
17.(12分)
(1) 球形冷凝管
(2)沿烧杯内壁将浓硫酸缓缓倒入盛有水的烧杯中,边加边搅拌。
(3)硫酸铵[或]
(4)利于苯乙酸析出 玻璃棒
(5)75.3%
18.(14分)
(1);羟基,醛基
(2)④⑤
(3)1,3-丙二醇
(4)
(5)
(6)
19.(14分)
(1)①第三周期第ⅣA族
②< 单晶硅与金刚石均为共价晶体,碳原子半径小于硅原子,故金刚石中C—C键长更短,键能更大,熔点更高。
(2)C、O
(3)① ② ③
高二年级化学
(考试时间:100分钟 总分:100分)
注意事项:
1.答题时,务必将自己的学校、班级、姓名、准考证号填写在答题卡规定的位置上。
2.答选择题时,必须使用2B铅笔将答题卡上对应题目的答案标号涂黑。如需改动,用橡皮擦擦干净后,再选涂其他答案标号。
3.答非选择题时,必须使用黑色墨水笔或黑色签字笔,将答案书写在答题卡规定的位置上。
4.所有题目必须在答题卡上作答,在试题卷上答题无效。
可能用到的相对原子质量:H 1 C 12 N 14 O 16 Si 28 Zr 91
一、选择题:本题共8小题,每小题2分,共16分。在每小题给出的四个选项中,只有一项符合题目要求。
1.下列有关有机物用途的叙述错误的是( )
A.95%的酒精溶液用于医用消毒 B.苯酚稀溶液可作消毒剂
C.工业上可用淀粉水解制葡萄糖 D.氧炔焰常用于焊接或切割金属
2.《格物粗谈》记载“红柿摘下未熟,每篮用木瓜三枚放入,得气即发,并无涩味。”文中的“气”是指( )
A.甲酸 B.乙烯 C.甲烷 D.乙炔
3.下列化学用语正确的是( )
A.氨基电子式: B.中子数为13的镁原子:
C.H O的空间结构模型: D.的键电子云:
4.下列分子属于非极性分子的是( )
A.CO B.H O C.SO D.O
5.玻璃器皿上沾有一些残留物,其洗涤方法错误的是( )
A.残留在试管内壁上的油脂,用热纯碱溶液洗涤
B.盛放氯化铁溶液试剂瓶内壁的红褐色固体,用氨水洗涤
C.做完银镜实验的试管,用稀硝酸洗涤
D.盛放过苯酚的试剂瓶中残留的苯酚,用酒精洗涤
6.下列化合物的命名正确的是( )
A. 邻羟基甲苯 B.CH CH CH(OH)CH 3-羟基丁烷
C.CH =CH—CH=CH 1,3-丁二烯 D. 乙基丙烷
7.下列关于所选实验装置能达到目的是
A.装置①:除去CH 中混有的少量C H
B.装置②:分离CH CH Br和H O的混合溶液
C.装置③:分离CH CH OH和H O的混合溶液
D.装置④:分离CH Cl (沸点40℃)和CCl (沸点77℃)的混合溶液
8.某萜类化合物结构如图所示,一氯取代物共有(不含立体异构)( )
A.5种 B.6种 C.7种 D.8种
二、选择题:本题共6小题,每小题4分,共24分。每小题有一个或两个选项符合题意。若正确答案只包括一个选项,多选得0分;若正确答案包括两个选项,只选一个且正确得2分,选两个且都正确得4分,但只要选错一个就得0分。
9.下列有机物分子中所有原子不可能共平面的是( )
A.乙烯 B.光气(COCl ) C.对二甲苯 D.氯苯
10.下列实验操作中,现象与结论不相匹配的是( )
选项 操作 现象 结论
A 向溶液中滴加过量氨水 溶液澄清 与能大量共存
B 将浓硫酸滴到蔗糖表面 固体变黑膨胀 浓硫酸有脱水性和强氧化性
C 分别向盛有花生油和汽油的两支试管中加入NaOH溶液,水浴加热 花生油层慢慢减少,汽油层不变 NaOH溶液可以鉴别花生油和汽油
D 将螺旋状铜丝灼烧后插入盛乙醇的试管,然后滴入酸性溶液 酸性溶液褪色 乙醇催化氧化生成乙醛
11.一种从植物中提取的天然化合物可用于制作香水,其结构如下图所示,有关该化合物的下列说法正确的是( )
A.分子式为C H O B.存在酚类异构体
C.分子中含有三种官能团 D.既可发生银镜反应又可发生还原反应
12.短周期主族元素W、X、Y的原子序数依次增大,W的最高正价与最低负价代数和为0,W、X、Y形成的化合物甲的结构如图所示。下列说法正确的是( )
A.电负性大小:W>X B.原子半径大小:Y>W>X
C.X、Y形成的化合物为离子化合物 D.甲中阴离子的空间构型为三角锥形
13.水杨酸结构如下所示,过量的下列溶液与水杨酸反应能得到化学式为C H O Na的是( )
A.NaHCO 溶液 B.Na CO 溶液 C.NaOH溶液 D.NaCl溶液
14.下列关于生物大分子的说法中正确的是( )
A.核酸是一种生物大分子,由核苷酸聚合而成,核苷酸最终可以水解成磷酸、己糖和碱基
B.向蛋白质溶液中滴加饱和(NH ) SO 溶液,有固体析出,向固体中加足量蒸馏水,固体溶解
C.氨基酸是组成蛋白质的基本结构单位,分子中含有氨基和羧基,故可以发生消去反应,能与酸、碱反应生成盐
D.淀粉和纤维素是天然高分子化合物,都属于非还原性糖,不能被氢氧化铜氧化
三、非选择题:共5题,共60分。
15.(10分)
莽草酸是合成治疗禽流感的药物——达菲的原料之一。有机物A是莽草酸的一种同分异构体。A的结构简式如右图所示,回答下列问题:
(1)A的分子式是 。
(2)A与溴的四氯化碳溶液发生化学反应的官能团名称为 。
(3)在右图中用“*”标出手性碳原子。
(4)A与乙醇发生酯化反应的化学方程式为 。
(5)试比较A在水中的溶解度和环己醇在水中溶解度的大小,并说明理由。
16.(10分)
某实验兴趣小组用如图所示的装置进行实验,探究乙炔的化学性质。向收集满乙炔的蒸馏烧瓶A中挤入少量液溴,轻轻振荡,片刻后可以看到红棕色褪去,烧瓶壁上有无色液滴出现。打开止水夹,B中的水沿导管倒吸入A中。
回答下列问题:
(1)实验室收集乙炔应采用 法。
(2)烧瓶壁上出现的无色液滴的结构简式为 、 。
(3)B中的水沿导管倒吸入A中的原因是 。
(4)老师认为仅凭此实验现象无法确认A中发生反应的类型,可将B中液体更换为 ,若出现 现象,则说明A中发生了 反应。
17.(12分)
苯乙酸铜是合成纳米氧化铜的重要前驱体之一。下面是它的一种实验室合成路线:
已知:苯乙酸的熔点为76.5℃,微溶于冷水,溶于乙醇。
制备苯乙酸的装置图如右下图所示(加热和夹持装置等略)。
实验步骤:
步骤1:在三颈烧瓶a中加入70%的硫酸,加入碎瓷片,将a中溶液加热至100℃,并缓缓滴加32g苯乙腈到硫酸溶液中,然后升温至130℃继续反应。
步骤2:反应结束后向混合液中加适量冷水,分离出苯乙酸粗品,并进行提纯。
步骤3:将得到的苯乙酸晶体加入乙醇与水的混合溶剂中,充分溶解后,加入Cu(OH) 搅拌30min,过滤,滤液静置一段时间,析出苯乙酸铜晶体。
回答下列问题:
(1)苯乙酸的结构简式是 ,仪器c的名称是 。
(2)稀释浓硫酸的操作方法是 。
(3)通过分离步骤1的残留液A可得到一种化肥为 。
(4)步骤2中加入冷水的目的是 ,过滤苯乙酸粗品所需玻璃仪器有漏斗、 、烧杯。
(5)最终得到28g苯乙酸晶体,则苯乙酸的产率是 (计算结果保留一位小数)。
18.(14分)
聚戊二酸丙二醇酯(PPG)是一种可降解的高分子材料,PPG的一种合成路线如下:
已知:
①烃A的分子式为C H ,核磁共振氢谱显示只有一种化学环境的氢;
②D、E为相对分子质量差14的同系物,E是福尔马林的溶质;
回答下列问题:
(1)A的结构简式为 ;F的官能团名称为 。
(2)PPG的合成路线中属于加成反应的是 (填序号)。
(3)按照系统命名法,G的名称为 。
(4)反应②的化学方程式为 。
(5)C的同分异构体中,与C的官能团种类和个数均相同,且核磁共振氢谱显示为2组峰的物质的结构简式为 。
(6)参照上述合成路线。写出以甲苯和D为有机原料制备肉桂醛()的路线(其他无机试剂任选)。
19.(14分)
“液态阳光”由中国科学院液态阳光研究组命名,指利用太阳能、风能等可再生能源分解水制氢,再将空气中的CO 加氢制成CH OH等液体燃料。
回答下列问题:
(1)硅太阳能电池是指以硅为基体材料的太阳能电池。
①写出Si元素位于周期表中的位置 ;其价层电子的轨道表示式是 。
②熔点比较:单晶硅 金刚石(选填“>”“<”或“=”),判断的理由是 。
(2)中杂化的原子为 。
(3)催化剂可实现(高选择性加氢合成(,晶胞结构如图1所示。
①图1中A代表 (填“”或“”)。
②晶胞沿z轴方向在xy平面的投影平面图如图2,如:d点的投影为图2中涂黑的部分,请在图2中涂黑并标注b微粒的位置。
③晶胞的晶胞参数是a pm,用表示阿伏加德罗常数的值,则该晶体的密度为 (用含a、的代数式表示)。
机密启用前
2024—2025学年第二学期期末监测
高二化学参考答案
评分说明:非选择题中,考生如给出其他符合题目要求的答案,同样得分。
一、选择题:本题共8小题,每小题2分,共16分。
题序 1 2 3 4 5 6 7 8
答案 A B D A B C D C
二、选择题:本题共6小题,每小题4分,共24分。每小题有一个或两个选项符合题意。若正确答案只包括一个选项,多选得0分;若正确答案包括两个选项,只选一个且正确得2分,选两个且都正确得4分,但只要选错一个就得0分。
题序 9 10 11 12 13 14
答案 C AD B BC A BD
三、非选择题:共5题,共60分。
15.(10分)
(1)
(2)碳碳双键
(3)
(4)
(5)A在水中的溶液度大于环己醇在水中的溶解度,因为A分子中有三个羟基和一个羧基都可以与水分子形成氢键,其分子极性远大于环己醇,故在水中的溶解度大。
16.(10分)
(1)排水法
(2)、
(3)乙炔气体与液溴反应生成液态产物,烧瓶中气压减小,故打开止水夹后,烧杯中1的水倒吸进入烧瓶。
(4)滴有紫色石蕊的水倒吸进入烧瓶中的石蕊溶液未变色 加成反应
17.(12分)
(1) 球形冷凝管
(2)沿烧杯内壁将浓硫酸缓缓倒入盛有水的烧杯中,边加边搅拌。
(3)硫酸铵[或]
(4)利于苯乙酸析出 玻璃棒
(5)75.3%
18.(14分)
(1);羟基,醛基
(2)④⑤
(3)1,3-丙二醇
(4)
(5)
(6)
19.(14分)
(1)①第三周期第ⅣA族
②< 单晶硅与金刚石均为共价晶体,碳原子半径小于硅原子,故金刚石中C—C键长更短,键能更大,熔点更高。
(2)C、O
(3)① ② ③
同课章节目录
