2.1钠及其化合物-课时1-活泼金属单质-Na 课件(共41张PPT)高中化学 人教版(2019) 必修 第一册
文档属性
| 名称 | 2.1钠及其化合物-课时1-活泼金属单质-Na 课件(共41张PPT)高中化学 人教版(2019) 必修 第一册 |

|
|
| 格式 | pptx | ||
| 文件大小 | 47.8MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2025-07-04 22:19:22 | ||
图片预览







文档简介
(共41张PPT)
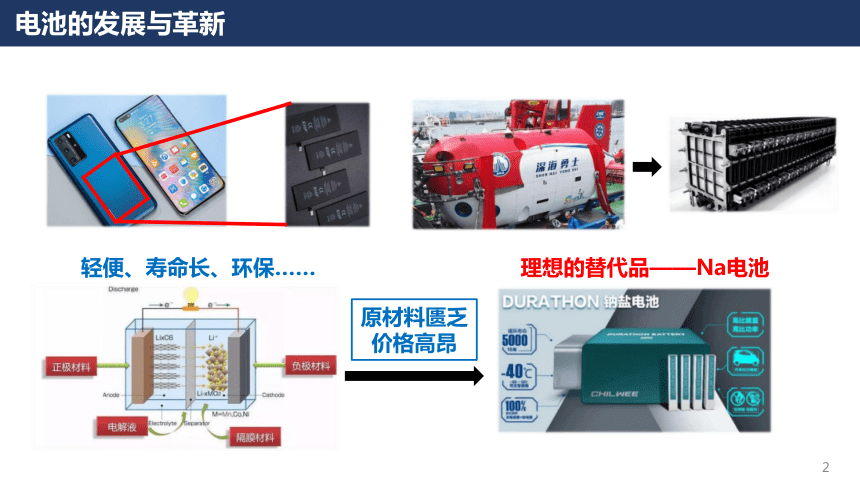
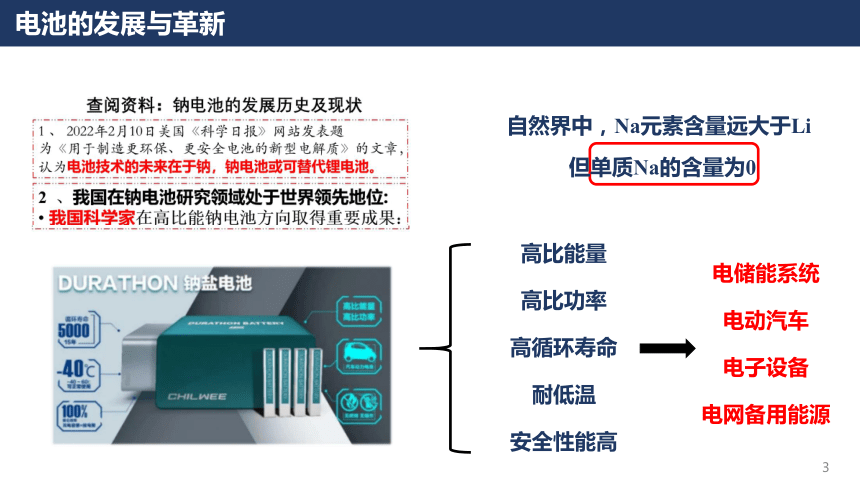
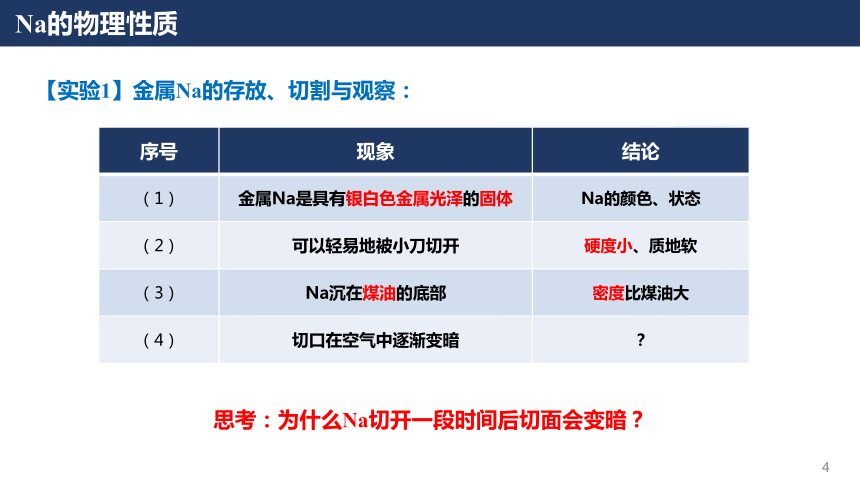
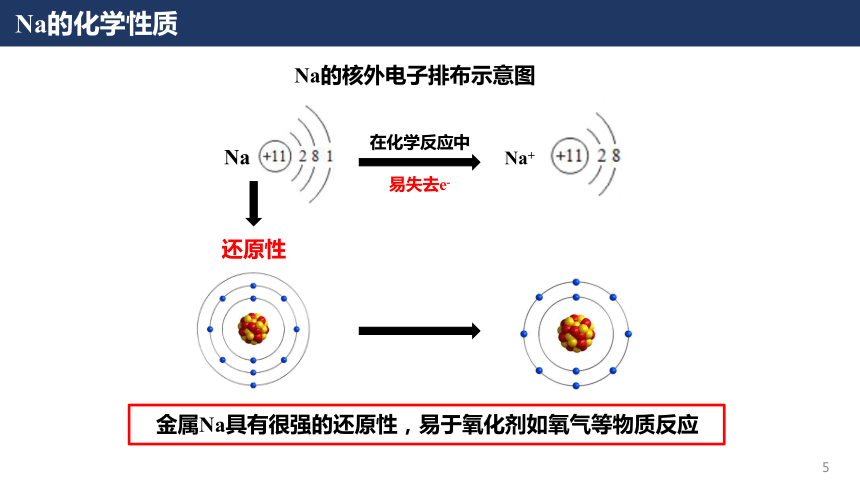
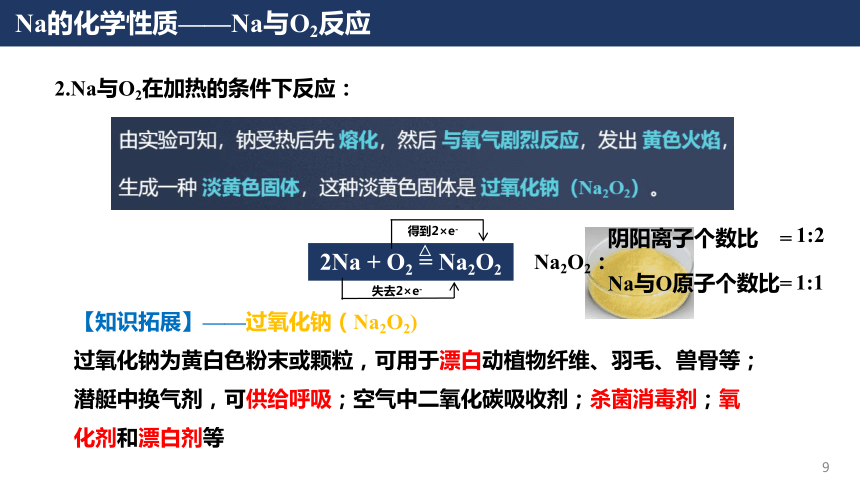
钠及其化合物第二章海水中的重要元素——钠和氯课时1活泼金属单质—Na电池的发展与革新轻便、寿命长、环保……原材料匮乏价格高昂理想的替代品——Na电池电池的发展与革新高比能量高比功率高循环寿命耐低温安全性能高电储能系统电动汽车电子设备电网备用能源自然界中,Na元素含量远大于Li但单质Na的含量为0Na的物理性质【实验1】金属Na的存放、切割与观察:思考:为什么Na切开一段时间后切面会变暗?序号现象结论(1)金属Na是具有银白色金属光泽的固体Na的颜色、状态(2)可以轻易地被小刀切开硬度小、质地软(3)Na沉在煤油的底部密度比煤油大(4)切口在空气中逐渐变暗?Na的化学性质Na的核外电子排布示意图Na在化学反应中Na+还原性易失去e-金属Na具有很强的还原性,易于氧化剂如氧气等物质反应Na的化学性质——Na与O2反应1.Na与O2在常温下反应生成氧化钠(Na2O):4Na + O2= 2Na2O思考:1.金属Na如何保存?2.保存Na的液体有什么性质?少量的Na保存在玻璃瓶中,并用煤油液封大量的Na保存在铁筒中,并用液体石蜡密封3.为什么Na都是以块状保存的,而不是做成钠粉保存?(白色固体)Na的化学性质——Na与O2反应2Fe + 3O2+ xH2O2Fe2O3·xH2O常温FeO·Fe2O3(Fe3O4)点燃3Fe + 2O2【资料】:金属Fe在不同条件下与氧气反应:思考:1.金属Na在不同条件下与氧气是否有不同的产物?如何验证?【提出猜想】:金属Na在O2中加热会生成其他物质Na的化学性质——Na与O2反应【实验验证】:金属Na与O2在加热条件下反应:序号现象(1)加热后Na先熔化成银白色小球(2)Na燃烧,发出黄色的火焰(3)燃烧之后的固体呈现为淡黄色实验器材与药品:坩埚、泥三角、三脚架、酒精灯、镊子、滤纸、小刀;金属Na:结论Na熔点低(97.8℃)Na可以在空气中燃烧Na与氧气反应生成新物质实验步骤:①搭建好实验仪器;②取出一块Na,用滤纸吸干表面煤油;③切取一块绿豆大小的Na,剩余的Na放回原瓶;④将切取的Na放入坩埚中,点燃酒精灯,观察实验现象Na的化学性质——Na与O2反应【知识拓展】——过氧化钠(Na2O2)过氧化钠为黄白色粉末或颗粒,可用于漂白动植物纤维、羽毛、兽骨等;潜艇中换气剂,可供给呼吸;空气中二氧化碳吸收剂;杀菌消毒剂;氧化剂和漂白剂等2Na + O2= Na2O2△2.Na与O2在加热的条件下反应:失去2×e-得到2×e-Na2O2:阴阳离子个数比=Na与O原子个数比=1:21:1Na的化学性质——Na与其他非金属单质反应3.Na与其他非金属单质反应(体现Na的还原性):·依据Na与氧气反应的方程式,分别写出Na与Cl2(点燃)、S(加热)反应的化学方程式:2 Na + Cl22 NaCl2 Na + S Na2S点燃加热若条件改为研磨易爆炸·写出Na在氢气中加热的化学方程式:2 Na + H22NaH△强还原剂,遇水放出氢气-1Na的化学性质——Na与H2O反应【资料】Na可以作为除水剂,除去一些有机溶剂中残留的水分:请大家从物质组成和氧化还原知识的角度,推测一下Na与H2O反应的产物?【实验】Na与H2O的反应:序号现象(1)钠浮在水面上(2)熔成光亮的小球(3)钠小球在水面迅速游动(4)发出“嘶嘶”声响(5)滴有酚酞溶液的水变红结论密度小于水反应放热且Na熔点低反应产生了气体反应剧烈且生成气体产生碱性物质实验器材与药品:烧杯、镊子、滤纸、小刀;金属Na、水、酚酞实验步骤:①取出一块钠,用滤纸吸干表面煤油;②切取一块绿豆大小的Na,将剩余Na放回试剂瓶;③在盛有一定水的烧杯中加入2滴酚酞试液,再小心地加入Na,观察实验现象Na的化学性质——Na与H2O反应思考:该实验有什么缺点?如何检验反应产生的H2?4.Na与H2O反应:2Na + 2H2O = 2NaOH + H2↑现象:浮、熔、游、响、红Na的化学性质——Na与H2O反应【实验改进】氢气的检验:如果氢气不纯——发出尖锐的爆鸣声如果氢气纯净——发出“噗”的声音Na的化学性质——Na溶液的反应思考:为什么反应产物是NH3而非NH3·H2O?4.Na与NH4Cl溶液反应:2Na + 2NH4Cl = 2NH3↑ + 2NaCl + H2↑2 Na + 2 H2O = 2 NaOH + H2↑NaOH + NH4Cl = NH3↑ + NaCl + H2O①②总反应:5.Na与稀HCl反应:2Na + 2HCl = 2NaCl + H2↑总反应:Na的化学性质——Na溶液的反应【资料】:思考:等物质的量的金属Na与水、等浓度的NH4Cl溶液和稀HCl反应的速率有何差异?为什么?与Na反应的试剂溶液的pHNa块消失的时间H2O7.026 sNH4Cl5.121 sHCl1.013 s0.1 mol/LNa的化学性质——Na与水/水溶液反应的本质Na与水溶液中的 H+反应,自身成为 Na+,H+得电子生成氢气Na与H2O或水溶液反应的本质:思考1:为什么H2O中有H+?H2O OH-+ H+水的电离思考2:Na与浓HCl反应速率与稀HCl反应速率(大于/小于/等于)实验序号12345678盐酸浓度(mol/L)00.050.100.501.001.503.06.0Na消失时间20 s18 s13 s11 s21 s37 s65 s114 sNa与不同浓度盐酸反应结果Na的化学性质——Na与水/水溶液反应的本质【实验】Na与浓HCl的反应:实验器材与药品:烧杯、镊子、滤纸、小刀;金属Na、浓HCl实验步骤:①取出一块钠,用滤纸吸干表面煤油;②切取一块绿豆大小的Na,将剩余Na放回试剂瓶;③把Na放入盛有浓盐酸的烧杯中,观察现象;浓盐酸中含有大量Cl-,反应生成的氯化钠在浓盐酸中的溶解度很小,因此会析出NaClNa的化学性质——Na与水/水溶液反应的本质思考:Na与CuSO4溶液能否置换出Cu?2 Fe + CuSO4=Cu+ FeSO42 Na + CuSO4=Cu+ Na2SO4 【实验】Na与CuSO4溶液的反应:实验器材与药品:烧杯、镊子、滤纸、小刀;金属Na、硫酸铜溶液实验步骤:①取出一块钠,用滤纸吸干表面煤油;②切取一块绿豆大小的Na,将剩余Na放回试剂瓶;③把Na放入盛有硫酸铜溶液的烧杯中,观察现象;Na的化学性质——Na与水/水溶液反应的本质思考:为什么Cu2+的氧化性更强,而Na却不与Cu2+反应?实验结果:结果分析:已知:氧化性:H+Cu2+<Na的化学性质——Na与水/水溶液反应的本质四水合铜离子·反应微观示意图:[Cu(H2O)4]2+Na与Cu2+几乎没有机会接触Na与水的反应速率远大于Cu2+水的浓度远大于四水合铜离子铜离子以四水合铜离子的形式存在Na的化学性质——Na与水/水溶液反应的本质6.Na的化学性质——Na与硫酸铜水溶液反应:·Na与CuSO4溶液反应:·Na与溶液反应的规律:①先考虑Na与H2O反应(若为酸溶液则先与酸中的氢离子反应),生成NaOH(消耗了H2O)②再考虑NaOH与溶液中的物质发生反应③Na与水溶液反应放热(影响溶质的溶解度)Na的化学性质——Na与水/水溶液反应的本质6.Na的化学性质——Na与硫酸铜水溶液反应:·当硫酸铜浓度较大或放入的Na块较大时:思考:为什么最后会有黑色物质生成?Cu(OH)2= CuO + H2O△氢氧化铜分解温度低Na的化学性质——Na与饱和溶液反应7.Na的化学性质——Na与饱和溶液的反应:①Na与饱和Ca(OH)2溶液反应:温度升高,Ca(OH)2析出现象:溶液中析出白色固体①Ca(OH)2的溶解度随温度升高而降低②Na与饱和NaCl溶液反应:现象:溶液中析出白色固体NaCl溶解度受温度影响不大Na+浓度增加,NaCl过饱和2Na + 2H2O = 2NaOH + H2↑2Na + 2H2O = 2NaOH + H2↑②反应消耗了H2O②反应生成了OH-,Ca(OH)2过饱和反应消耗了H2ONa的化学性质——Na在非水条件下的反应思考:Na与CuSO4真的无法发生置换反应吗?8.Na的化学性质——Na与CuSO4在非水条件下的反应:①Na与熔融CuSO4反应:2Na + CuSO4(熔融)= Na2SO4+ Cu②Na与CuSO4的丙酮溶液反应:2Na + CuSO4= Na2SO4+ Cu【丙酮:一种常用的有机溶剂,分子式为(C3H6O)】Na的化学性质——Na的用途之一:冶炼9.Na的化学性质——Na与熔融金属盐反应冶炼金属:4Na + TiCl4(熔融)= Ti + 4NaCl①Na与熔融TiCl4反应:②Na与熔融KCl反应:Na + KCl (熔融)= K + NaCl思考:该反应为什么能发生?【资料】在工业上,该反应的温度在850℃左右,而K的沸点为759℃,Na的沸点为881℃,因此K不断逸出体系,使得该反应能够发生焰色试验——一种检验金属离子的方法很多金属或其化合物在燃烧时都会呈现独特的火焰颜色:透过蓝色钴玻璃后观察焰色试验——一种检验金属离子的方法焰色试验——一种检验金属离子的方法【实验】一些金属离子的焰色试验:【步骤】1.将铂丝放在酒精灯外焰上灼烧,再蘸取对应金属离子的盐溶液;2.蘸取后在酒精灯外焰上灼烧,观察火焰颜色;3.用稀盐酸洗涤铂丝,在酒精灯外焰上灼烧;4.再蘸取其他金属离子的盐溶液并灼烧、观察。焰色试验是物理变化还是化学变化?金属离子的电子发生跃迁焰色试验跃迁以光能的形式释放电子不同金属所释放出的能量不同,体现为光的颜色不同金属离子的电子发生跃迁焰色试验思考:为什么要用盐酸洗涤铂丝?金属的焰色试验做完之后可能有金属离子残留在铂丝上面,用盐酸洗涤这些物质,形成对应的金属氯化物,在火焰上烧的时候可以将这些物质分解挥发思考:为什么要用铂丝做焰色试验?——如果用玻璃棒会出现什么现象?玻璃棒的主要成分为硅酸钠(Na2SiO3),会引入Na+,会干扰其他金属离子的焰色试验酒精灯的火焰为什么是黄色的?焰色试验Na的化学性质——Na制备非金属单质10.Na的化学性质——Na制备非金属单质:①Na与CCl4反应:4Na + CCl4==== C + 4NaCl一定条件【资料】中国科学技术大学的钱逸泰教授等以CCl4和金属钠为原料,在700℃时反应制造出纳米级金刚石粉末和另一种化合物。该成果发表在世界权威的《科学》杂志上,被科学家们高度评价为“稻草变黄金”钱逸泰院士在一定条件下可以成为金刚石Na的化学性质——Na制备非金属单质②Na与CO2反应:4Na + 3CO2= C + 2Na2CO3△思考:Na着火如何灭火?有的灭火剂中含有水、有的灭火剂中含有CO2,都能与Na发生反应干燥的沙土盖灭Na的用途——高压Na灯【原理】在通电下,高压钠灯中的Na成为Na蒸汽,灯管内放出的电子撞击Na原子,使其获得能量并以光的形式释放出来【优点】高压Na灯具有发光效率高、耗电少、寿命长、透雾能力强和不诱虫等优点。广泛应用于照明场所Na的用途——高压Na灯Na电光源,制作高压钠灯原子反应堆的导热剂制备各类含Na的化合物有机化学中的除水剂强还原剂,冶炼Ti等金属Na电池等思考:Na用途如此之广,如何批量生产Na Na的冶炼10.金属Na的冶炼:2NaCl (熔融)==== 2Na + Cl2↑通电思考:类比初中所学的电解水实验,思考电解熔融NaCl时阴极和阳极产物?阴极产物阳极产物练习答案:A;钠的密度介于水和煤油之间,所以钠在煤油和水的界面处,钠与水反应有气泡产生,固体上下跳动,至钠消失。向一小烧杯中加入等体积的水和煤油,片刻后再向该烧杯中轻缓的加入一绿豆大小的金属钠,可能观察到的现象是()总结:活泼金属单质——NaNa与O2的反应4Na + O2= 2Na2O2Na + O2= Na2O2△2 Na + Cl22 NaCl2 Na + S Na2S点燃加热2 Na + H22NaH△Na与其他非金属单质的反应(研磨易爆炸)Na与H2O(溶液)的反应浮熔游响红NaOH + NH4Cl = NH3↑ + NaCl + H2O2Na + 2HCl = 2NaCl + H2↑2Na + 2H2O = 2NaOH + H2↑氧化钠与过氧化钠的比较名称氧化钠过氧化钠化学式Na2ONa2O2氧元素价态-2-1物理性质(颜色、状态)白色固体淡黄色固体物质类别碱性氧化物过氧化物用途制备Na的各类化合物供氧剂、漂白剂、杀菌剂保存密封保存总结:活泼金属单质——NaNa冶炼金属2Na + CuSO4+ 2H2O = Na2SO4+ H2↑+Cu(OH)2△CuO氢氧化铜分解温度低本质:Na与水溶液中的H+的反应Na与饱和溶液的反应饱和Ca(OH)2溶液饱和NaCl溶液①先考虑Na与H2O反应,生成NaOH(消耗了H2O)②再考虑NaOH与溶液中的物质发生反应③Na与水溶液反应放热(影响溶质的溶解度)4Na + TiCl4(熔融)= Ti + 4NaClNa + KCl (熔融)= K + NaCl2Na + CuSO4(熔融)= Na2SO4+ Cu总结:活泼金属单质——NaNa制备非金属4Na + CCl4==== C + 4NaCl一定条件4Na + 3CO2= C + 2Na2CO3△2NaCl (熔融)==== 2Na + Cl2↑Na的制备通电焰色试验课后探究:1.请解释我国的制钠厂为什么没建在海边 2.请查阅资料了解钠电池的研究进展。
钠及其化合物第二章海水中的重要元素——钠和氯课时1活泼金属单质—Na电池的发展与革新轻便、寿命长、环保……原材料匮乏价格高昂理想的替代品——Na电池电池的发展与革新高比能量高比功率高循环寿命耐低温安全性能高电储能系统电动汽车电子设备电网备用能源自然界中,Na元素含量远大于Li但单质Na的含量为0Na的物理性质【实验1】金属Na的存放、切割与观察:思考:为什么Na切开一段时间后切面会变暗?序号现象结论(1)金属Na是具有银白色金属光泽的固体Na的颜色、状态(2)可以轻易地被小刀切开硬度小、质地软(3)Na沉在煤油的底部密度比煤油大(4)切口在空气中逐渐变暗?Na的化学性质Na的核外电子排布示意图Na在化学反应中Na+还原性易失去e-金属Na具有很强的还原性,易于氧化剂如氧气等物质反应Na的化学性质——Na与O2反应1.Na与O2在常温下反应生成氧化钠(Na2O):4Na + O2= 2Na2O思考:1.金属Na如何保存?2.保存Na的液体有什么性质?少量的Na保存在玻璃瓶中,并用煤油液封大量的Na保存在铁筒中,并用液体石蜡密封3.为什么Na都是以块状保存的,而不是做成钠粉保存?(白色固体)Na的化学性质——Na与O2反应2Fe + 3O2+ xH2O2Fe2O3·xH2O常温FeO·Fe2O3(Fe3O4)点燃3Fe + 2O2【资料】:金属Fe在不同条件下与氧气反应:思考:1.金属Na在不同条件下与氧气是否有不同的产物?如何验证?【提出猜想】:金属Na在O2中加热会生成其他物质Na的化学性质——Na与O2反应【实验验证】:金属Na与O2在加热条件下反应:序号现象(1)加热后Na先熔化成银白色小球(2)Na燃烧,发出黄色的火焰(3)燃烧之后的固体呈现为淡黄色实验器材与药品:坩埚、泥三角、三脚架、酒精灯、镊子、滤纸、小刀;金属Na:结论Na熔点低(97.8℃)Na可以在空气中燃烧Na与氧气反应生成新物质实验步骤:①搭建好实验仪器;②取出一块Na,用滤纸吸干表面煤油;③切取一块绿豆大小的Na,剩余的Na放回原瓶;④将切取的Na放入坩埚中,点燃酒精灯,观察实验现象Na的化学性质——Na与O2反应【知识拓展】——过氧化钠(Na2O2)过氧化钠为黄白色粉末或颗粒,可用于漂白动植物纤维、羽毛、兽骨等;潜艇中换气剂,可供给呼吸;空气中二氧化碳吸收剂;杀菌消毒剂;氧化剂和漂白剂等2Na + O2= Na2O2△2.Na与O2在加热的条件下反应:失去2×e-得到2×e-Na2O2:阴阳离子个数比=Na与O原子个数比=1:21:1Na的化学性质——Na与其他非金属单质反应3.Na与其他非金属单质反应(体现Na的还原性):·依据Na与氧气反应的方程式,分别写出Na与Cl2(点燃)、S(加热)反应的化学方程式:2 Na + Cl22 NaCl2 Na + S Na2S点燃加热若条件改为研磨易爆炸·写出Na在氢气中加热的化学方程式:2 Na + H22NaH△强还原剂,遇水放出氢气-1Na的化学性质——Na与H2O反应【资料】Na可以作为除水剂,除去一些有机溶剂中残留的水分:请大家从物质组成和氧化还原知识的角度,推测一下Na与H2O反应的产物?【实验】Na与H2O的反应:序号现象(1)钠浮在水面上(2)熔成光亮的小球(3)钠小球在水面迅速游动(4)发出“嘶嘶”声响(5)滴有酚酞溶液的水变红结论密度小于水反应放热且Na熔点低反应产生了气体反应剧烈且生成气体产生碱性物质实验器材与药品:烧杯、镊子、滤纸、小刀;金属Na、水、酚酞实验步骤:①取出一块钠,用滤纸吸干表面煤油;②切取一块绿豆大小的Na,将剩余Na放回试剂瓶;③在盛有一定水的烧杯中加入2滴酚酞试液,再小心地加入Na,观察实验现象Na的化学性质——Na与H2O反应思考:该实验有什么缺点?如何检验反应产生的H2?4.Na与H2O反应:2Na + 2H2O = 2NaOH + H2↑现象:浮、熔、游、响、红Na的化学性质——Na与H2O反应【实验改进】氢气的检验:如果氢气不纯——发出尖锐的爆鸣声如果氢气纯净——发出“噗”的声音Na的化学性质——Na溶液的反应思考:为什么反应产物是NH3而非NH3·H2O?4.Na与NH4Cl溶液反应:2Na + 2NH4Cl = 2NH3↑ + 2NaCl + H2↑2 Na + 2 H2O = 2 NaOH + H2↑NaOH + NH4Cl = NH3↑ + NaCl + H2O①②总反应:5.Na与稀HCl反应:2Na + 2HCl = 2NaCl + H2↑总反应:Na的化学性质——Na溶液的反应【资料】:思考:等物质的量的金属Na与水、等浓度的NH4Cl溶液和稀HCl反应的速率有何差异?为什么?与Na反应的试剂溶液的pHNa块消失的时间H2O7.026 sNH4Cl5.121 sHCl1.013 s0.1 mol/LNa的化学性质——Na与水/水溶液反应的本质Na与水溶液中的 H+反应,自身成为 Na+,H+得电子生成氢气Na与H2O或水溶液反应的本质:思考1:为什么H2O中有H+?H2O OH-+ H+水的电离思考2:Na与浓HCl反应速率与稀HCl反应速率(大于/小于/等于)实验序号12345678盐酸浓度(mol/L)00.050.100.501.001.503.06.0Na消失时间20 s18 s13 s11 s21 s37 s65 s114 sNa与不同浓度盐酸反应结果Na的化学性质——Na与水/水溶液反应的本质【实验】Na与浓HCl的反应:实验器材与药品:烧杯、镊子、滤纸、小刀;金属Na、浓HCl实验步骤:①取出一块钠,用滤纸吸干表面煤油;②切取一块绿豆大小的Na,将剩余Na放回试剂瓶;③把Na放入盛有浓盐酸的烧杯中,观察现象;浓盐酸中含有大量Cl-,反应生成的氯化钠在浓盐酸中的溶解度很小,因此会析出NaClNa的化学性质——Na与水/水溶液反应的本质思考:Na与CuSO4溶液能否置换出Cu?2 Fe + CuSO4=Cu+ FeSO42 Na + CuSO4=Cu+ Na2SO4 【实验】Na与CuSO4溶液的反应:实验器材与药品:烧杯、镊子、滤纸、小刀;金属Na、硫酸铜溶液实验步骤:①取出一块钠,用滤纸吸干表面煤油;②切取一块绿豆大小的Na,将剩余Na放回试剂瓶;③把Na放入盛有硫酸铜溶液的烧杯中,观察现象;Na的化学性质——Na与水/水溶液反应的本质思考:为什么Cu2+的氧化性更强,而Na却不与Cu2+反应?实验结果:结果分析:已知:氧化性:H+Cu2+<Na的化学性质——Na与水/水溶液反应的本质四水合铜离子·反应微观示意图:[Cu(H2O)4]2+Na与Cu2+几乎没有机会接触Na与水的反应速率远大于Cu2+水的浓度远大于四水合铜离子铜离子以四水合铜离子的形式存在Na的化学性质——Na与水/水溶液反应的本质6.Na的化学性质——Na与硫酸铜水溶液反应:·Na与CuSO4溶液反应:·Na与溶液反应的规律:①先考虑Na与H2O反应(若为酸溶液则先与酸中的氢离子反应),生成NaOH(消耗了H2O)②再考虑NaOH与溶液中的物质发生反应③Na与水溶液反应放热(影响溶质的溶解度)Na的化学性质——Na与水/水溶液反应的本质6.Na的化学性质——Na与硫酸铜水溶液反应:·当硫酸铜浓度较大或放入的Na块较大时:思考:为什么最后会有黑色物质生成?Cu(OH)2= CuO + H2O△氢氧化铜分解温度低Na的化学性质——Na与饱和溶液反应7.Na的化学性质——Na与饱和溶液的反应:①Na与饱和Ca(OH)2溶液反应:温度升高,Ca(OH)2析出现象:溶液中析出白色固体①Ca(OH)2的溶解度随温度升高而降低②Na与饱和NaCl溶液反应:现象:溶液中析出白色固体NaCl溶解度受温度影响不大Na+浓度增加,NaCl过饱和2Na + 2H2O = 2NaOH + H2↑2Na + 2H2O = 2NaOH + H2↑②反应消耗了H2O②反应生成了OH-,Ca(OH)2过饱和反应消耗了H2ONa的化学性质——Na在非水条件下的反应思考:Na与CuSO4真的无法发生置换反应吗?8.Na的化学性质——Na与CuSO4在非水条件下的反应:①Na与熔融CuSO4反应:2Na + CuSO4(熔融)= Na2SO4+ Cu②Na与CuSO4的丙酮溶液反应:2Na + CuSO4= Na2SO4+ Cu【丙酮:一种常用的有机溶剂,分子式为(C3H6O)】Na的化学性质——Na的用途之一:冶炼9.Na的化学性质——Na与熔融金属盐反应冶炼金属:4Na + TiCl4(熔融)= Ti + 4NaCl①Na与熔融TiCl4反应:②Na与熔融KCl反应:Na + KCl (熔融)= K + NaCl思考:该反应为什么能发生?【资料】在工业上,该反应的温度在850℃左右,而K的沸点为759℃,Na的沸点为881℃,因此K不断逸出体系,使得该反应能够发生焰色试验——一种检验金属离子的方法很多金属或其化合物在燃烧时都会呈现独特的火焰颜色:透过蓝色钴玻璃后观察焰色试验——一种检验金属离子的方法焰色试验——一种检验金属离子的方法【实验】一些金属离子的焰色试验:【步骤】1.将铂丝放在酒精灯外焰上灼烧,再蘸取对应金属离子的盐溶液;2.蘸取后在酒精灯外焰上灼烧,观察火焰颜色;3.用稀盐酸洗涤铂丝,在酒精灯外焰上灼烧;4.再蘸取其他金属离子的盐溶液并灼烧、观察。焰色试验是物理变化还是化学变化?金属离子的电子发生跃迁焰色试验跃迁以光能的形式释放电子不同金属所释放出的能量不同,体现为光的颜色不同金属离子的电子发生跃迁焰色试验思考:为什么要用盐酸洗涤铂丝?金属的焰色试验做完之后可能有金属离子残留在铂丝上面,用盐酸洗涤这些物质,形成对应的金属氯化物,在火焰上烧的时候可以将这些物质分解挥发思考:为什么要用铂丝做焰色试验?——如果用玻璃棒会出现什么现象?玻璃棒的主要成分为硅酸钠(Na2SiO3),会引入Na+,会干扰其他金属离子的焰色试验酒精灯的火焰为什么是黄色的?焰色试验Na的化学性质——Na制备非金属单质10.Na的化学性质——Na制备非金属单质:①Na与CCl4反应:4Na + CCl4==== C + 4NaCl一定条件【资料】中国科学技术大学的钱逸泰教授等以CCl4和金属钠为原料,在700℃时反应制造出纳米级金刚石粉末和另一种化合物。该成果发表在世界权威的《科学》杂志上,被科学家们高度评价为“稻草变黄金”钱逸泰院士在一定条件下可以成为金刚石Na的化学性质——Na制备非金属单质②Na与CO2反应:4Na + 3CO2= C + 2Na2CO3△思考:Na着火如何灭火?有的灭火剂中含有水、有的灭火剂中含有CO2,都能与Na发生反应干燥的沙土盖灭Na的用途——高压Na灯【原理】在通电下,高压钠灯中的Na成为Na蒸汽,灯管内放出的电子撞击Na原子,使其获得能量并以光的形式释放出来【优点】高压Na灯具有发光效率高、耗电少、寿命长、透雾能力强和不诱虫等优点。广泛应用于照明场所Na的用途——高压Na灯Na电光源,制作高压钠灯原子反应堆的导热剂制备各类含Na的化合物有机化学中的除水剂强还原剂,冶炼Ti等金属Na电池等思考:Na用途如此之广,如何批量生产Na Na的冶炼10.金属Na的冶炼:2NaCl (熔融)==== 2Na + Cl2↑通电思考:类比初中所学的电解水实验,思考电解熔融NaCl时阴极和阳极产物?阴极产物阳极产物练习答案:A;钠的密度介于水和煤油之间,所以钠在煤油和水的界面处,钠与水反应有气泡产生,固体上下跳动,至钠消失。向一小烧杯中加入等体积的水和煤油,片刻后再向该烧杯中轻缓的加入一绿豆大小的金属钠,可能观察到的现象是()总结:活泼金属单质——NaNa与O2的反应4Na + O2= 2Na2O2Na + O2= Na2O2△2 Na + Cl22 NaCl2 Na + S Na2S点燃加热2 Na + H22NaH△Na与其他非金属单质的反应(研磨易爆炸)Na与H2O(溶液)的反应浮熔游响红NaOH + NH4Cl = NH3↑ + NaCl + H2O2Na + 2HCl = 2NaCl + H2↑2Na + 2H2O = 2NaOH + H2↑氧化钠与过氧化钠的比较名称氧化钠过氧化钠化学式Na2ONa2O2氧元素价态-2-1物理性质(颜色、状态)白色固体淡黄色固体物质类别碱性氧化物过氧化物用途制备Na的各类化合物供氧剂、漂白剂、杀菌剂保存密封保存总结:活泼金属单质——NaNa冶炼金属2Na + CuSO4+ 2H2O = Na2SO4+ H2↑+Cu(OH)2△CuO氢氧化铜分解温度低本质:Na与水溶液中的H+的反应Na与饱和溶液的反应饱和Ca(OH)2溶液饱和NaCl溶液①先考虑Na与H2O反应,生成NaOH(消耗了H2O)②再考虑NaOH与溶液中的物质发生反应③Na与水溶液反应放热(影响溶质的溶解度)4Na + TiCl4(熔融)= Ti + 4NaClNa + KCl (熔融)= K + NaCl2Na + CuSO4(熔融)= Na2SO4+ Cu总结:活泼金属单质——NaNa制备非金属4Na + CCl4==== C + 4NaCl一定条件4Na + 3CO2= C + 2Na2CO3△2NaCl (熔融)==== 2Na + Cl2↑Na的制备通电焰色试验课后探究:1.请解释我国的制钠厂为什么没建在海边 2.请查阅资料了解钠电池的研究进展。
