第五章 第二节 氮及其化合物第2课时--人教版高中化学必修第二册教学课件(共24张PPT)
文档属性
| 名称 | 第五章 第二节 氮及其化合物第2课时--人教版高中化学必修第二册教学课件(共24张PPT) |  | |
| 格式 | pptx | ||
| 文件大小 | 5.6MB | ||
| 资源类型 | 试卷 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2025-07-08 08:49:47 | ||
图片预览








文档简介
(共24张PPT)
第2课时 氨和铵盐
第二节 氮及其化合物
化学
1. 通过“价 -类”二维图的角度设计铵态氮肥、氨态氮肥的转化路径,构建基于物质类别认识物质转化的模型,能设计实验验证预测路径,发展证据推理与科学探究的核心素养。
2.通过“先价后类”的角度设计硝态氮肥的转化路径,构建基于元素价态认识物质转化的模型,能够基于材料进行分析推理,发展宏观辨识与微观探析的核心素养。
3.通过总结氨气的转化思路,进一步运用复分解反应原理及氧化还原原理实现物质转化的推断,能设计验证实验,优化设计方案完成整体分析。
学习目标
重点:
不同含氮物质间的转化与物质转化思维模型的构建。
难点:
基于实验目的设计方案、评价与优化实验的方案并能寻求证据证明。
学习重难点
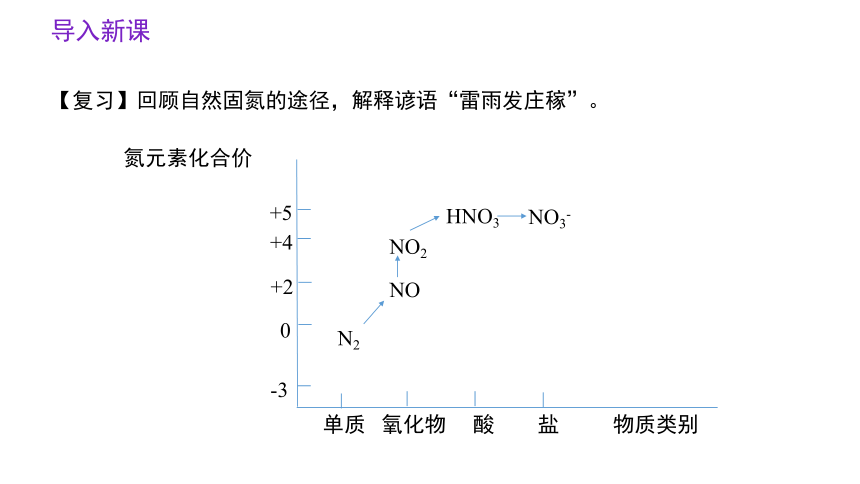
导入新课
氮元素化合价
+5
+4
+2
0
-3
单质 氧化物 酸 盐 物质类别
NO
NO2
HNO3
NO3-
N2
【复习】回顾自然固氮的途径,解释谚语“雷雨发庄稼”。
导入新课
认识氮肥及其种类
氨态氮肥
如NH3·H2O
硝态氮肥
如KNO3
NaNO3
铵态氮肥
如NH4Cl
NH4HCO3
硝铵态氮肥
如NH4NO3
有机态氮肥
CO(NH2)2
导入新课
氮肥的生产基石——合成氨工业
【问题1-1】比较高能固氮与生物固氮的转化条件,尝试思考由人工实现氮气制备氮肥的途径。
模拟自然固氮途径:①N2→NO→NO2→HNO3→NO3—;②N2→NH3→NH4+。
但是氮气和氧气生成 NO,能耗大、产量低,不适合工业生产。
导入新课
氮肥的生产基石——合成氨工业
【问题1-2】氨气的物理性质?是否适合用于农作物的肥料?
无色、有刺激性气味的气体;密度大于空气。
因为常温下氨气是气体,不适合用于农作物的肥料。
导入新课
氮肥的生产基石——合成氨工业
【问题1-3】其他状态的氨气是否可以用于作为氮肥?
【资料1】氨气的沸点为-33.34℃,熔点为-77.73℃,常温下,氨气呈现为气态,但可以通过降温或者增加压力使其转化为液态或固态。1g液态NH3汽化,吸收约5.761kJ的热量。
液氨不适合用作肥料,因为液氨易汽化,吸收大量热量,植物会冻伤。
课堂探究
一、由氨气向其他含氮化合物的转化。
【资料】氨态氮肥:氮元素以游离态氨(NH )的形式存在,主要以氨气、氨水为主。
【问题1-4】氨气不易储存和运输,如何由氨气制备氨水?
氮元素化合价
+5
+4
+2
0
-3
氢化物 单质 氧化物 酸 碱 盐 物质类别
N2
NH3
NO
NO2
HNO3
NH3 H2O
H2O
氨态氮肥
【问题1-5】如何设计实验可以证明氨气与水发生了反应?
NH3·H2O是弱碱,可以电离产生OH—,向反应后的溶液中滴加酚酞溶液,若溶液变红,说明发生了反应
课堂探究
[演示实验1] 如图所示组装实验仪器,然后打开止水夹,
将胶头滴管里的少量水挤入圆底烧瓶。
【问题1-6】为什么会出现喷泉现象?
氨气极易溶于水,当胶头滴管中的水挤进烧瓶中,烧瓶内
外产生较大压强差,水被大气压压进烧瓶。
【问题1-7】依据实验现象,你得出什么结论?
(1)极易溶于水,常温常压下,1体积的水能溶解 700 体积氨气。
(2)氨气与水发生化学反应。氨气是碱性气体,NH3+H2O NH3·H2O NH4++OH-
一、由氨气向其他含氮化合物的转化。
课堂探究
【问题2-1】氨态氮肥未被广泛使用,而铵态氮肥可以被豆科类植物直接吸收利用。如何由氨气制备铵态氮肥?
一、由氨气向其他含氮化合物的转化。
氮元素化合价
+5
+4
+2
0
-3
氢化物 单质 氧化物 酸 碱 盐 物质类别
N2
NH3
NO
NO2
HNO3
NH4+
铵态氮肥
H+
H2O
H+
【资料2】铵态氮肥:肥料中的氮元素以NH4+的形式存在,易溶于水。
NH3 H2O
课堂探究
[演示实验2]向塑料瓶中滴加5滴浓氨水,向瓶盖的滤纸滴加5滴浓盐酸,拧紧瓶盖。
【问题2-2】若将演示实验2中的浓盐酸换成浓硝酸制备硝酸铵是否可行?
可以,观察到白烟NH3+HNO3===NH4NO3
一、由氨气向其他含氮化合物的转化。
5滴浓氨水
5滴浓盐酸
实验现象 实验结论
瓶内出现大量白烟
反应生成白色铵盐颗粒
【问题2-3】根据演示实验1和实验2,总结如何检验氨气。
①湿润的红色石蕊试纸——变蓝; ②蘸有浓盐酸、浓硝酸的玻璃棒靠近——有白烟。
课堂探究
一、由氨气向其他含氮化合物的转化。
氮元素化合价
+5
+4
+2
0
-3
氢化物 单质 氧化物 酸 碱 盐 物质类别
N2
NH3
NO
NO2
HNO3
NH3 H2O
NO3-
NH4+
铵态氮肥
O2
氨态氮肥
O2
OH-
【问题2-4】如何用氨气制备硝态氮肥?
【资料3】不同植物对氮肥的需求不同,如叶菜类植物需要更多的硝态氮。不同植物对氮肥的需求不同,如叶菜类植物需要更多的硝态氮。硝态氮肥指含氮微粒主要以NO3- 形式存在的氮肥。
课堂探究
[氨的催化氧化实验]
一、由氨气向其他含氮化合物的转化。
NH3到NH4NO3的转化路径:NH3→NO→NO2→HNO3
课堂探究
二、由其他含氮化合物向氨气的转化。
【资料4】2002年国务院办公厅发出相关文件,禁止NH4NO3作为化肥销售。因为硝酸铵固体常温下可以稳定存在,但在撞击或受热条件下发生热分解造成热积累而引发爆炸。NH4NO3 ===HNO3+NH3 (100℃) 2NH4NO3 === O2+2N2+4H2O(400℃)
【问题3-1】其他铵盐,如NH4HCO3、NH4Cl固体加热能分解产生氨气吗?
[演示实验3]分别加热盛有碳酸氢铵、氯化铵固体的试管
NH4HCO3 NH3 + H2O+CO2
NH4Cl NH3+ HCl
NH3+ HCl===NH4Cl
课堂探究
二、由其他含氮化合物向氨气的转化。
【问题3-2】能否只利用加热NH4HCO3、NH4Cl固体的方法制备氨气?
不能,NH4HCO3分解产物中混有杂质气体CO2;NH4Cl固体家人分解后,遇冷重新化合。
【问题3-3】实验室如何实现氨气的制备?
方案一:浓氨水受热分解;方案二:铵盐与碱反应。
课堂探究
二、由其他含氮化合物向氨气的转化。
【问题3-4】为收集到更多更纯净的氨气,应选择哪种铵盐?哪种碱?
【资料5】NaOH、KOH固体易吸湿结块,熔点低加热时会熔化并凝结,且在加热条件下对玻璃有严重腐蚀性。
铵盐 碱
NH4Cl固体 NaOH固体
NH4NO3固体 KOH固体
NH4HCO3固体 Ca(OH)2 固体
NH4Cl溶液 NaOH溶液
NH4NO3溶液 KOH溶液
NH4HCO3溶液 Ca(OH)2溶液
课堂探究
[演示实验4]在试管中加入半匙Ca(OH)2、半匙NH4Cl粉末,用酒精灯加热,试管口放湿润的红色石蕊试纸,观察。
二、由其他含氮化合物向氨气的转化。
2NH4Cl+Ca(OH)2 CaCl2+ 2NH3 +2H2O
【问题3-5】如何检验溶液中的NH4+?
加入浓碱溶液并加热,用湿润红色石蕊试纸检验。
NH4++OH- NH3+H2O
评价反馈
C
1.兴趣小组利用以下装置进行制取NH3并探究其性质的实验(部分夹持装置略),其中难以达到预期目的的是( )
A.制备NH3 B.净化、干燥NH3 C.收集NH3 D.验证NH3的还原性
评价反馈
D
2.如图是氨溶于水的喷泉实验装置,下列叙述错误的是( )
A.该实验说明氨是一种极易溶于水的气体
B.进入烧瓶中的液体颜色由无色变为红色,说明氨水呈碱性
C.形成喷泉的原因是氨溶于水后,烧瓶内的气压小于大气压
D.用NO代替氨,利用此装置也可进行喷泉实验
评价反馈
B
3.以下有关氨和铵盐的叙述中,不正确的是( )
A.目前工业上用氢气和氮气直接合成氨
B.氨溶于水的喷泉实验体现了氨的氧化性
C.氨气易液化,常用作制冷剂
D.硫酸铵、碳酸氢铵、硝酸铵等铵盐在农业生产中常用作化肥
课堂小结
研究物质性质
的一般程序
得出结论
发现问题
设计实验
预测性质
分析解释
实验验证
元素化合价角度
物质类别角度
“价-类”二维图
布置作业
编写铵态氮肥的使用说明书。
完成本节素养专练。
谢谢大家
第2课时 氨和铵盐
第二节 氮及其化合物
化学
1. 通过“价 -类”二维图的角度设计铵态氮肥、氨态氮肥的转化路径,构建基于物质类别认识物质转化的模型,能设计实验验证预测路径,发展证据推理与科学探究的核心素养。
2.通过“先价后类”的角度设计硝态氮肥的转化路径,构建基于元素价态认识物质转化的模型,能够基于材料进行分析推理,发展宏观辨识与微观探析的核心素养。
3.通过总结氨气的转化思路,进一步运用复分解反应原理及氧化还原原理实现物质转化的推断,能设计验证实验,优化设计方案完成整体分析。
学习目标
重点:
不同含氮物质间的转化与物质转化思维模型的构建。
难点:
基于实验目的设计方案、评价与优化实验的方案并能寻求证据证明。
学习重难点
导入新课
氮元素化合价
+5
+4
+2
0
-3
单质 氧化物 酸 盐 物质类别
NO
NO2
HNO3
NO3-
N2
【复习】回顾自然固氮的途径,解释谚语“雷雨发庄稼”。
导入新课
认识氮肥及其种类
氨态氮肥
如NH3·H2O
硝态氮肥
如KNO3
NaNO3
铵态氮肥
如NH4Cl
NH4HCO3
硝铵态氮肥
如NH4NO3
有机态氮肥
CO(NH2)2
导入新课
氮肥的生产基石——合成氨工业
【问题1-1】比较高能固氮与生物固氮的转化条件,尝试思考由人工实现氮气制备氮肥的途径。
模拟自然固氮途径:①N2→NO→NO2→HNO3→NO3—;②N2→NH3→NH4+。
但是氮气和氧气生成 NO,能耗大、产量低,不适合工业生产。
导入新课
氮肥的生产基石——合成氨工业
【问题1-2】氨气的物理性质?是否适合用于农作物的肥料?
无色、有刺激性气味的气体;密度大于空气。
因为常温下氨气是气体,不适合用于农作物的肥料。
导入新课
氮肥的生产基石——合成氨工业
【问题1-3】其他状态的氨气是否可以用于作为氮肥?
【资料1】氨气的沸点为-33.34℃,熔点为-77.73℃,常温下,氨气呈现为气态,但可以通过降温或者增加压力使其转化为液态或固态。1g液态NH3汽化,吸收约5.761kJ的热量。
液氨不适合用作肥料,因为液氨易汽化,吸收大量热量,植物会冻伤。
课堂探究
一、由氨气向其他含氮化合物的转化。
【资料】氨态氮肥:氮元素以游离态氨(NH )的形式存在,主要以氨气、氨水为主。
【问题1-4】氨气不易储存和运输,如何由氨气制备氨水?
氮元素化合价
+5
+4
+2
0
-3
氢化物 单质 氧化物 酸 碱 盐 物质类别
N2
NH3
NO
NO2
HNO3
NH3 H2O
H2O
氨态氮肥
【问题1-5】如何设计实验可以证明氨气与水发生了反应?
NH3·H2O是弱碱,可以电离产生OH—,向反应后的溶液中滴加酚酞溶液,若溶液变红,说明发生了反应
课堂探究
[演示实验1] 如图所示组装实验仪器,然后打开止水夹,
将胶头滴管里的少量水挤入圆底烧瓶。
【问题1-6】为什么会出现喷泉现象?
氨气极易溶于水,当胶头滴管中的水挤进烧瓶中,烧瓶内
外产生较大压强差,水被大气压压进烧瓶。
【问题1-7】依据实验现象,你得出什么结论?
(1)极易溶于水,常温常压下,1体积的水能溶解 700 体积氨气。
(2)氨气与水发生化学反应。氨气是碱性气体,NH3+H2O NH3·H2O NH4++OH-
一、由氨气向其他含氮化合物的转化。
课堂探究
【问题2-1】氨态氮肥未被广泛使用,而铵态氮肥可以被豆科类植物直接吸收利用。如何由氨气制备铵态氮肥?
一、由氨气向其他含氮化合物的转化。
氮元素化合价
+5
+4
+2
0
-3
氢化物 单质 氧化物 酸 碱 盐 物质类别
N2
NH3
NO
NO2
HNO3
NH4+
铵态氮肥
H+
H2O
H+
【资料2】铵态氮肥:肥料中的氮元素以NH4+的形式存在,易溶于水。
NH3 H2O
课堂探究
[演示实验2]向塑料瓶中滴加5滴浓氨水,向瓶盖的滤纸滴加5滴浓盐酸,拧紧瓶盖。
【问题2-2】若将演示实验2中的浓盐酸换成浓硝酸制备硝酸铵是否可行?
可以,观察到白烟NH3+HNO3===NH4NO3
一、由氨气向其他含氮化合物的转化。
5滴浓氨水
5滴浓盐酸
实验现象 实验结论
瓶内出现大量白烟
反应生成白色铵盐颗粒
【问题2-3】根据演示实验1和实验2,总结如何检验氨气。
①湿润的红色石蕊试纸——变蓝; ②蘸有浓盐酸、浓硝酸的玻璃棒靠近——有白烟。
课堂探究
一、由氨气向其他含氮化合物的转化。
氮元素化合价
+5
+4
+2
0
-3
氢化物 单质 氧化物 酸 碱 盐 物质类别
N2
NH3
NO
NO2
HNO3
NH3 H2O
NO3-
NH4+
铵态氮肥
O2
氨态氮肥
O2
OH-
【问题2-4】如何用氨气制备硝态氮肥?
【资料3】不同植物对氮肥的需求不同,如叶菜类植物需要更多的硝态氮。不同植物对氮肥的需求不同,如叶菜类植物需要更多的硝态氮。硝态氮肥指含氮微粒主要以NO3- 形式存在的氮肥。
课堂探究
[氨的催化氧化实验]
一、由氨气向其他含氮化合物的转化。
NH3到NH4NO3的转化路径:NH3→NO→NO2→HNO3
课堂探究
二、由其他含氮化合物向氨气的转化。
【资料4】2002年国务院办公厅发出相关文件,禁止NH4NO3作为化肥销售。因为硝酸铵固体常温下可以稳定存在,但在撞击或受热条件下发生热分解造成热积累而引发爆炸。NH4NO3 ===HNO3+NH3 (100℃) 2NH4NO3 === O2+2N2+4H2O(400℃)
【问题3-1】其他铵盐,如NH4HCO3、NH4Cl固体加热能分解产生氨气吗?
[演示实验3]分别加热盛有碳酸氢铵、氯化铵固体的试管
NH4HCO3 NH3 + H2O+CO2
NH4Cl NH3+ HCl
NH3+ HCl===NH4Cl
课堂探究
二、由其他含氮化合物向氨气的转化。
【问题3-2】能否只利用加热NH4HCO3、NH4Cl固体的方法制备氨气?
不能,NH4HCO3分解产物中混有杂质气体CO2;NH4Cl固体家人分解后,遇冷重新化合。
【问题3-3】实验室如何实现氨气的制备?
方案一:浓氨水受热分解;方案二:铵盐与碱反应。
课堂探究
二、由其他含氮化合物向氨气的转化。
【问题3-4】为收集到更多更纯净的氨气,应选择哪种铵盐?哪种碱?
【资料5】NaOH、KOH固体易吸湿结块,熔点低加热时会熔化并凝结,且在加热条件下对玻璃有严重腐蚀性。
铵盐 碱
NH4Cl固体 NaOH固体
NH4NO3固体 KOH固体
NH4HCO3固体 Ca(OH)2 固体
NH4Cl溶液 NaOH溶液
NH4NO3溶液 KOH溶液
NH4HCO3溶液 Ca(OH)2溶液
课堂探究
[演示实验4]在试管中加入半匙Ca(OH)2、半匙NH4Cl粉末,用酒精灯加热,试管口放湿润的红色石蕊试纸,观察。
二、由其他含氮化合物向氨气的转化。
2NH4Cl+Ca(OH)2 CaCl2+ 2NH3 +2H2O
【问题3-5】如何检验溶液中的NH4+?
加入浓碱溶液并加热,用湿润红色石蕊试纸检验。
NH4++OH- NH3+H2O
评价反馈
C
1.兴趣小组利用以下装置进行制取NH3并探究其性质的实验(部分夹持装置略),其中难以达到预期目的的是( )
A.制备NH3 B.净化、干燥NH3 C.收集NH3 D.验证NH3的还原性
评价反馈
D
2.如图是氨溶于水的喷泉实验装置,下列叙述错误的是( )
A.该实验说明氨是一种极易溶于水的气体
B.进入烧瓶中的液体颜色由无色变为红色,说明氨水呈碱性
C.形成喷泉的原因是氨溶于水后,烧瓶内的气压小于大气压
D.用NO代替氨,利用此装置也可进行喷泉实验
评价反馈
B
3.以下有关氨和铵盐的叙述中,不正确的是( )
A.目前工业上用氢气和氮气直接合成氨
B.氨溶于水的喷泉实验体现了氨的氧化性
C.氨气易液化,常用作制冷剂
D.硫酸铵、碳酸氢铵、硝酸铵等铵盐在农业生产中常用作化肥
课堂小结
研究物质性质
的一般程序
得出结论
发现问题
设计实验
预测性质
分析解释
实验验证
元素化合价角度
物质类别角度
“价-类”二维图
布置作业
编写铵态氮肥的使用说明书。
完成本节素养专练。
谢谢大家
同课章节目录
- 第五章 化工生产中的重要非金属元素
- 第一节 硫及其化合物
- 第二节 氮及其化合物
- 第三节 无机非金属材料
- 实验活动4 用化学沉淀法去除粗盐中的杂质离子
- 实验活动5 不同价态含硫物质的转化
- 第六章 化学反应与能量
- 第一节 化学反应与能量变化
- 第二节 化学反应的速率与限度
- 实验活动6 化学能转化成电能
- 实验活动7 化学反应速率的影响因素
- 第七章 有机化合物
- 第一节 认识有机化合物
- 第二节 乙烯与有机高分子材料
- 第三节 乙醇与乙酸
- 第四节 基本营养物质
- 实验活动8 搭建球棍模型认识有机化合物分子结构的特点
- 实验活动9 乙醇、乙酸的主要性质
- 第八章 化学与可持续发展
- 第一节 自然资源的开发利用
- 第二节 化学品的合理使用
- 第三节 环境保护与绿色化学
