第五章 第一节 硫及其化合物 第2课时--人教版高中化学必修第二册教学课件(共23张PPT)
文档属性
| 名称 | 第五章 第一节 硫及其化合物 第2课时--人教版高中化学必修第二册教学课件(共23张PPT) |

|
|
| 格式 | pptx | ||
| 文件大小 | 1.7MB | ||
| 资源类型 | 试卷 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2025-07-08 00:00:00 | ||
图片预览








文档简介
(共23张PPT)
第2课时 硫酸的性质、用途
及硫酸根离子的检验
第一节 硫及其化合物
化学
1.通过浓硫酸的黑面包实验、与铜反应实验,探究浓硫酸的脱水性和强氧化性。
2.通过物质类别和元素化合价的角度认识硫酸的性质,发展证据推理与模型认知的核心素养。
3.硫酸根离子的检验。
学习目标
重点:
浓硫酸的性质、硫酸根离子的检验。
难点:
硫酸根离子的检验。
学习重难点
每日一题
SO2通入下列溶液中有无沉淀产生?为什么?
1、BaCl2溶液
2、Ba(OH)2溶液
3、Ba(NO3)2溶液
4、H2S溶液
分类的思想
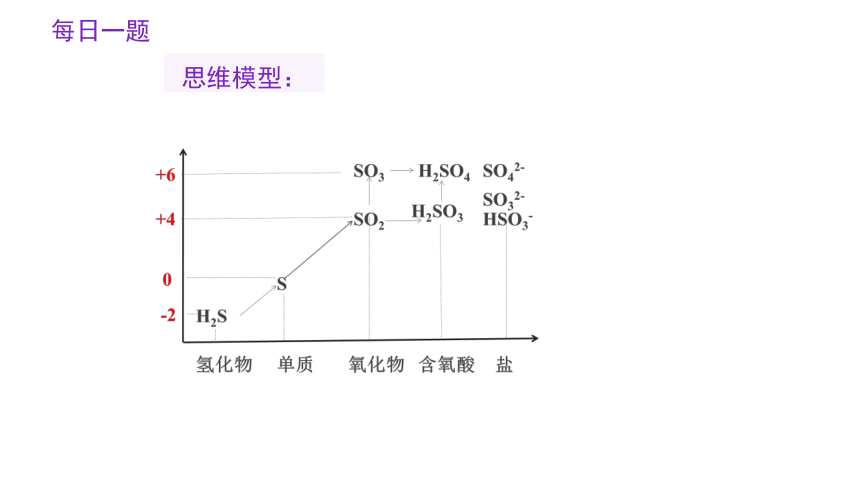
每日一题
思维模型:
课堂探究
一、稀硫酸
氢离子、硫酸根离子和水分子。
问题1-1 稀硫酸的组成微粒有哪些?
问题1-3 稀硫酸体现这些性质的本质原因是什么?
①与指示剂反应;②与活泼金属反应;③与碱的反应生成盐和水;
④与金属氧化物反应生成盐和水;⑤与盐的反应生成新盐和新酸。
H2SO4=2H++SO42-
问题1-2 稀硫酸有哪些性质?
课堂探究
二、浓硫酸
问题2-1 浓硫酸的物理性质?
①纯硫酸是无色、油状、液体(常用浓硫酸质量分数为98.3%)。
②纯硫酸难挥发,沸点338℃。(高沸点酸)
③密度:质量分数为98.3%的硫酸的密度为1.84g/cm3 。
④易溶于水,能以任意比与水混溶。
课堂探究
二、浓硫酸
思考交流:
1.如何稀释浓硫酸?
2.浓硫酸所含物质微粒与稀硫酸有何不同?
将浓硫酸沿着容器内壁缓慢地注入水中,并用玻璃棒不断搅拌,使产生的热量迅速扩散。将浓硫酸与其它低密度的液体混合时,方法与浓硫酸在水中的溶解方法相同。
主要以硫酸分子的形式存在
课堂探究
二、浓硫酸
思考交流:
3.现有浓硫酸、浓盐酸各一瓶(无标签,试剂瓶大小一样,酸的体积相同),不用化学方法怎样识别?根据是什么? 稀硫酸有哪些性质?
气味、状态(油状)、重量、白雾等。
4.若皮肤上沾上浓硫酸,应该如何处理?
立即用大量水冲洗,然后再涂上3%~5%的NaHCO3溶液或肥皂水。
课堂探究
二、浓硫酸
问题2-2 如何检验气体中有水蒸气?用完的试剂如何处理?发生了怎样的反应?
CuSO4·5H2O + H2SO4(浓)= CuSO4 + H2SO4·5H2O
问题2-3 上面反应体现了浓硫酸怎样的性质?有怎样的用途?
浓硫酸有吸水性;常用做干燥剂(注意:浓硫酸吸收物质本来就有的水,直接与水分子结合。)
课堂探究
二、浓硫酸
思考交流:
如何解释下列现象?
课堂探究
二、浓硫酸
蔗糖变黑,体积膨胀,形成疏松多孔的海绵状的黑色物质,并有白雾产生,强氧化性。
问题2-4 你看到了怎样的现象?黑色物质是什么?反应方程式?体现了浓硫酸的什么性质?
C12H22O11 12C+11H2O
浓硫酸
课堂探究
二、浓硫酸
问题2-5 浓硫酸的吸水性和脱水性有何不同?
脱水性是指浓硫酸能把有机物中的氢氧原子按2:1(H2O)的个数比脱去。
问题2-6 整个过程中热量如何变化?为什么?
放出热量;浓硫酸遇水放热
问题2-7 为什么体积会膨胀?写出反应方程式?体现了浓硫酸怎样的性质?稀硫酸有无氧化性?有何不同?
产生了气体;强氧化性;H+弱氧化性生成H2、+6价硫,强氧化性生成SO2
课堂探究
二、浓硫酸
问题2-8 木炭与浓硫酸反应的产物有哪些?分别用什么试剂检验?如何检验?
先检验H2O、再检验SO2、再除去SO2、再检验CO2
课堂探究
二、浓硫酸
问题2-9 浓硫酸能氧化排在氢后面的不活泼的金属吗?稀硫酸与活泼金属反应生成氢气,那么浓硫酸与金属反应是否也生成氢气?
能反应但不产生氢气
课堂探究
二、浓硫酸
问题2-10 有怎样的实验现象?写出反应方程式?体现了浓硫酸怎样的性质?加入过量的铜,浓硫酸是否会完全反应为什么?
Cu + 2H2SO4(浓) == CuSO4+ SO2↑+ 2H2O
加热
课堂探究
二、浓硫酸
在常温下,浓硫酸跟某些金属,如铁、铝等接触时,能够使金属表面生成一薄层致密的薄膜,从而阻止内部的金属继续跟硫酸发生反应(钝化现象)。因此,冷的浓硫酸可以用铁或铝的容器储存。但受热时,浓硫酸可以与Fe、Al反应。
课堂练习
练习:下列现象反映了硫酸的哪些主要性质
(1)浓硫酸滴在木条上,过一会儿,木条变黑。
(2)敞口放置浓硫酸时,质量增加。
(3)锌粒投入稀硫酸中,有气泡产生。
(4)把铜片放入浓硫酸里加热,有气体产生。
(5)利用浓硫酸和食盐固体反应可制HCl气体。
(6)浓硫酸不能用来干燥硫化氢气体。
(7)利用硫化亚铁跟稀硫酸反应可制H2S气体。
(1)脱水性;(2) 吸水性;(3) 酸性;(4)酸性和强氧化性;(5)难挥发性;(6)强氧化性;(7)强酸性。
课堂探究
三、硫酸根离子的检验
步骤:取少量待测液于试管中,先加盐酸酸化,无明显现象,再加入少量氯化钡溶液,如有白色沉淀生成,则说明原溶液中有SO42-存在。
问题3-1 如果先加入BaCl2溶液,再加入盐酸,产生白色沉淀,能不能说明溶液中存在SO42-?
问题3-2 能不能盐酸改为硝酸
问题3-3 能不能BaCl2改为Ba(NO3)2
不能,可能有银离子。
不能,硝酸能把亚硫酸根离子氧化为硫酸根离子,干扰实验。
不能,因为溶液中存在H+和N,相当于加入硝酸,可将S氧化为S,干扰实验。
课堂探究
四、浓硫酸——用途
硫酸是世界上用量最大、用途最广的化工基本原料之一,素有“化学工业之母”之称。
课堂小结
一、浓硫酸的特性
1、吸水性
2、脱水性
3、强氧化性
二、硫酸根的检验
三、硫酸的用途
①活泼金属(注意铝和铁)
②不活泼金属(加热)
③非金属单质
布置作业
预习下节学案。
完成本节素养专练。
谢谢大家
第2课时 硫酸的性质、用途
及硫酸根离子的检验
第一节 硫及其化合物
化学
1.通过浓硫酸的黑面包实验、与铜反应实验,探究浓硫酸的脱水性和强氧化性。
2.通过物质类别和元素化合价的角度认识硫酸的性质,发展证据推理与模型认知的核心素养。
3.硫酸根离子的检验。
学习目标
重点:
浓硫酸的性质、硫酸根离子的检验。
难点:
硫酸根离子的检验。
学习重难点
每日一题
SO2通入下列溶液中有无沉淀产生?为什么?
1、BaCl2溶液
2、Ba(OH)2溶液
3、Ba(NO3)2溶液
4、H2S溶液
分类的思想
每日一题
思维模型:
课堂探究
一、稀硫酸
氢离子、硫酸根离子和水分子。
问题1-1 稀硫酸的组成微粒有哪些?
问题1-3 稀硫酸体现这些性质的本质原因是什么?
①与指示剂反应;②与活泼金属反应;③与碱的反应生成盐和水;
④与金属氧化物反应生成盐和水;⑤与盐的反应生成新盐和新酸。
H2SO4=2H++SO42-
问题1-2 稀硫酸有哪些性质?
课堂探究
二、浓硫酸
问题2-1 浓硫酸的物理性质?
①纯硫酸是无色、油状、液体(常用浓硫酸质量分数为98.3%)。
②纯硫酸难挥发,沸点338℃。(高沸点酸)
③密度:质量分数为98.3%的硫酸的密度为1.84g/cm3 。
④易溶于水,能以任意比与水混溶。
课堂探究
二、浓硫酸
思考交流:
1.如何稀释浓硫酸?
2.浓硫酸所含物质微粒与稀硫酸有何不同?
将浓硫酸沿着容器内壁缓慢地注入水中,并用玻璃棒不断搅拌,使产生的热量迅速扩散。将浓硫酸与其它低密度的液体混合时,方法与浓硫酸在水中的溶解方法相同。
主要以硫酸分子的形式存在
课堂探究
二、浓硫酸
思考交流:
3.现有浓硫酸、浓盐酸各一瓶(无标签,试剂瓶大小一样,酸的体积相同),不用化学方法怎样识别?根据是什么? 稀硫酸有哪些性质?
气味、状态(油状)、重量、白雾等。
4.若皮肤上沾上浓硫酸,应该如何处理?
立即用大量水冲洗,然后再涂上3%~5%的NaHCO3溶液或肥皂水。
课堂探究
二、浓硫酸
问题2-2 如何检验气体中有水蒸气?用完的试剂如何处理?发生了怎样的反应?
CuSO4·5H2O + H2SO4(浓)= CuSO4 + H2SO4·5H2O
问题2-3 上面反应体现了浓硫酸怎样的性质?有怎样的用途?
浓硫酸有吸水性;常用做干燥剂(注意:浓硫酸吸收物质本来就有的水,直接与水分子结合。)
课堂探究
二、浓硫酸
思考交流:
如何解释下列现象?
课堂探究
二、浓硫酸
蔗糖变黑,体积膨胀,形成疏松多孔的海绵状的黑色物质,并有白雾产生,强氧化性。
问题2-4 你看到了怎样的现象?黑色物质是什么?反应方程式?体现了浓硫酸的什么性质?
C12H22O11 12C+11H2O
浓硫酸
课堂探究
二、浓硫酸
问题2-5 浓硫酸的吸水性和脱水性有何不同?
脱水性是指浓硫酸能把有机物中的氢氧原子按2:1(H2O)的个数比脱去。
问题2-6 整个过程中热量如何变化?为什么?
放出热量;浓硫酸遇水放热
问题2-7 为什么体积会膨胀?写出反应方程式?体现了浓硫酸怎样的性质?稀硫酸有无氧化性?有何不同?
产生了气体;强氧化性;H+弱氧化性生成H2、+6价硫,强氧化性生成SO2
课堂探究
二、浓硫酸
问题2-8 木炭与浓硫酸反应的产物有哪些?分别用什么试剂检验?如何检验?
先检验H2O、再检验SO2、再除去SO2、再检验CO2
课堂探究
二、浓硫酸
问题2-9 浓硫酸能氧化排在氢后面的不活泼的金属吗?稀硫酸与活泼金属反应生成氢气,那么浓硫酸与金属反应是否也生成氢气?
能反应但不产生氢气
课堂探究
二、浓硫酸
问题2-10 有怎样的实验现象?写出反应方程式?体现了浓硫酸怎样的性质?加入过量的铜,浓硫酸是否会完全反应为什么?
Cu + 2H2SO4(浓) == CuSO4+ SO2↑+ 2H2O
加热
课堂探究
二、浓硫酸
在常温下,浓硫酸跟某些金属,如铁、铝等接触时,能够使金属表面生成一薄层致密的薄膜,从而阻止内部的金属继续跟硫酸发生反应(钝化现象)。因此,冷的浓硫酸可以用铁或铝的容器储存。但受热时,浓硫酸可以与Fe、Al反应。
课堂练习
练习:下列现象反映了硫酸的哪些主要性质
(1)浓硫酸滴在木条上,过一会儿,木条变黑。
(2)敞口放置浓硫酸时,质量增加。
(3)锌粒投入稀硫酸中,有气泡产生。
(4)把铜片放入浓硫酸里加热,有气体产生。
(5)利用浓硫酸和食盐固体反应可制HCl气体。
(6)浓硫酸不能用来干燥硫化氢气体。
(7)利用硫化亚铁跟稀硫酸反应可制H2S气体。
(1)脱水性;(2) 吸水性;(3) 酸性;(4)酸性和强氧化性;(5)难挥发性;(6)强氧化性;(7)强酸性。
课堂探究
三、硫酸根离子的检验
步骤:取少量待测液于试管中,先加盐酸酸化,无明显现象,再加入少量氯化钡溶液,如有白色沉淀生成,则说明原溶液中有SO42-存在。
问题3-1 如果先加入BaCl2溶液,再加入盐酸,产生白色沉淀,能不能说明溶液中存在SO42-?
问题3-2 能不能盐酸改为硝酸
问题3-3 能不能BaCl2改为Ba(NO3)2
不能,可能有银离子。
不能,硝酸能把亚硫酸根离子氧化为硫酸根离子,干扰实验。
不能,因为溶液中存在H+和N,相当于加入硝酸,可将S氧化为S,干扰实验。
课堂探究
四、浓硫酸——用途
硫酸是世界上用量最大、用途最广的化工基本原料之一,素有“化学工业之母”之称。
课堂小结
一、浓硫酸的特性
1、吸水性
2、脱水性
3、强氧化性
二、硫酸根的检验
三、硫酸的用途
①活泼金属(注意铝和铁)
②不活泼金属(加热)
③非金属单质
布置作业
预习下节学案。
完成本节素养专练。
谢谢大家
同课章节目录
- 第五章 化工生产中的重要非金属元素
- 第一节 硫及其化合物
- 第二节 氮及其化合物
- 第三节 无机非金属材料
- 实验活动4 用化学沉淀法去除粗盐中的杂质离子
- 实验活动5 不同价态含硫物质的转化
- 第六章 化学反应与能量
- 第一节 化学反应与能量变化
- 第二节 化学反应的速率与限度
- 实验活动6 化学能转化成电能
- 实验活动7 化学反应速率的影响因素
- 第七章 有机化合物
- 第一节 认识有机化合物
- 第二节 乙烯与有机高分子材料
- 第三节 乙醇与乙酸
- 第四节 基本营养物质
- 实验活动8 搭建球棍模型认识有机化合物分子结构的特点
- 实验活动9 乙醇、乙酸的主要性质
- 第八章 化学与可持续发展
- 第一节 自然资源的开发利用
- 第二节 化学品的合理使用
- 第三节 环境保护与绿色化学
