第五章 实验活动4 用化学沉淀法除去粗盐中的杂质离子--人教版高中化学必修第二册教学课件(共24张PPT)
文档属性
| 名称 | 第五章 实验活动4 用化学沉淀法除去粗盐中的杂质离子--人教版高中化学必修第二册教学课件(共24张PPT) |  | |
| 格式 | pptx | ||
| 文件大小 | 509.6KB | ||
| 资源类型 | 试卷 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2025-07-08 09:10:15 | ||
图片预览








文档简介
(共24张PPT)
化学沉淀法去除粗盐中的杂质离子
第五章 实验活动4
化学
1.通过习题复习回顾物质分离与提纯的原理、原则和方法,掌握理论基础与基本的实验操作方法。
2.通过分析粗盐当中的物质组成与寻找除杂试剂的过程,形成运用离子反应去除杂质离子的分析思路和方法,能设计用化学沉淀法去除粗盐中的杂质离子的实验方案。
3.通过粗盐提纯的实验操作,熟练掌握溶解、过滤、蒸发等操作,学会去除可溶性固体中杂质的方法,体会实验操作顺序和试剂用量控制对实验结果的影响。
学习目标
重点:
运用化学沉淀法对物质进行分离。
难点:
混合溶液中去除杂质离子的方案设计。
学习重难点
知识回顾
①概念:利用物质溶解性的差异,将液体和不溶于液体的固体分离开来
②原理:物质溶解性的差异
③适用范围:适用于固液混合物的分离。一般情况下,是一种物质易溶于水,另一种物质难溶于水
④主要仪器:铁架台(含铁圈)、烧杯、漏斗、滤纸
⑤注意事项:一贴:滤纸紧贴漏斗内壁,中间不留有气泡;
二低:滤纸上边缘低于漏斗边缘,液面低于滤纸边缘;
三靠:倾倒液体的烧杯紧靠玻璃棒,玻璃棒末端紧靠三层滤纸处,漏斗的下端尖口紧靠盛接滤液的烧杯内壁。
【注意】①若滤液浑浊,需更换滤纸,重新过滤,直至溶液澄清透明为止
②浑浊的原因可能是:滤纸破损、滤液超过滤纸边缘、仪器不干净
知识回顾
①概念:在蒸发皿中不断加热,蒸发溶剂,使溶液浓缩,从而析出晶体的过程。
②适用范围:适用于分离溶液中的溶质。
③主要仪器:铁架台(含铁圈)、酒精灯、蒸发皿、玻璃棒。
④注意事项:
a.蒸发时,液体量不得超过蒸发皿容积的2/3,以免加热时液体溅出
b.在加热过程中,要用玻璃棒不断搅拌液体,防止因局部温度过高,造成液体
飞溅
c.当蒸发皿中出现较多固体时,应停止加热,利用余热蒸干
d.取下未冷却的蒸发皿时,要放在陶土网上
【注意】①结晶是使溶质从溶液中以晶体状态析出的过程,是分离、提纯固体物质的重要方法之一
②结晶的方法有蒸发结晶(物质溶解度随温度变化不大的物质,如:NaCl)和冷却结晶(溶解度随温度下降而显著降低的物质,如:KNO3)两种。
导入新课
粗盐能直接食用吗?如果你是盐矿(厂)老板聘请的工程师,面对这样的成分,你会如何处理?
精盐的主要成分是氯化钠,部分精盐含有碘酸钾,这是我们的食用盐。粗盐主要来源于海水蒸发和盐矿开采,除氯化钠外,里面还含有多种可溶性杂质,如氯化钙,氯化镁,硫酸镁,初晒的粗盐中还含有泥沙。
一、 物质的分离和提纯
【问题1.1】物质分离和提纯的基本概念、原则及注意事项分别是什么?
课堂探究
①物质的分离:将混合物的各种物质彼此分开,最终获得几种纯净物的过程。即
A和B的混合物通过某种分离方法最终得到纯净物A和纯净物B的过程。
②物质的提纯:将混合物中的杂质去除而得到纯净物的过程,又叫物质的净化或
除杂。
一、 物质的分离和提纯
【问题1.1】物质分离和提纯的基本概念、原则及注意事项分别是什么?
课堂探究
物质分离和提纯
四原则
四必须
不增:过程中不增加新的杂质 易复原:被提纯物转化后易复原
不减:不减少被提纯物质 易分离:被提纯物质与杂质易分离
除杂试剂必须过量(目的是为了除去杂质)
过量试剂必须除去(因为过量试剂引入新的杂质)
除杂途径必须最佳(能把杂质转化为被提纯物质的方法通常认为是最佳方法)
除多种杂质必须考虑加入试剂的顺序
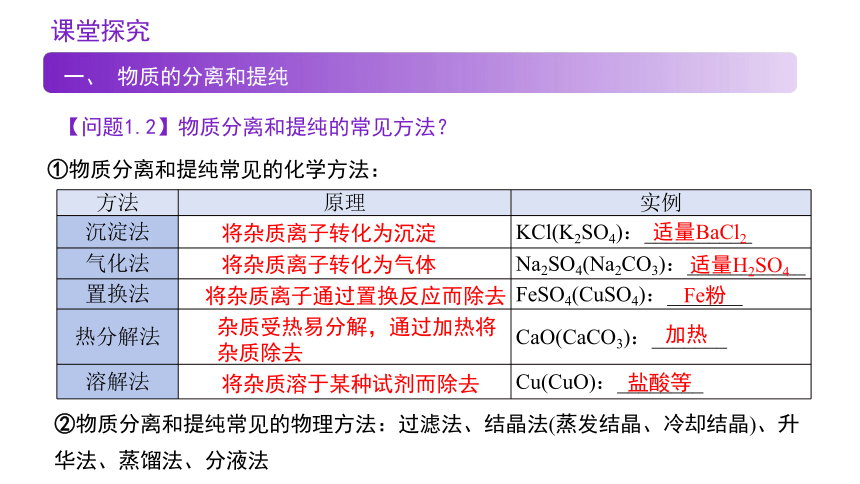
【问题1.2】物质分离和提纯的常见方法?
课堂探究
①物质分离和提纯常见的化学方法:
方法 原理 实例
沉淀法 KCl(K2SO4):__________
气化法 Na2SO4(Na2CO3):___________
置换法 FeSO4(CuSO4):_______
热分解法 CaO(CaCO3):_______
溶解法 Cu(CuO):________
将杂质离子转化为沉淀
将杂质离子转化为气体
将杂质离子通过置换反应而除去
杂质受热易分解,通过加热将杂质除去
将杂质溶于某种试剂而除去
适量BaCl2
适量H2SO4
Fe粉
加热
盐酸等
②物质分离和提纯常见的物理方法:过滤法、结晶法(蒸发结晶、冷却结晶)、升
华法、蒸馏法、分液法
一、 物质的分离和提纯
课堂探究
二、设计去除粗盐中的可溶性杂质的实验方案
【问题2.1】粗盐中存在的离子有哪些?
【问题2.2】用什么试剂除去粗盐中的杂质离子 试阐述选择的依据。
【方法指导】杂质离子与需要保存的离子性质之间存在什么差异,选择能使杂质离子转化为气体或沉淀的物质作为除杂试剂。除杂试剂不能影响要保留的离子,且应适当过量。
杂质 加入的试剂及用量 引入的离子 除去引入离子的试剂
过量BaCl2 Ba2+ Na2CO3
Mg2+ 过量NaOH OH- HCl
Ca2+ 过量Na2CO3 HCl
课堂探究
二、设计去除粗盐中的可溶性杂质的实验方案
【问题2.3】除杂试剂过量而引入的新杂质如何除去?
【注意】①BaCl2必须在Na2CO3之前加
②过滤之后再加入稀盐酸除去过量的Na2CO3和NaOH
③除去多种杂质时必须考虑加入试剂的顺序
④除杂时,每次所加试剂都要略微过量是为了将杂质离子完全除去
课堂探究
总结:利用离子反应除去杂质的思路和方法
1.分析物质组成,确定要保留的物质和需要除去的杂质。
2.明确要保留的物质和杂质之间的性质差异。
3.选择能使杂质离子转化为气体或沉淀的物质作为除杂试剂。除杂试剂不能影响要保留的离子,且应适当过量。
4.分析因除杂试剂过量而引入的新杂质如何除去。
5.综合考虑原有杂质离子和可能新引入的杂质离子,确定试剂添加顺序和实验操作步骤。
课堂探究
【小组合作】根据所提供的仪器、试剂,小组合作初步确定实验方案,绘制流程图。
天平、药匙、量筒、烧杯、玻璃棒、胶头滴管、漏斗、滤纸、蒸发皿、坩埚钳、铁架台(带铁圈)、陶土网、酒精灯、火柴、粗盐、蒸馏水、0.1 mol·L-1 BaCl2溶液、20% NaOH 溶液、饱和Na2CO3溶液、6 mol·L-1盐酸、pH试纸。
课堂探究
二、设计去除粗盐中的可溶性杂质的实验方案
【问题2.4】化学除杂时如何保证杂质离子除干净 如何检验S是否完全除去
【问题2.5】实验操作流程:
溶解、沉淀、过滤、中和、蒸发。
课堂探究
二、设计去除粗盐中的可溶性杂质的实验方案
【小组合作】根据所提供的仪器、试剂,小组合作完善实验方案。
课堂探究
三、实验操作
1.注意事项:(1)使用玻璃仪器需注意安全,进行加热蒸发操作时请戴上护目镜。
(2)如果过滤后的滤液仍然浑浊,必须重做过滤器,再次过滤。
(3)实验完毕,整理好实验台。
2.认真规范操作实验,填写实验记录卡。
[实验]
课堂探究
三、实验操作
实验步骤 实验操作
①溶解
用天平称取5.0 g粗盐放入烧杯中,然后加入20 mL水,用玻璃棒 ,使粗盐溶解,得到粗盐水
搅拌
课堂探究
三、实验操作
②沉淀 向粗盐水中依次滴加过量的氯化钡溶液、氢氧化钠溶液、饱和碳酸钠溶液,使_____________
___________完全沉淀析出
SO 、Mg2+、
Ca2+、Ba2+
课堂探究
三、实验操作
③过滤 将烧杯静置后过滤,除去生成的沉淀和不溶性杂质、过滤中玻璃棒的作用是 ,滤液呈
性
引流
碱
课堂探究
三、实验操作
④中和 向滤液中滴加盐酸,用玻璃棒搅拌,直到_____
,并用pH试纸检验,使滤液呈中性或微酸性
无气
泡冒出
课堂探究
三、实验操作
⑤蒸发 将滤液倒入蒸发皿,用酒精灯加热,并用玻璃棒不断 。当蒸发皿中出现 时,停止加热。利用蒸发皿的余热使滤液蒸干。冷却后,得到除去杂质离子的精盐
搅拌
较多固体
课堂小结
粗盐
粗盐水
杂质
氯化钠
不溶性杂质
可溶性杂质
过滤
Ca2+
Mg2+
化学沉淀法
Na2CO3溶液
NaOH溶液
BaCl2溶液
分析混合物组成
根据杂质的特点选择合适的分离方法
选择合适的试剂
布置作业
预习下节学案。
完成本节课后练习。
谢谢大家
化学沉淀法去除粗盐中的杂质离子
第五章 实验活动4
化学
1.通过习题复习回顾物质分离与提纯的原理、原则和方法,掌握理论基础与基本的实验操作方法。
2.通过分析粗盐当中的物质组成与寻找除杂试剂的过程,形成运用离子反应去除杂质离子的分析思路和方法,能设计用化学沉淀法去除粗盐中的杂质离子的实验方案。
3.通过粗盐提纯的实验操作,熟练掌握溶解、过滤、蒸发等操作,学会去除可溶性固体中杂质的方法,体会实验操作顺序和试剂用量控制对实验结果的影响。
学习目标
重点:
运用化学沉淀法对物质进行分离。
难点:
混合溶液中去除杂质离子的方案设计。
学习重难点
知识回顾
①概念:利用物质溶解性的差异,将液体和不溶于液体的固体分离开来
②原理:物质溶解性的差异
③适用范围:适用于固液混合物的分离。一般情况下,是一种物质易溶于水,另一种物质难溶于水
④主要仪器:铁架台(含铁圈)、烧杯、漏斗、滤纸
⑤注意事项:一贴:滤纸紧贴漏斗内壁,中间不留有气泡;
二低:滤纸上边缘低于漏斗边缘,液面低于滤纸边缘;
三靠:倾倒液体的烧杯紧靠玻璃棒,玻璃棒末端紧靠三层滤纸处,漏斗的下端尖口紧靠盛接滤液的烧杯内壁。
【注意】①若滤液浑浊,需更换滤纸,重新过滤,直至溶液澄清透明为止
②浑浊的原因可能是:滤纸破损、滤液超过滤纸边缘、仪器不干净
知识回顾
①概念:在蒸发皿中不断加热,蒸发溶剂,使溶液浓缩,从而析出晶体的过程。
②适用范围:适用于分离溶液中的溶质。
③主要仪器:铁架台(含铁圈)、酒精灯、蒸发皿、玻璃棒。
④注意事项:
a.蒸发时,液体量不得超过蒸发皿容积的2/3,以免加热时液体溅出
b.在加热过程中,要用玻璃棒不断搅拌液体,防止因局部温度过高,造成液体
飞溅
c.当蒸发皿中出现较多固体时,应停止加热,利用余热蒸干
d.取下未冷却的蒸发皿时,要放在陶土网上
【注意】①结晶是使溶质从溶液中以晶体状态析出的过程,是分离、提纯固体物质的重要方法之一
②结晶的方法有蒸发结晶(物质溶解度随温度变化不大的物质,如:NaCl)和冷却结晶(溶解度随温度下降而显著降低的物质,如:KNO3)两种。
导入新课
粗盐能直接食用吗?如果你是盐矿(厂)老板聘请的工程师,面对这样的成分,你会如何处理?
精盐的主要成分是氯化钠,部分精盐含有碘酸钾,这是我们的食用盐。粗盐主要来源于海水蒸发和盐矿开采,除氯化钠外,里面还含有多种可溶性杂质,如氯化钙,氯化镁,硫酸镁,初晒的粗盐中还含有泥沙。
一、 物质的分离和提纯
【问题1.1】物质分离和提纯的基本概念、原则及注意事项分别是什么?
课堂探究
①物质的分离:将混合物的各种物质彼此分开,最终获得几种纯净物的过程。即
A和B的混合物通过某种分离方法最终得到纯净物A和纯净物B的过程。
②物质的提纯:将混合物中的杂质去除而得到纯净物的过程,又叫物质的净化或
除杂。
一、 物质的分离和提纯
【问题1.1】物质分离和提纯的基本概念、原则及注意事项分别是什么?
课堂探究
物质分离和提纯
四原则
四必须
不增:过程中不增加新的杂质 易复原:被提纯物转化后易复原
不减:不减少被提纯物质 易分离:被提纯物质与杂质易分离
除杂试剂必须过量(目的是为了除去杂质)
过量试剂必须除去(因为过量试剂引入新的杂质)
除杂途径必须最佳(能把杂质转化为被提纯物质的方法通常认为是最佳方法)
除多种杂质必须考虑加入试剂的顺序
【问题1.2】物质分离和提纯的常见方法?
课堂探究
①物质分离和提纯常见的化学方法:
方法 原理 实例
沉淀法 KCl(K2SO4):__________
气化法 Na2SO4(Na2CO3):___________
置换法 FeSO4(CuSO4):_______
热分解法 CaO(CaCO3):_______
溶解法 Cu(CuO):________
将杂质离子转化为沉淀
将杂质离子转化为气体
将杂质离子通过置换反应而除去
杂质受热易分解,通过加热将杂质除去
将杂质溶于某种试剂而除去
适量BaCl2
适量H2SO4
Fe粉
加热
盐酸等
②物质分离和提纯常见的物理方法:过滤法、结晶法(蒸发结晶、冷却结晶)、升
华法、蒸馏法、分液法
一、 物质的分离和提纯
课堂探究
二、设计去除粗盐中的可溶性杂质的实验方案
【问题2.1】粗盐中存在的离子有哪些?
【问题2.2】用什么试剂除去粗盐中的杂质离子 试阐述选择的依据。
【方法指导】杂质离子与需要保存的离子性质之间存在什么差异,选择能使杂质离子转化为气体或沉淀的物质作为除杂试剂。除杂试剂不能影响要保留的离子,且应适当过量。
杂质 加入的试剂及用量 引入的离子 除去引入离子的试剂
过量BaCl2 Ba2+ Na2CO3
Mg2+ 过量NaOH OH- HCl
Ca2+ 过量Na2CO3 HCl
课堂探究
二、设计去除粗盐中的可溶性杂质的实验方案
【问题2.3】除杂试剂过量而引入的新杂质如何除去?
【注意】①BaCl2必须在Na2CO3之前加
②过滤之后再加入稀盐酸除去过量的Na2CO3和NaOH
③除去多种杂质时必须考虑加入试剂的顺序
④除杂时,每次所加试剂都要略微过量是为了将杂质离子完全除去
课堂探究
总结:利用离子反应除去杂质的思路和方法
1.分析物质组成,确定要保留的物质和需要除去的杂质。
2.明确要保留的物质和杂质之间的性质差异。
3.选择能使杂质离子转化为气体或沉淀的物质作为除杂试剂。除杂试剂不能影响要保留的离子,且应适当过量。
4.分析因除杂试剂过量而引入的新杂质如何除去。
5.综合考虑原有杂质离子和可能新引入的杂质离子,确定试剂添加顺序和实验操作步骤。
课堂探究
【小组合作】根据所提供的仪器、试剂,小组合作初步确定实验方案,绘制流程图。
天平、药匙、量筒、烧杯、玻璃棒、胶头滴管、漏斗、滤纸、蒸发皿、坩埚钳、铁架台(带铁圈)、陶土网、酒精灯、火柴、粗盐、蒸馏水、0.1 mol·L-1 BaCl2溶液、20% NaOH 溶液、饱和Na2CO3溶液、6 mol·L-1盐酸、pH试纸。
课堂探究
二、设计去除粗盐中的可溶性杂质的实验方案
【问题2.4】化学除杂时如何保证杂质离子除干净 如何检验S是否完全除去
【问题2.5】实验操作流程:
溶解、沉淀、过滤、中和、蒸发。
课堂探究
二、设计去除粗盐中的可溶性杂质的实验方案
【小组合作】根据所提供的仪器、试剂,小组合作完善实验方案。
课堂探究
三、实验操作
1.注意事项:(1)使用玻璃仪器需注意安全,进行加热蒸发操作时请戴上护目镜。
(2)如果过滤后的滤液仍然浑浊,必须重做过滤器,再次过滤。
(3)实验完毕,整理好实验台。
2.认真规范操作实验,填写实验记录卡。
[实验]
课堂探究
三、实验操作
实验步骤 实验操作
①溶解
用天平称取5.0 g粗盐放入烧杯中,然后加入20 mL水,用玻璃棒 ,使粗盐溶解,得到粗盐水
搅拌
课堂探究
三、实验操作
②沉淀 向粗盐水中依次滴加过量的氯化钡溶液、氢氧化钠溶液、饱和碳酸钠溶液,使_____________
___________完全沉淀析出
SO 、Mg2+、
Ca2+、Ba2+
课堂探究
三、实验操作
③过滤 将烧杯静置后过滤,除去生成的沉淀和不溶性杂质、过滤中玻璃棒的作用是 ,滤液呈
性
引流
碱
课堂探究
三、实验操作
④中和 向滤液中滴加盐酸,用玻璃棒搅拌,直到_____
,并用pH试纸检验,使滤液呈中性或微酸性
无气
泡冒出
课堂探究
三、实验操作
⑤蒸发 将滤液倒入蒸发皿,用酒精灯加热,并用玻璃棒不断 。当蒸发皿中出现 时,停止加热。利用蒸发皿的余热使滤液蒸干。冷却后,得到除去杂质离子的精盐
搅拌
较多固体
课堂小结
粗盐
粗盐水
杂质
氯化钠
不溶性杂质
可溶性杂质
过滤
Ca2+
Mg2+
化学沉淀法
Na2CO3溶液
NaOH溶液
BaCl2溶液
分析混合物组成
根据杂质的特点选择合适的分离方法
选择合适的试剂
布置作业
预习下节学案。
完成本节课后练习。
谢谢大家
同课章节目录
- 第五章 化工生产中的重要非金属元素
- 第一节 硫及其化合物
- 第二节 氮及其化合物
- 第三节 无机非金属材料
- 实验活动4 用化学沉淀法去除粗盐中的杂质离子
- 实验活动5 不同价态含硫物质的转化
- 第六章 化学反应与能量
- 第一节 化学反应与能量变化
- 第二节 化学反应的速率与限度
- 实验活动6 化学能转化成电能
- 实验活动7 化学反应速率的影响因素
- 第七章 有机化合物
- 第一节 认识有机化合物
- 第二节 乙烯与有机高分子材料
- 第三节 乙醇与乙酸
- 第四节 基本营养物质
- 实验活动8 搭建球棍模型认识有机化合物分子结构的特点
- 实验活动9 乙醇、乙酸的主要性质
- 第八章 化学与可持续发展
- 第一节 自然资源的开发利用
- 第二节 化学品的合理使用
- 第三节 环境保护与绿色化学
