第五章 章末复习--人教版高中化学必修第二册教学课件(共22张PPT)
文档属性
| 名称 | 第五章 章末复习--人教版高中化学必修第二册教学课件(共22张PPT) |  | |
| 格式 | pptx | ||
| 文件大小 | 1.1MB | ||
| 资源类型 | 试卷 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2025-07-08 09:10:15 | ||
图片预览







文档简介
(共20张PPT)
章末复习
第五章 化工生产的重要非金属元素
化学
1.通过阅读雾霾的成分及其来源,利用价类二维图揭秘雾霾的形成路径。
2.从物质类别角度、氧化还原角度分析氮及其化合物、硫及其化合物间的相互转化,总结物质间的转化关系,能提炼出非金属元素学习的一般思路及方法,通过硅及其化合物的练习,深化非金属元素学习的思路和方法。
3.通过复习的检验方法,能形成离子检验的基本思路。
学习目标
4.通过再现氨的制备原理,完善实验室制备气体所需要考虑的因素,并能设计出SO2的实验室制法。
5.通过复习无机非金属材料,感受化学对社会发展和人类生活的巨大贡献。
重点:
从物质类别及氧化还原角度分析物质间的转化关系。
难点:
复杂体系中离子的检验。
学习重难点
课堂探究
一、含硫、含氮物质的性质及转化
思考由空气中的N2和自然界中的S单质转化成雾霾中硝酸盐、铵盐和硫酸盐的路线。
课堂探究
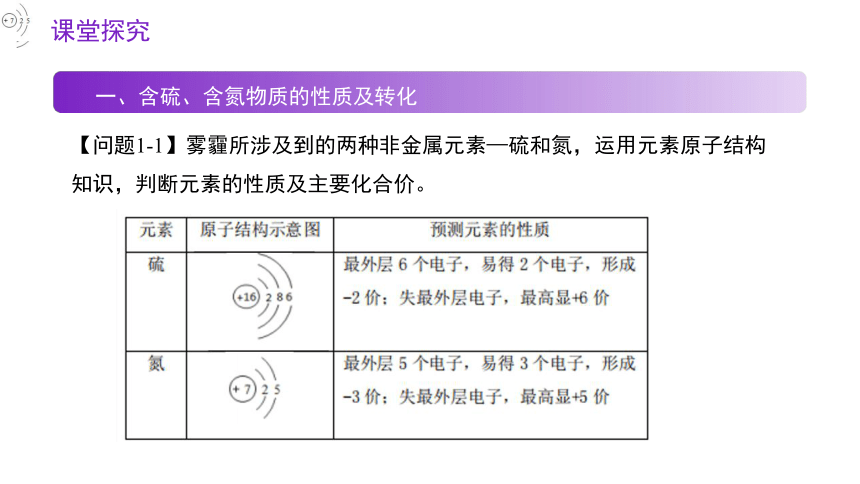
【问题1-1】雾霾所涉及到的两种非金属元素—硫和氮,运用元素原子结构知识,判断元素的性质及主要化合价。
一、含硫、含氮物质的性质及转化
课堂探究
一、含硫、含氮物质的性质及转化
【问题1-2】根据上述物质的转化关系,分析研究非金属元素时常涉及的物质类别有哪些
氢化物—单质—氧化物—含氧酸—盐
一、含硫、含氮物质的性质及转化
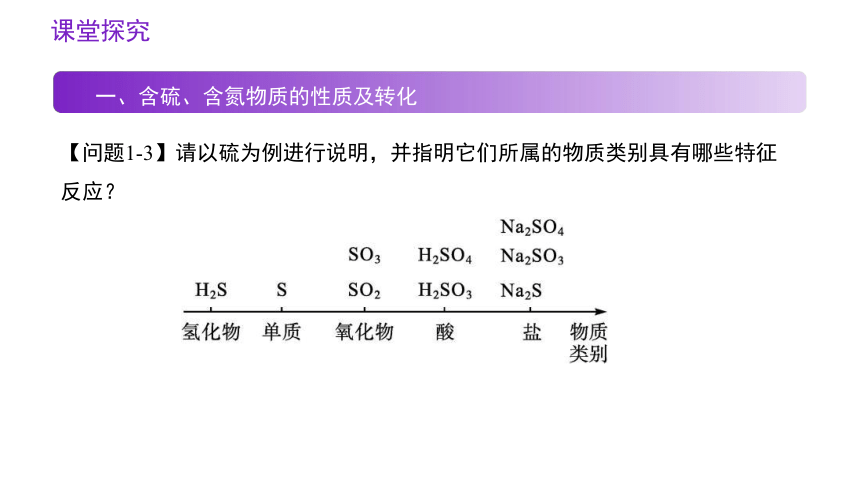
【问题1-3】请以硫为例进行说明,并指明它们所属的物质类别具有哪些特征反应?
课堂探究
一、含硫、含氮物质的性质及转化
【问题1-3】请以硫为例进行说明,并指明它们所属的物质类别具有哪些特征反应?
课堂探究
非金属单质:①与氢气反应:S+H2 H2S
②与氧气反应:S+O2 SO2
氧化物:SO2和SO3均属于酸性氧化物
①与水反应生成相应的酸
②与碱反应生成相应的盐和水
③与碱性氧化物反应生成盐
酸:①与碱反应生成相应的盐和水
②与碱性氧化物反应生成盐
课堂探究
一、含硫、含氮物质的性质及转化
【问题1-4】CO2和SO2均属于酸性氧化物,SO2还有哪些不同于CO2的化学性质?
SO2还原性:能与常见氧化剂发生氧化还原反应
SO2漂白性:能使品红溶液褪色,表现的SO2漂白性
课堂探究
一、含硫、含氮物质的性质及转化
【问题1-5】写出下列化学方程式,并从氧化还原角度说明如何实现这些物质的转化。
课堂探究
一、含硫、含氮物质的性质及转化
【问题1-6】揭秘材料所给出的H2S、空气中的氮气如何分别转化成雾霾中的硫酸盐和硝酸盐的。
N2→NO→NO2→HNO3→硝酸盐
由H2S和N2为原料,再未转化成相应最高价含氧酸前化合价一直升高,需加氧化剂均与O2反应,得到相应酸后,酸碱中和即可得到相应的盐。
课堂练习
【练习1】
请从物质类别和化合价角度分析硅单质及其氧化物具有的一般性质,并根据已学知识说明这些物质还具有哪些特性。
一般性质:
Si与O2反应;
SiO2作为酸性氧化物可与碱和碱性氧化物反应;
高温条件下与碳单质反应表现其氧化性;
硅酸可与NaOH反应等。
特性:Si、SiO2常温下均可与HF反应。
课堂探究
二、检验硫酸根离子、铵根离子
1. 的检验:先加入过量的盐酸酸化,无明显现象,再加入氯化钡溶液,产生白色沉淀
2. 的检验:加氢氧化钠溶液,加热,产生能使湿润的红色石蕊试纸变蓝的气体
【问题2】雾霾的主要成分包括硫酸盐、硝酸盐、有机碳、铵盐、无机碳等。在实验室中如何检验?
课堂练习
【练习2】
如何检验Na2SO4溶液中是否含有Cl-?
取少量待测液于试管中,滴加过量Ba(NO3)2溶液,过滤,向滤液中滴加硝酸酸化的硝酸银溶液,若产生白色沉淀,则证明含有Cl-。
课堂探究
三、气体的实验室制备
【问题3-1】一套完整的气体制备过程包含哪些装置?
发生装置-净化装置-收集装置-尾气处理装置
【问题3-2】氨气的发生装置的选择考虑了哪些因素?收集装置如何选择?
发生装置:反应原理所需试剂的状态、反应条件
收集装置:所制备气体的性质—密度及溶解度
课堂练习
【练习3】
请利用稀硫酸和亚硫酸钠溶液设计实验制备纯净的SO2。
发生装置
净化装置
收集装置
尾气处理装置
课堂探究
四、复习回顾无机非金属材料
无机非金属材料具有优良的性能与广泛的用途。请根据你对无机非金属材料的认识,绘制无机非金属材料的知识脉络图。
课堂小结
布置作业
完成本节素养专练。
预习下节学案。
谢谢大家
章末复习
第五章 化工生产的重要非金属元素
化学
1.通过阅读雾霾的成分及其来源,利用价类二维图揭秘雾霾的形成路径。
2.从物质类别角度、氧化还原角度分析氮及其化合物、硫及其化合物间的相互转化,总结物质间的转化关系,能提炼出非金属元素学习的一般思路及方法,通过硅及其化合物的练习,深化非金属元素学习的思路和方法。
3.通过复习的检验方法,能形成离子检验的基本思路。
学习目标
4.通过再现氨的制备原理,完善实验室制备气体所需要考虑的因素,并能设计出SO2的实验室制法。
5.通过复习无机非金属材料,感受化学对社会发展和人类生活的巨大贡献。
重点:
从物质类别及氧化还原角度分析物质间的转化关系。
难点:
复杂体系中离子的检验。
学习重难点
课堂探究
一、含硫、含氮物质的性质及转化
思考由空气中的N2和自然界中的S单质转化成雾霾中硝酸盐、铵盐和硫酸盐的路线。
课堂探究
【问题1-1】雾霾所涉及到的两种非金属元素—硫和氮,运用元素原子结构知识,判断元素的性质及主要化合价。
一、含硫、含氮物质的性质及转化
课堂探究
一、含硫、含氮物质的性质及转化
【问题1-2】根据上述物质的转化关系,分析研究非金属元素时常涉及的物质类别有哪些
氢化物—单质—氧化物—含氧酸—盐
一、含硫、含氮物质的性质及转化
【问题1-3】请以硫为例进行说明,并指明它们所属的物质类别具有哪些特征反应?
课堂探究
一、含硫、含氮物质的性质及转化
【问题1-3】请以硫为例进行说明,并指明它们所属的物质类别具有哪些特征反应?
课堂探究
非金属单质:①与氢气反应:S+H2 H2S
②与氧气反应:S+O2 SO2
氧化物:SO2和SO3均属于酸性氧化物
①与水反应生成相应的酸
②与碱反应生成相应的盐和水
③与碱性氧化物反应生成盐
酸:①与碱反应生成相应的盐和水
②与碱性氧化物反应生成盐
课堂探究
一、含硫、含氮物质的性质及转化
【问题1-4】CO2和SO2均属于酸性氧化物,SO2还有哪些不同于CO2的化学性质?
SO2还原性:能与常见氧化剂发生氧化还原反应
SO2漂白性:能使品红溶液褪色,表现的SO2漂白性
课堂探究
一、含硫、含氮物质的性质及转化
【问题1-5】写出下列化学方程式,并从氧化还原角度说明如何实现这些物质的转化。
课堂探究
一、含硫、含氮物质的性质及转化
【问题1-6】揭秘材料所给出的H2S、空气中的氮气如何分别转化成雾霾中的硫酸盐和硝酸盐的。
N2→NO→NO2→HNO3→硝酸盐
由H2S和N2为原料,再未转化成相应最高价含氧酸前化合价一直升高,需加氧化剂均与O2反应,得到相应酸后,酸碱中和即可得到相应的盐。
课堂练习
【练习1】
请从物质类别和化合价角度分析硅单质及其氧化物具有的一般性质,并根据已学知识说明这些物质还具有哪些特性。
一般性质:
Si与O2反应;
SiO2作为酸性氧化物可与碱和碱性氧化物反应;
高温条件下与碳单质反应表现其氧化性;
硅酸可与NaOH反应等。
特性:Si、SiO2常温下均可与HF反应。
课堂探究
二、检验硫酸根离子、铵根离子
1. 的检验:先加入过量的盐酸酸化,无明显现象,再加入氯化钡溶液,产生白色沉淀
2. 的检验:加氢氧化钠溶液,加热,产生能使湿润的红色石蕊试纸变蓝的气体
【问题2】雾霾的主要成分包括硫酸盐、硝酸盐、有机碳、铵盐、无机碳等。在实验室中如何检验?
课堂练习
【练习2】
如何检验Na2SO4溶液中是否含有Cl-?
取少量待测液于试管中,滴加过量Ba(NO3)2溶液,过滤,向滤液中滴加硝酸酸化的硝酸银溶液,若产生白色沉淀,则证明含有Cl-。
课堂探究
三、气体的实验室制备
【问题3-1】一套完整的气体制备过程包含哪些装置?
发生装置-净化装置-收集装置-尾气处理装置
【问题3-2】氨气的发生装置的选择考虑了哪些因素?收集装置如何选择?
发生装置:反应原理所需试剂的状态、反应条件
收集装置:所制备气体的性质—密度及溶解度
课堂练习
【练习3】
请利用稀硫酸和亚硫酸钠溶液设计实验制备纯净的SO2。
发生装置
净化装置
收集装置
尾气处理装置
课堂探究
四、复习回顾无机非金属材料
无机非金属材料具有优良的性能与广泛的用途。请根据你对无机非金属材料的认识,绘制无机非金属材料的知识脉络图。
课堂小结
布置作业
完成本节素养专练。
预习下节学案。
谢谢大家
同课章节目录
- 第五章 化工生产中的重要非金属元素
- 第一节 硫及其化合物
- 第二节 氮及其化合物
- 第三节 无机非金属材料
- 实验活动4 用化学沉淀法去除粗盐中的杂质离子
- 实验活动5 不同价态含硫物质的转化
- 第六章 化学反应与能量
- 第一节 化学反应与能量变化
- 第二节 化学反应的速率与限度
- 实验活动6 化学能转化成电能
- 实验活动7 化学反应速率的影响因素
- 第七章 有机化合物
- 第一节 认识有机化合物
- 第二节 乙烯与有机高分子材料
- 第三节 乙醇与乙酸
- 第四节 基本营养物质
- 实验活动8 搭建球棍模型认识有机化合物分子结构的特点
- 实验活动9 乙醇、乙酸的主要性质
- 第八章 化学与可持续发展
- 第一节 自然资源的开发利用
- 第二节 化学品的合理使用
- 第三节 环境保护与绿色化学
