第六章 第二节 化学反应的速率与限度 第2课时--人教版高中化学必修第二册教学课件(共22张PPT)
文档属性
| 名称 | 第六章 第二节 化学反应的速率与限度 第2课时--人教版高中化学必修第二册教学课件(共22张PPT) |

|
|
| 格式 | pptx | ||
| 文件大小 | 6.5MB | ||
| 资源类型 | 试卷 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2025-07-08 09:10:15 | ||
图片预览








文档简介
(共22张PPT)
第2课时 化学反应的限度与条件的控制
第二节 化学反应的速率与限度
化学
1.通过氯气与水反应的实例,寻找证据,体会一定条件下的可逆反应存在一定的限度,进而理解可逆反应的特征。
2.通过利用化学反应速率的概念分析可逆反应从投料到平衡建立的过程中正、逆反应速率的变化规律,说明可逆反应为什么会有限度以及化学平衡状态的特征。
3.通过探究化学平衡状态建立过程中各物理量的变化规律,会判断一定条件下的可逆反应是否已达到平衡状态。
学习目标
重点:
化学反应限度的概念和本质,化学平衡状态的建立和判断。
难点:
化学平衡状态的判断。
学习重难点
知识回顾
1.什么是可逆反应?
2.我们学过的可逆反应有哪些 举例说明。
在同一条件下,既能向正反应方向进行,又能向逆反应方向进行的反应
SO2 + H2OH2SO3
Cl2 + H2OHClO+ HCl
NH3 + H2ONH3·H2O
N2 + 3H2 2NH3
催化剂
高温、高压
2SO2+O2 2SO3
催化剂
高温
导入新课
高炉炼铁
高炉炼铁的主要反应:
Fe2O3 + 3CO 2Fe + 3CO2
C(焦炭) + O2(空气) CO2 (放出热量)
C(焦炭) + CO2 2CO(吸收热量)
生产中炼制生铁所需焦炭的实际用量远高于按化学方程式计算所需的量,而且从高炉炉顶出来的气体中含有没利用的CO。开始,炼铁工程师们认为是CO与铁矿石接触不充分造成的,于是设法增加高炉的高度,然而高炉增高后,高炉尾气中CO的比例竟没有改变。
这是什么原因呢?
课堂探究
环节一、构建化学反应限度的概念
1.寻找证据——认识可逆反应的限度
氯气溶于水会和水发生化学反应,该反应能否100%完成 请同学们回顾氯及其化合物部分所学相关知识,搜寻证据,分析、讨论,并说明结果。
氯水的颜色为黄绿色,它是氯气分子溶解在溶液中形成的颜色,由此可知,氯气与水的反应体系中还存在未反应的氯分子,氯气与水的反应不能完全进行,相应条件下,该反应有一定的限度。
课堂探究
环节一、构建化学反应限度的概念
2.思维进阶——探讨可逆反应的特征
【问题1.1】氯气与水的反应为可逆反应,二氧化硫与水的反应、二氧化硫催化氧化为三氧化硫的反应等都是可逆反应,请分析这些可逆反应都有哪些共同的特征
(1)不彻底性:反应体系中反应物和生成物共存,反应存在一定的限度;
(2)双同性:同一条件下,正、逆反应同时存在。
在一定条件下进行的可逆反应,反应物不能百分之百地转化成生成物,最终形成一个反应物、生成物共存的平衡体系,也就是化学平衡状态,它是一定条件下的可逆反应进行的最大限度。
课堂探究
环节二、分析化学平衡状态的建立过程
1.由表及里——理解平衡的建立过程
一定条件下,在密闭容器中充入2molSO2和1molO2,在催化剂的作用下进行以下反应:2SO2(g)+O2(g) 2SO3(g),请分析讨论下列问题:
反应起始时,反应物浓度最大,浓度越大,化学反应速率就越大,因此v(正)最大,此时生成物浓度为零,所以v(逆)为零。
【问题2.1】反应起始时,反应物和生成物的浓度哪个大?正、逆化学反应速率哪个大?
【问题2.2】反应开始后,反应物和生成物浓度怎样变化 正、逆化学反应速率怎样变化?
反应开始后,因反应物被消耗,反应物浓度逐渐减小,导致v(正)逐渐减小,生成物慢慢增多,浓度逐渐增大,因此,v(逆)逐渐增大。
课堂探究
环节二、分析化学平衡状态的建立过程
1.由表及里——理解平衡的建立过程
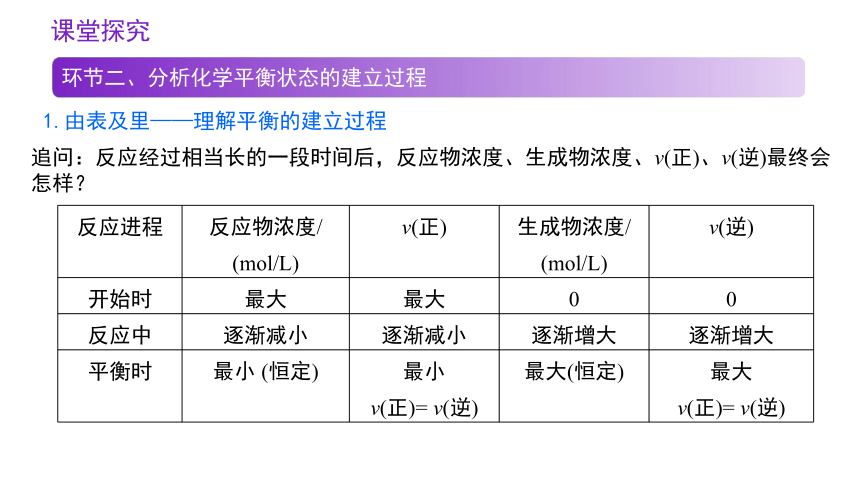
追问:反应经过相当长的一段时间后,反应物浓度、生成物浓度、v(正)、v(逆)最终会怎样?
反应进程 反应物浓度/ (mol/L) v(正) 生成物浓度/ (mol/L) v(逆)
开始时 最大 最大 0 0
反应中 逐渐减小 逐渐减小 逐渐增大 逐渐增大
平衡时 最小 (恒定) 最小 v(正)= v(逆) 最大(恒定) 最大
v(正)= v(逆)
课堂探究
环节二、分析化学平衡状态的建立过程
1.由表及里——理解平衡的建立过程
【问题2.3】画出该反应浓度对时间、速率对时间的二维图:
【小结1】在一定条件下,可逆反应进行到一定程度时,正反应速率与逆反应速率相等,物质的净转化率为零,即单位时间内该物质的消耗量和生成量相等,反应物的浓度和生成物的浓度都不再改变,达到一种表面静止的状态,即称之为化学平衡状态,简称化学平衡。
课堂探究
环节二、分析化学平衡状态的建立过程
1.由表及里——理解平衡的建立过程
充入含的氧气,氧气的浓度增大,正反应速率增大,而此时逆反应速率不变,原有平衡被打破,新的条件下会建立新的平衡;最终, 可能存在于氧气、二氧化硫和三氧化硫中,因为反应为可逆反应,当含的氧气参与反应生成含的三氧化硫,同时含的三氧化硫又分解生成含的二氧化硫和氧气,故最终3种物质中都可能含有。
【问题2.4】反应达到平衡后,再向容器中充入含的氧气,则最终存在于哪些物质中?对平衡有何影响,为什么?
③动:动态平衡
④定:平衡时,各组分的浓度保持一定
⑤变:当外界条件改变,原平衡发生移动
①逆:研究的对象是可逆反应
②等:v(正)=v(逆)≠0(本质)
环节二、分析化学平衡状态的建立过程
2.整理提升——归纳平衡状态的特征
课堂探究
环节三、理解化学平衡状态的判断依据
1.直接依据——平衡状态的概念
如何判断一定条件下的可逆反应是否已达到化学平衡状态
因为可逆反应的本质是v(正)=v(逆),因此,我们可以根据v(正)和v(逆)是否相等来判断。
。
变量不变即平衡,即该变量在平衡建立过程中一直在发生变化,当达到平衡后,该变量保持恒定不变
课堂探究
环节三、理解化学平衡状态的判断依据
2.间接依据——把握平衡状态的本质
评价练习:在2个恒温、恒容的密闭容器中进行反应:
2X(g) Y(g) (甲);A(s)+2B(g) C(g)+D(g) (乙),请在二维坐标图中,分别绘制从投入反应物到反应达到平衡时的以下物理量对时间的图像,并说明哪些物理量可以判断反应已达到平衡状态。
①气体的密度;②体系中生成物的百分含量;③混合气体的压强;④混合气体的平均相对分子质量;⑤混合气体的总物质的量。
课堂探究
环节三、理解化学平衡状态的判断依据
2.间接依据——把握平衡状态的本质
课堂探究
环节三、理解化学平衡状态的判断依据
2.间接依据——把握平衡状态的本质
评价练习:在2个恒温、恒容的密闭容器中进行反应:
2X(g) Y(g) (甲);A(s)+2B(g) C(g)+D(g) (乙),
甲反应:混合气体的密度(ρ)始终不变,不能作为平衡状态的标志,Y的百分含量(Y%)、气体总压强(p)、混合气体平均相对分子质量(Mr)、气体总物质的量(n总)在平衡建立过程中一直在变化,平衡后恒定,可以作为平衡状态的标志;
乙反应:气体总压强(p)、气体总物质的量(n总)始终不变,不能作为平衡状态的标志,混合气体的密度(ρ)、C的百分含量(C%)、混合气体平均相对分子质量(Mr)在平衡建立过程中一直在变化,平衡后恒定,可以作为平衡状态的标志。
如果一个物理量随着反应的进行而改变,当其不变时反应达到平衡状态;随反应的进行保持不变的物理量,不能作为平衡状态的判断依据。
反应举例 mA(g)+nB(g) pC(g)+qD(g) 是否平衡
气体密度 若体系的体积不变,密度一定
混合气体的平均相对分子质量 当m+n≠p+q时,平均相对分子质量一定
当m+n=p+q时,平均相对分子质量一定
颜色 反应体系内有色物质的颜色一定
温度 体系温度一定(其他不变)
平衡
不一定
平衡
不一定
平衡
课堂探究
环节三、理解化学平衡状态的判断依据
2.间接依据——把握平衡状态的本质
课堂探究
环节四、化学反应条件的控制
【解决问题】通过前面的学习,你能解释高炉增高后,高炉尾气中的CO比例竟没有改变的原因了吗?
高炉炼铁过程中发生的反应包括了可逆反应,而可逆反应存在一定的限度,当反应达到其限度以后,各物质的量就不变了,因此炼铁过程中,原料是不可能完全转化为产物的。
【问题4.1】化工生产中,为了提高经济效益,我们需要考虑哪些因素?
使原料尽可能快地转化为产品——化学反应速率
使原料尽可能多地转化为产品——化学反应限度(化学平衡)
课堂探究
环节四、化学反应条件的控制
【问题4.2】后来的研究证明,在高炉中Fe2O3 + 3CO 2Fe + 3CO2的反应为可逆反应,请思考如何优化炼铁条件以提高铁的产率?
(1)浓度控制:增加Fe2O3或CO浓度,促使平衡正向移动。
(2)温度控制:选择适宜温度(兼顾反应速率与催化剂活性)。
(3)尾气处理:回收CO循环使用,减少污染。
【延伸思考】为何工业上不通过无限增加反应物浓度实现完全转化?
投入过多反应物,成本比较高;能耗大;反应物浓度太大,对设备的要求高。
高温
课堂小结
布置作业
查阅资料,分析合成氨或硫酸工业中的条件控制策略,撰写小报告。
谢谢大家
第2课时 化学反应的限度与条件的控制
第二节 化学反应的速率与限度
化学
1.通过氯气与水反应的实例,寻找证据,体会一定条件下的可逆反应存在一定的限度,进而理解可逆反应的特征。
2.通过利用化学反应速率的概念分析可逆反应从投料到平衡建立的过程中正、逆反应速率的变化规律,说明可逆反应为什么会有限度以及化学平衡状态的特征。
3.通过探究化学平衡状态建立过程中各物理量的变化规律,会判断一定条件下的可逆反应是否已达到平衡状态。
学习目标
重点:
化学反应限度的概念和本质,化学平衡状态的建立和判断。
难点:
化学平衡状态的判断。
学习重难点
知识回顾
1.什么是可逆反应?
2.我们学过的可逆反应有哪些 举例说明。
在同一条件下,既能向正反应方向进行,又能向逆反应方向进行的反应
SO2 + H2OH2SO3
Cl2 + H2OHClO+ HCl
NH3 + H2ONH3·H2O
N2 + 3H2 2NH3
催化剂
高温、高压
2SO2+O2 2SO3
催化剂
高温
导入新课
高炉炼铁
高炉炼铁的主要反应:
Fe2O3 + 3CO 2Fe + 3CO2
C(焦炭) + O2(空气) CO2 (放出热量)
C(焦炭) + CO2 2CO(吸收热量)
生产中炼制生铁所需焦炭的实际用量远高于按化学方程式计算所需的量,而且从高炉炉顶出来的气体中含有没利用的CO。开始,炼铁工程师们认为是CO与铁矿石接触不充分造成的,于是设法增加高炉的高度,然而高炉增高后,高炉尾气中CO的比例竟没有改变。
这是什么原因呢?
课堂探究
环节一、构建化学反应限度的概念
1.寻找证据——认识可逆反应的限度
氯气溶于水会和水发生化学反应,该反应能否100%完成 请同学们回顾氯及其化合物部分所学相关知识,搜寻证据,分析、讨论,并说明结果。
氯水的颜色为黄绿色,它是氯气分子溶解在溶液中形成的颜色,由此可知,氯气与水的反应体系中还存在未反应的氯分子,氯气与水的反应不能完全进行,相应条件下,该反应有一定的限度。
课堂探究
环节一、构建化学反应限度的概念
2.思维进阶——探讨可逆反应的特征
【问题1.1】氯气与水的反应为可逆反应,二氧化硫与水的反应、二氧化硫催化氧化为三氧化硫的反应等都是可逆反应,请分析这些可逆反应都有哪些共同的特征
(1)不彻底性:反应体系中反应物和生成物共存,反应存在一定的限度;
(2)双同性:同一条件下,正、逆反应同时存在。
在一定条件下进行的可逆反应,反应物不能百分之百地转化成生成物,最终形成一个反应物、生成物共存的平衡体系,也就是化学平衡状态,它是一定条件下的可逆反应进行的最大限度。
课堂探究
环节二、分析化学平衡状态的建立过程
1.由表及里——理解平衡的建立过程
一定条件下,在密闭容器中充入2molSO2和1molO2,在催化剂的作用下进行以下反应:2SO2(g)+O2(g) 2SO3(g),请分析讨论下列问题:
反应起始时,反应物浓度最大,浓度越大,化学反应速率就越大,因此v(正)最大,此时生成物浓度为零,所以v(逆)为零。
【问题2.1】反应起始时,反应物和生成物的浓度哪个大?正、逆化学反应速率哪个大?
【问题2.2】反应开始后,反应物和生成物浓度怎样变化 正、逆化学反应速率怎样变化?
反应开始后,因反应物被消耗,反应物浓度逐渐减小,导致v(正)逐渐减小,生成物慢慢增多,浓度逐渐增大,因此,v(逆)逐渐增大。
课堂探究
环节二、分析化学平衡状态的建立过程
1.由表及里——理解平衡的建立过程
追问:反应经过相当长的一段时间后,反应物浓度、生成物浓度、v(正)、v(逆)最终会怎样?
反应进程 反应物浓度/ (mol/L) v(正) 生成物浓度/ (mol/L) v(逆)
开始时 最大 最大 0 0
反应中 逐渐减小 逐渐减小 逐渐增大 逐渐增大
平衡时 最小 (恒定) 最小 v(正)= v(逆) 最大(恒定) 最大
v(正)= v(逆)
课堂探究
环节二、分析化学平衡状态的建立过程
1.由表及里——理解平衡的建立过程
【问题2.3】画出该反应浓度对时间、速率对时间的二维图:
【小结1】在一定条件下,可逆反应进行到一定程度时,正反应速率与逆反应速率相等,物质的净转化率为零,即单位时间内该物质的消耗量和生成量相等,反应物的浓度和生成物的浓度都不再改变,达到一种表面静止的状态,即称之为化学平衡状态,简称化学平衡。
课堂探究
环节二、分析化学平衡状态的建立过程
1.由表及里——理解平衡的建立过程
充入含的氧气,氧气的浓度增大,正反应速率增大,而此时逆反应速率不变,原有平衡被打破,新的条件下会建立新的平衡;最终, 可能存在于氧气、二氧化硫和三氧化硫中,因为反应为可逆反应,当含的氧气参与反应生成含的三氧化硫,同时含的三氧化硫又分解生成含的二氧化硫和氧气,故最终3种物质中都可能含有。
【问题2.4】反应达到平衡后,再向容器中充入含的氧气,则最终存在于哪些物质中?对平衡有何影响,为什么?
③动:动态平衡
④定:平衡时,各组分的浓度保持一定
⑤变:当外界条件改变,原平衡发生移动
①逆:研究的对象是可逆反应
②等:v(正)=v(逆)≠0(本质)
环节二、分析化学平衡状态的建立过程
2.整理提升——归纳平衡状态的特征
课堂探究
环节三、理解化学平衡状态的判断依据
1.直接依据——平衡状态的概念
如何判断一定条件下的可逆反应是否已达到化学平衡状态
因为可逆反应的本质是v(正)=v(逆),因此,我们可以根据v(正)和v(逆)是否相等来判断。
。
变量不变即平衡,即该变量在平衡建立过程中一直在发生变化,当达到平衡后,该变量保持恒定不变
课堂探究
环节三、理解化学平衡状态的判断依据
2.间接依据——把握平衡状态的本质
评价练习:在2个恒温、恒容的密闭容器中进行反应:
2X(g) Y(g) (甲);A(s)+2B(g) C(g)+D(g) (乙),请在二维坐标图中,分别绘制从投入反应物到反应达到平衡时的以下物理量对时间的图像,并说明哪些物理量可以判断反应已达到平衡状态。
①气体的密度;②体系中生成物的百分含量;③混合气体的压强;④混合气体的平均相对分子质量;⑤混合气体的总物质的量。
课堂探究
环节三、理解化学平衡状态的判断依据
2.间接依据——把握平衡状态的本质
课堂探究
环节三、理解化学平衡状态的判断依据
2.间接依据——把握平衡状态的本质
评价练习:在2个恒温、恒容的密闭容器中进行反应:
2X(g) Y(g) (甲);A(s)+2B(g) C(g)+D(g) (乙),
甲反应:混合气体的密度(ρ)始终不变,不能作为平衡状态的标志,Y的百分含量(Y%)、气体总压强(p)、混合气体平均相对分子质量(Mr)、气体总物质的量(n总)在平衡建立过程中一直在变化,平衡后恒定,可以作为平衡状态的标志;
乙反应:气体总压强(p)、气体总物质的量(n总)始终不变,不能作为平衡状态的标志,混合气体的密度(ρ)、C的百分含量(C%)、混合气体平均相对分子质量(Mr)在平衡建立过程中一直在变化,平衡后恒定,可以作为平衡状态的标志。
如果一个物理量随着反应的进行而改变,当其不变时反应达到平衡状态;随反应的进行保持不变的物理量,不能作为平衡状态的判断依据。
反应举例 mA(g)+nB(g) pC(g)+qD(g) 是否平衡
气体密度 若体系的体积不变,密度一定
混合气体的平均相对分子质量 当m+n≠p+q时,平均相对分子质量一定
当m+n=p+q时,平均相对分子质量一定
颜色 反应体系内有色物质的颜色一定
温度 体系温度一定(其他不变)
平衡
不一定
平衡
不一定
平衡
课堂探究
环节三、理解化学平衡状态的判断依据
2.间接依据——把握平衡状态的本质
课堂探究
环节四、化学反应条件的控制
【解决问题】通过前面的学习,你能解释高炉增高后,高炉尾气中的CO比例竟没有改变的原因了吗?
高炉炼铁过程中发生的反应包括了可逆反应,而可逆反应存在一定的限度,当反应达到其限度以后,各物质的量就不变了,因此炼铁过程中,原料是不可能完全转化为产物的。
【问题4.1】化工生产中,为了提高经济效益,我们需要考虑哪些因素?
使原料尽可能快地转化为产品——化学反应速率
使原料尽可能多地转化为产品——化学反应限度(化学平衡)
课堂探究
环节四、化学反应条件的控制
【问题4.2】后来的研究证明,在高炉中Fe2O3 + 3CO 2Fe + 3CO2的反应为可逆反应,请思考如何优化炼铁条件以提高铁的产率?
(1)浓度控制:增加Fe2O3或CO浓度,促使平衡正向移动。
(2)温度控制:选择适宜温度(兼顾反应速率与催化剂活性)。
(3)尾气处理:回收CO循环使用,减少污染。
【延伸思考】为何工业上不通过无限增加反应物浓度实现完全转化?
投入过多反应物,成本比较高;能耗大;反应物浓度太大,对设备的要求高。
高温
课堂小结
布置作业
查阅资料,分析合成氨或硫酸工业中的条件控制策略,撰写小报告。
谢谢大家
同课章节目录
- 第五章 化工生产中的重要非金属元素
- 第一节 硫及其化合物
- 第二节 氮及其化合物
- 第三节 无机非金属材料
- 实验活动4 用化学沉淀法去除粗盐中的杂质离子
- 实验活动5 不同价态含硫物质的转化
- 第六章 化学反应与能量
- 第一节 化学反应与能量变化
- 第二节 化学反应的速率与限度
- 实验活动6 化学能转化成电能
- 实验活动7 化学反应速率的影响因素
- 第七章 有机化合物
- 第一节 认识有机化合物
- 第二节 乙烯与有机高分子材料
- 第三节 乙醇与乙酸
- 第四节 基本营养物质
- 实验活动8 搭建球棍模型认识有机化合物分子结构的特点
- 实验活动9 乙醇、乙酸的主要性质
- 第八章 化学与可持续发展
- 第一节 自然资源的开发利用
- 第二节 化学品的合理使用
- 第三节 环境保护与绿色化学
