第六章 实验活动6 化学能转化成电能--人教版高中化学必修第二册教学课件(共24张PPT)
文档属性
| 名称 | 第六章 实验活动6 化学能转化成电能--人教版高中化学必修第二册教学课件(共24张PPT) |  | |
| 格式 | pptx | ||
| 文件大小 | 322.2KB | ||
| 资源类型 | 试卷 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2025-07-08 09:10:15 | ||
图片预览







文档简介
(共24张PPT)
实验活动6 化学能转化成电能
化学
1.通过实验探究,理解氧化还原反应在化学能转化为电能过程中的作用,体会化学的价值。
2.通过实验探究,认识原电池的构成要素及其作用。
3.通过实验探究,培养分析、归纳问题的能力及实验设计能力。
学习目标
重点:
原电池的概念与构成的条件。
难点:
用已经学过的有关知识探究化学能转化为电能的条件和装置。
学习重难点
【思考1】日常生活离不开电,那么同学们能想象一下没有电后的生活吗?
【回顾】上节课我们学过化学能可以转化为电能,目前我国用得最多的是火力发电。大家思考一下,火力发电都有哪些弊端?
导入新课
想象没有电之后的生活:不能看电视,不能听音乐,不能上网,不能用冰箱、洗衣机,不能用空调、电扇、电灯,电梯停运,商场、超市甚至无法收银……
(1)火力发电经历环节多,每个环节能量都不能实现100%的转化,因此必然造成大量的能量损耗。
(2)煤的燃烧会产生污染,不环保。
(3)煤是化石燃料,是不可再生能源,火力发电消耗煤,导致能源枯竭。
化学能
?
一 步 到 位
电能
导入新课
1.电流的本质是什么?
2.电荷存在于哪些微粒?这些微粒依靠什么路径传递?
课堂探究
一、探究原电池的构成条件
电流的实质是带电粒子的定向移动。
电子:借助金属导体或石墨;
阴、阳离子:借助电解质溶液或熔融态电解质。
3.什么可以促使电子与离子定向移动?
【资料1】电子:可以在电势差的作用下从低电势定向移动到高电势,产生电流。
【资料2】离子:阴离子也可以在电势差的作用下从低电势定向移动到高电势,阳离子相反。
【资料3】①每种可以导电的材料,都有一个属性,叫做电势。它的大小主要取决于材料的本性。不同材料的电势不一样,不同材料的电极连接在一起就产生了电势差。
②元素原子的得失电子能力不同,其形成的物质在闭合回路中也会存在电势差。
课堂探究
一、探究原电池的构成条件
形成电势差。
4.如何形成电势差?
5. 哪一类反应最有可能实现将化学能转化为电能的设想?
课堂探究
一、探究原电池的构成条件
不同材料的电极连接在一起或物质得失电子。
我们学过的反应中,氧化还原反应最有可能实现将化学能转化为电能。
实验步骤
电极材料的实验
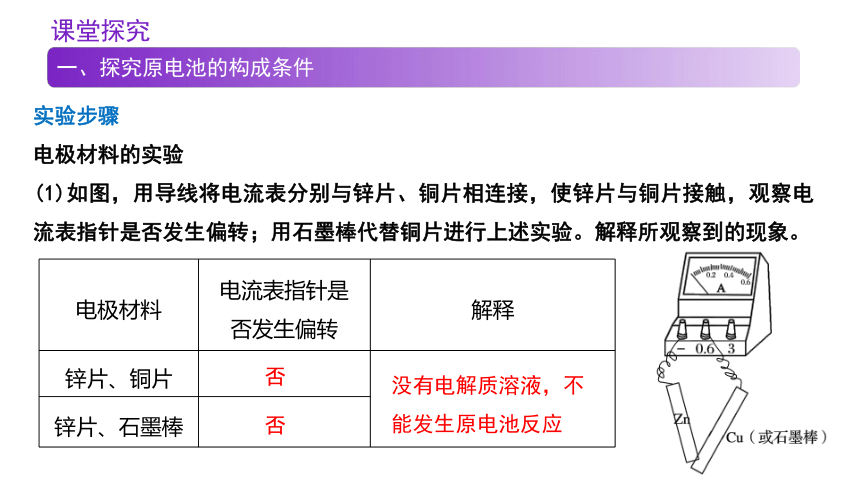
(1)如图,用导线将电流表分别与锌片、铜片相连接,使锌片与铜片接触,观察电流表指针是否发生偏转;用石墨棒代替铜片进行上述实验。解释所观察到的现象。
课堂探究
一、探究原电池的构成条件
电极材料 电流表指针是 否发生偏转 解释
锌片、铜片
锌片、石墨棒 否
否
没有电解质溶液,不能发生原电池反应
按如图所示的装置进行实验,记录实验现象并解释原因。
实验装置 实验现象 解释
课堂探究
一、探究原电池的构成条件
锌片溶解,表面产生无色气泡
锌的还原性比H2强,溶液中的H+直接得到Zn失去的电子生成H2
①锌片溶解,表面产生无色气泡;
②铜片表面无明显变化
铜的还原性比H2弱,不能置换出H2,电子不能在溶液中移动,锌的电子不能转移到铜片上,H+只能在锌片表面被还原成H2
课堂探究
一、探究原电池的构成条件
①锌片溶解,表面产生无色气泡;
②石墨棒表面无明显变化
石墨为惰性材料,不能置换出H2,电子不能通过溶液转移到石墨棒上,
H+只能在锌片表面被还原成H2
按如图所示的装置实验,记录实验现象并解释原因。
电极材料 实验现象 解释
锌片、铜片
课堂探究
二、组装原电池
①锌片溶解;
②铜片不溶解,表面产生无色气泡;
③电流表指针偏转
锌失去的电子通过导线转移至铜片表面产生电流,溶液中的H+在铜片表面获得Zn失去的电子生成H2
电极材料 实验现象 解释
锌片、 石墨棒
铜片、 石墨棒
课堂探究
二、组装原电池
①锌片溶解;
②石墨棒表面产生无色气泡;
③电流表指针偏转
锌失去的电子通过导线转移至石墨棒表面产生电流,溶液中的H+在石墨棒表面获得Zn失去的电子生成H2
铜的还原性比H2弱,不能发生氧化还原反应,没有电子转移,因而不能产生电流
铜片不溶解,电流表指针不偏转
课堂探究
二、组装原电池
1. 铜棒周围的氢气是铜与稀硫酸反应产生的吗?若不是,是怎样产生的?
2.储存在铜电极上的电子是从哪里来的?
3.电荷是如何形成闭合回路的?请从电子和阴、阳离子的移动方向角度回答。
不是,铜与稀硫酸不反应,溶液中的H+在铜片表面获得电子生成H2。
Zn失去的电子沿导线移向铜电极。
电子从负极移向正极;
阳离子移向正极,阴离子移向负极。
课堂探究
二、组装原电池
4.原电池正、负极的判断方法有哪些
5.回头看刚才做过的实验,大家还有哪些问题或者现象想跟同学们分享一下?
①根据电极材料,通常较活泼的为负极。
②根据反应类型,发生氧化反应的为负极。
③根据反应现象,质量减小的为负极。
④根据电子或离子的移动方向,电子流出或阴离子移向的电极为负极。
①锌片最好不要一直插在稀硫酸中,避免过度消耗,而且发现锌片产生的气体有气味。
②更换实验组之前要冲洗电极,避免误差。
③注意选用量程合适的电流表和采用正确的连接方式,以免烧坏。
【思考】
1.能否用铁片作为电极代替铜锌原电池中的锌片?为什么?
2.换成铁片后,电流大小发生变化吗?如何变化?
3.如果通过实验来验证大家刚才的猜测,要注意哪些问题?
课堂探究
三、进一步探索原电池电流大小的影响因素
能。锌片作负极,失电子→铁不如锌活泼,但是也可以与稀硫酸反应→铁片可以代替锌片作负极。
在金属活动性顺序中,铁、铜较锌、铜的差距更小,电势差更小,电流应该变小。
①电流表量程要合适。
②要注意控制变量。
【讨论交流】1.大家观察一下展台上自己刚才组装原电池的材料,回想自己做实验的过程,还有哪些因素可能影响电流大小?
课堂探究
三、进一步探索原电池电流大小的影响因素
①电极活性的差异。
②电极间距离的远近。
③电极材料表面积大小。
④电极材料进入电解质溶液的深浅。
⑤电解质溶液类型的不同。
【讨论交流】2. 其他条件相同时,电极活性差异大,电流相对较大,那么其他因素是如何影响电流大小的?大家能否预测一下?
课堂探究
三、进一步探索原电池电流大小的影响因素
①电极间距离越近,电流可能越大。
②电极材料表面积越大,电流可能越大。
③电极材料进入电解质溶液越深,电流可能越大。
1.(1)下列装置能发生原电池反应使电流表指针偏转的是____(填序号),并说明其他装置不符合要求的理由:_________________________________________________________________
。
⑤
课堂探究
四、原电池知识的应用
①没有构成闭合回路;②没有自发进行的氧化还原反应;③酒精是非电解质,不反应;④两电极相同
(2)根据(1)中选出的原电池回答下列问题:
①负极是 ,发生 (填“氧化”或“还原”)反应,该电极的现象: ,电极反应式: 。
②正极是 ,电极反应式: 。
③溶液中的Fe3+移向 极。
④电池总反应式: 。
Cu
课堂探究
四、原电池知识的应用
氧化
铜片逐渐溶解
Cu -2e-===Cu2+
石墨
Fe3++e-===Fe2+(或2Fe3++2e-===2Fe2+)
正
Cu+2Fe3+===Cu2++2Fe2+
2.在伦敦上流社会,有一位贵族夫人格林太太,幼年时因蛀牙补过一颗不锈钢的假牙。不料后来,她又因为车祸掉了一颗牙,为了显示她的富有,她装了一颗黄金假牙。自此以后,她就经常出现头痛、失眠、心情烦躁等症状。更奇怪的是,众多的医学专家为她检查后,都找不到病因。格林太太的病因到底是什么呢?你能用今天所学的知识帮她解决吗?
课堂探究
四、原电池知识的应用
不锈钢假牙和黄金假牙在口腔中形成了原电池。
课堂小结
布置作业
1.利用生活中的物品如钥匙、导线及各种水果等制作电池。
2.完成学案和教材相关习题。
谢谢大家
实验活动6 化学能转化成电能
化学
1.通过实验探究,理解氧化还原反应在化学能转化为电能过程中的作用,体会化学的价值。
2.通过实验探究,认识原电池的构成要素及其作用。
3.通过实验探究,培养分析、归纳问题的能力及实验设计能力。
学习目标
重点:
原电池的概念与构成的条件。
难点:
用已经学过的有关知识探究化学能转化为电能的条件和装置。
学习重难点
【思考1】日常生活离不开电,那么同学们能想象一下没有电后的生活吗?
【回顾】上节课我们学过化学能可以转化为电能,目前我国用得最多的是火力发电。大家思考一下,火力发电都有哪些弊端?
导入新课
想象没有电之后的生活:不能看电视,不能听音乐,不能上网,不能用冰箱、洗衣机,不能用空调、电扇、电灯,电梯停运,商场、超市甚至无法收银……
(1)火力发电经历环节多,每个环节能量都不能实现100%的转化,因此必然造成大量的能量损耗。
(2)煤的燃烧会产生污染,不环保。
(3)煤是化石燃料,是不可再生能源,火力发电消耗煤,导致能源枯竭。
化学能
?
一 步 到 位
电能
导入新课
1.电流的本质是什么?
2.电荷存在于哪些微粒?这些微粒依靠什么路径传递?
课堂探究
一、探究原电池的构成条件
电流的实质是带电粒子的定向移动。
电子:借助金属导体或石墨;
阴、阳离子:借助电解质溶液或熔融态电解质。
3.什么可以促使电子与离子定向移动?
【资料1】电子:可以在电势差的作用下从低电势定向移动到高电势,产生电流。
【资料2】离子:阴离子也可以在电势差的作用下从低电势定向移动到高电势,阳离子相反。
【资料3】①每种可以导电的材料,都有一个属性,叫做电势。它的大小主要取决于材料的本性。不同材料的电势不一样,不同材料的电极连接在一起就产生了电势差。
②元素原子的得失电子能力不同,其形成的物质在闭合回路中也会存在电势差。
课堂探究
一、探究原电池的构成条件
形成电势差。
4.如何形成电势差?
5. 哪一类反应最有可能实现将化学能转化为电能的设想?
课堂探究
一、探究原电池的构成条件
不同材料的电极连接在一起或物质得失电子。
我们学过的反应中,氧化还原反应最有可能实现将化学能转化为电能。
实验步骤
电极材料的实验
(1)如图,用导线将电流表分别与锌片、铜片相连接,使锌片与铜片接触,观察电流表指针是否发生偏转;用石墨棒代替铜片进行上述实验。解释所观察到的现象。
课堂探究
一、探究原电池的构成条件
电极材料 电流表指针是 否发生偏转 解释
锌片、铜片
锌片、石墨棒 否
否
没有电解质溶液,不能发生原电池反应
按如图所示的装置进行实验,记录实验现象并解释原因。
实验装置 实验现象 解释
课堂探究
一、探究原电池的构成条件
锌片溶解,表面产生无色气泡
锌的还原性比H2强,溶液中的H+直接得到Zn失去的电子生成H2
①锌片溶解,表面产生无色气泡;
②铜片表面无明显变化
铜的还原性比H2弱,不能置换出H2,电子不能在溶液中移动,锌的电子不能转移到铜片上,H+只能在锌片表面被还原成H2
课堂探究
一、探究原电池的构成条件
①锌片溶解,表面产生无色气泡;
②石墨棒表面无明显变化
石墨为惰性材料,不能置换出H2,电子不能通过溶液转移到石墨棒上,
H+只能在锌片表面被还原成H2
按如图所示的装置实验,记录实验现象并解释原因。
电极材料 实验现象 解释
锌片、铜片
课堂探究
二、组装原电池
①锌片溶解;
②铜片不溶解,表面产生无色气泡;
③电流表指针偏转
锌失去的电子通过导线转移至铜片表面产生电流,溶液中的H+在铜片表面获得Zn失去的电子生成H2
电极材料 实验现象 解释
锌片、 石墨棒
铜片、 石墨棒
课堂探究
二、组装原电池
①锌片溶解;
②石墨棒表面产生无色气泡;
③电流表指针偏转
锌失去的电子通过导线转移至石墨棒表面产生电流,溶液中的H+在石墨棒表面获得Zn失去的电子生成H2
铜的还原性比H2弱,不能发生氧化还原反应,没有电子转移,因而不能产生电流
铜片不溶解,电流表指针不偏转
课堂探究
二、组装原电池
1. 铜棒周围的氢气是铜与稀硫酸反应产生的吗?若不是,是怎样产生的?
2.储存在铜电极上的电子是从哪里来的?
3.电荷是如何形成闭合回路的?请从电子和阴、阳离子的移动方向角度回答。
不是,铜与稀硫酸不反应,溶液中的H+在铜片表面获得电子生成H2。
Zn失去的电子沿导线移向铜电极。
电子从负极移向正极;
阳离子移向正极,阴离子移向负极。
课堂探究
二、组装原电池
4.原电池正、负极的判断方法有哪些
5.回头看刚才做过的实验,大家还有哪些问题或者现象想跟同学们分享一下?
①根据电极材料,通常较活泼的为负极。
②根据反应类型,发生氧化反应的为负极。
③根据反应现象,质量减小的为负极。
④根据电子或离子的移动方向,电子流出或阴离子移向的电极为负极。
①锌片最好不要一直插在稀硫酸中,避免过度消耗,而且发现锌片产生的气体有气味。
②更换实验组之前要冲洗电极,避免误差。
③注意选用量程合适的电流表和采用正确的连接方式,以免烧坏。
【思考】
1.能否用铁片作为电极代替铜锌原电池中的锌片?为什么?
2.换成铁片后,电流大小发生变化吗?如何变化?
3.如果通过实验来验证大家刚才的猜测,要注意哪些问题?
课堂探究
三、进一步探索原电池电流大小的影响因素
能。锌片作负极,失电子→铁不如锌活泼,但是也可以与稀硫酸反应→铁片可以代替锌片作负极。
在金属活动性顺序中,铁、铜较锌、铜的差距更小,电势差更小,电流应该变小。
①电流表量程要合适。
②要注意控制变量。
【讨论交流】1.大家观察一下展台上自己刚才组装原电池的材料,回想自己做实验的过程,还有哪些因素可能影响电流大小?
课堂探究
三、进一步探索原电池电流大小的影响因素
①电极活性的差异。
②电极间距离的远近。
③电极材料表面积大小。
④电极材料进入电解质溶液的深浅。
⑤电解质溶液类型的不同。
【讨论交流】2. 其他条件相同时,电极活性差异大,电流相对较大,那么其他因素是如何影响电流大小的?大家能否预测一下?
课堂探究
三、进一步探索原电池电流大小的影响因素
①电极间距离越近,电流可能越大。
②电极材料表面积越大,电流可能越大。
③电极材料进入电解质溶液越深,电流可能越大。
1.(1)下列装置能发生原电池反应使电流表指针偏转的是____(填序号),并说明其他装置不符合要求的理由:_________________________________________________________________
。
⑤
课堂探究
四、原电池知识的应用
①没有构成闭合回路;②没有自发进行的氧化还原反应;③酒精是非电解质,不反应;④两电极相同
(2)根据(1)中选出的原电池回答下列问题:
①负极是 ,发生 (填“氧化”或“还原”)反应,该电极的现象: ,电极反应式: 。
②正极是 ,电极反应式: 。
③溶液中的Fe3+移向 极。
④电池总反应式: 。
Cu
课堂探究
四、原电池知识的应用
氧化
铜片逐渐溶解
Cu -2e-===Cu2+
石墨
Fe3++e-===Fe2+(或2Fe3++2e-===2Fe2+)
正
Cu+2Fe3+===Cu2++2Fe2+
2.在伦敦上流社会,有一位贵族夫人格林太太,幼年时因蛀牙补过一颗不锈钢的假牙。不料后来,她又因为车祸掉了一颗牙,为了显示她的富有,她装了一颗黄金假牙。自此以后,她就经常出现头痛、失眠、心情烦躁等症状。更奇怪的是,众多的医学专家为她检查后,都找不到病因。格林太太的病因到底是什么呢?你能用今天所学的知识帮她解决吗?
课堂探究
四、原电池知识的应用
不锈钢假牙和黄金假牙在口腔中形成了原电池。
课堂小结
布置作业
1.利用生活中的物品如钥匙、导线及各种水果等制作电池。
2.完成学案和教材相关习题。
谢谢大家
同课章节目录
- 第五章 化工生产中的重要非金属元素
- 第一节 硫及其化合物
- 第二节 氮及其化合物
- 第三节 无机非金属材料
- 实验活动4 用化学沉淀法去除粗盐中的杂质离子
- 实验活动5 不同价态含硫物质的转化
- 第六章 化学反应与能量
- 第一节 化学反应与能量变化
- 第二节 化学反应的速率与限度
- 实验活动6 化学能转化成电能
- 实验活动7 化学反应速率的影响因素
- 第七章 有机化合物
- 第一节 认识有机化合物
- 第二节 乙烯与有机高分子材料
- 第三节 乙醇与乙酸
- 第四节 基本营养物质
- 实验活动8 搭建球棍模型认识有机化合物分子结构的特点
- 实验活动9 乙醇、乙酸的主要性质
- 第八章 化学与可持续发展
- 第一节 自然资源的开发利用
- 第二节 化学品的合理使用
- 第三节 环境保护与绿色化学
