第七章 第三节 乙醇与乙酸 第1课时--人教版高中化学必修第二册教学课件(共19张PPT)
文档属性
| 名称 | 第七章 第三节 乙醇与乙酸 第1课时--人教版高中化学必修第二册教学课件(共19张PPT) |

|
|
| 格式 | pptx | ||
| 文件大小 | 1.2MB | ||
| 资源类型 | 试卷 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2025-07-08 09:10:15 | ||
图片预览






文档简介
(共19张PPT)
第1课时 乙醇
第三节 乙醇与乙酸
化学
1.通过观察分析与模型制作,总结乙醇的分子结构特点,了解烃的衍生物和官能团的概念,初步建立分析有机物官能团与性质关系的思维方法。
2.通过引导分析、实验探究,理解乙醇与钠的反应、乙醇的催化氧化反应原理,能正确描述实验现象及书写有关化学方程式,培养实验、观察和分析能力。
3.通过对乙醇结构和性质的学习,认识官能团对有机物性质的重要影响,建立“组成—性质—用途”的有机物学习模式,了解乙醇与人类日常生活和健康的关系。
学习目标
重点:
乙醇分子的结构和乙醇的化学性质。
难点:
乙醇的性质及性质与结构之间的关系。
学习重难点
知识回顾
1.判断下列说法是否正确,并说明理由:
“所有含碳的化合物都是有机物。”
2.结合生活经验,列举两种常见的含氧有机物,并说明其用途。
酒精(乙醇):消毒、燃料。
乙酸(醋酸):调味品、清洁剂。
错误。例如CO、CO 、碳酸盐等含碳但属于无机物。
古代对于酒的称呼非常多,比如别称杜康、欢伯、杯中物,雅称琼露、瑶浆、香蚁等等,诗句中也常出现牛饮 、纵酒、觞酌来形容饮酒的方式,可见古人对酒的喜爱,同学们能试着说出一些含有酒的诗句吗?
导入新课
课堂探究
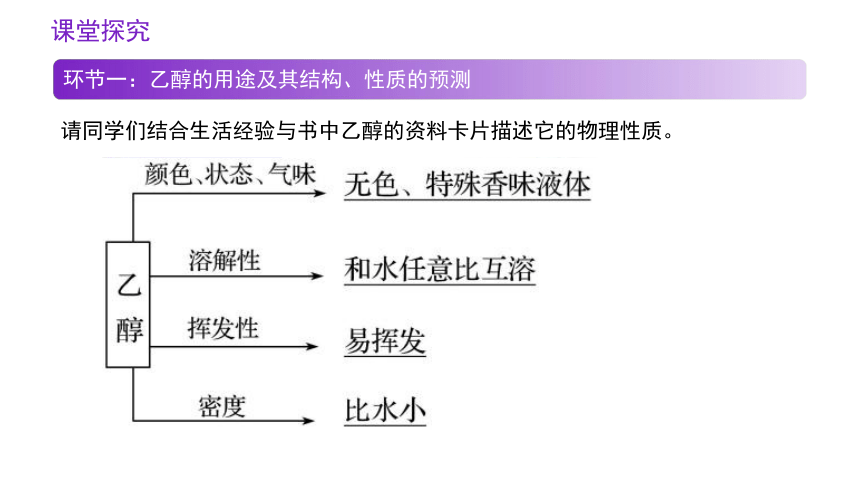
环节一:乙醇的用途及其结构、性质的预测
请同学们结合生活经验与书中乙醇的资料卡片描述它的物理性质。
课堂探究
环节一:乙醇的用途及其结构、性质的预测
【思考】酒精作为良好的溶剂广泛的用于工业生产,乙醇在生产、生活中还有哪些实际用途?结合下面的资料,猜测乙醇的化学性质。
不同浓度的酒精具有不同作用 乙醇可作燃料 乙醇可用于处理钠废料
可以燃烧,燃烧放热;可以和金属钠反应;可作良好的有机溶剂。
课堂探究
环节一:乙醇的用途及其结构、性质的预测
前面的学习中我们已经学习与搭建了乙烷的结构式,在已知乙醇的分子式为 C2H6O 的情况下,请同学们试着搭建出乙醇可能的结构模型。
究竟哪一种才是乙醇的结构呢?
实验探究:将一小块新切的、用滤纸吸干表面煤油的金属钠投入盛有少量无水乙醇的试管中,观察现象。
思考:钠与乙醇反应能产生气体,那此气体是什么?如何检验?
有气体放出,能燃烧,火焰呈淡蓝色,烧杯壁有水滴,加石灰水不变浑浊。
从元素守恒和氧化还原反应视角推测气体产物是氢气
课堂探究
环节一:乙醇的用途及其结构、性质的预测
氢原子来源于哪里?能否推出乙醇的结构式?试着写出该反应的化学方程式。
课堂探究
环节一:乙醇的用途及其结构、性质的预测
烃分子中的氢原子被其他原子或原子团所取代而生成的一系列化合物称为烃的衍生物。如CH3Cl、CH3CH2OH、CH3COOH 等。
课堂探究
环节一:乙醇的用途及其结构、性质的预测
【迁移】水是弱电解质,乙醇为非电解质。乙醇与钠反应和前面做过的水与钠反应的现象进行比较,可以得出什么结论?
相同条件下,乙醇与钠的反应比水与钠的反应缓和得多。乙醇羟基中的氢原子不如水分子中的氢原子活泼。
课堂探究
环节二:探究乙醇的催化氧化反应及机理
前面说到,乙醇可以用作燃料,你能写出反应的化学方程式吗?
【情境】 酒的主要成分是乙醇,那么人喝酒为什么会醉呢?下面是一份饮酒基因的检测报告,酒在人体中经历了什么样的转化过程?
课堂探究
环节二:探究乙醇的催化氧化反应及机理
【实验】乙醇的催化氧化实验:
将铜丝在火焰上烧热会有哪些现象?将烧热的铜丝插入无水乙醇中又会观察到什么现象呢?
铜丝由红色变成黑色;铜丝由黑色变成红色,反复多次后闻到刺激性气味。
课堂探究
环节二:探究乙醇的催化氧化反应及机理
铜丝颜色经过多次改变,它发生了什么反应呢?起到了什么作用?
反应开始时参与反应的铜单质与经过反应后被还原出来的铜单质一直没有发生变化,所以铜作催化剂。
通过化合价的变化指出乙醇所发挥的作用是?
乙醇被氧化作还原剂,具有还原性
乙醇分子断裂的是哪些键?
课堂探究
环节二:探究乙醇的催化氧化反应及机理
什么样的醇才能被催化氧化呢?
羟基相连的碳原子上有氢原子
你知道了人为什么喝多了酒就会醉吗?
乙醇在乙醇脱氢酶的作用下会生成乙醛,乙醇脱氢酶活性越高,乙醇转化为乙醛的速度越快;乙醛在乙醛脱氢酶的作用下生成乙酸,乙醛脱氢酶活性越高,乙醛转化为乙酸的速度越快,乙酸最后分解为 CO2 和 H2O。
课堂探究
环节三:乙醇的氧化反应及应用
交警检查酒驾运用了什么原理?根据什么来判断司机饮酒是否超过规定量?
运用乙醇具有还原性,能被强氧化剂氧化并使其变色的原理。乙醇能被酸性高锰酸钾溶液或酸性重铬酸钾溶液氧化,生成乙酸。交警检查酒驾的装置中含有橙色的酸性重铬酸钾,遇到乙醇时由橙色变为绿色。
小结
布置作业
动手实践:取一根洁净、红亮的铜丝,前端绕成螺旋状;点燃酒精灯,先使螺旋部位在酒精灯外焰处灼烧,然后慢慢移向内焰,迅速取出。在这一过程中,你观察到了哪些现象 应如何解释这些现象 写出有关变化的化学方程式。上述实验对你了解如何使用酒精灯有什么启示
谢谢大家
第1课时 乙醇
第三节 乙醇与乙酸
化学
1.通过观察分析与模型制作,总结乙醇的分子结构特点,了解烃的衍生物和官能团的概念,初步建立分析有机物官能团与性质关系的思维方法。
2.通过引导分析、实验探究,理解乙醇与钠的反应、乙醇的催化氧化反应原理,能正确描述实验现象及书写有关化学方程式,培养实验、观察和分析能力。
3.通过对乙醇结构和性质的学习,认识官能团对有机物性质的重要影响,建立“组成—性质—用途”的有机物学习模式,了解乙醇与人类日常生活和健康的关系。
学习目标
重点:
乙醇分子的结构和乙醇的化学性质。
难点:
乙醇的性质及性质与结构之间的关系。
学习重难点
知识回顾
1.判断下列说法是否正确,并说明理由:
“所有含碳的化合物都是有机物。”
2.结合生活经验,列举两种常见的含氧有机物,并说明其用途。
酒精(乙醇):消毒、燃料。
乙酸(醋酸):调味品、清洁剂。
错误。例如CO、CO 、碳酸盐等含碳但属于无机物。
古代对于酒的称呼非常多,比如别称杜康、欢伯、杯中物,雅称琼露、瑶浆、香蚁等等,诗句中也常出现牛饮 、纵酒、觞酌来形容饮酒的方式,可见古人对酒的喜爱,同学们能试着说出一些含有酒的诗句吗?
导入新课
课堂探究
环节一:乙醇的用途及其结构、性质的预测
请同学们结合生活经验与书中乙醇的资料卡片描述它的物理性质。
课堂探究
环节一:乙醇的用途及其结构、性质的预测
【思考】酒精作为良好的溶剂广泛的用于工业生产,乙醇在生产、生活中还有哪些实际用途?结合下面的资料,猜测乙醇的化学性质。
不同浓度的酒精具有不同作用 乙醇可作燃料 乙醇可用于处理钠废料
可以燃烧,燃烧放热;可以和金属钠反应;可作良好的有机溶剂。
课堂探究
环节一:乙醇的用途及其结构、性质的预测
前面的学习中我们已经学习与搭建了乙烷的结构式,在已知乙醇的分子式为 C2H6O 的情况下,请同学们试着搭建出乙醇可能的结构模型。
究竟哪一种才是乙醇的结构呢?
实验探究:将一小块新切的、用滤纸吸干表面煤油的金属钠投入盛有少量无水乙醇的试管中,观察现象。
思考:钠与乙醇反应能产生气体,那此气体是什么?如何检验?
有气体放出,能燃烧,火焰呈淡蓝色,烧杯壁有水滴,加石灰水不变浑浊。
从元素守恒和氧化还原反应视角推测气体产物是氢气
课堂探究
环节一:乙醇的用途及其结构、性质的预测
氢原子来源于哪里?能否推出乙醇的结构式?试着写出该反应的化学方程式。
课堂探究
环节一:乙醇的用途及其结构、性质的预测
烃分子中的氢原子被其他原子或原子团所取代而生成的一系列化合物称为烃的衍生物。如CH3Cl、CH3CH2OH、CH3COOH 等。
课堂探究
环节一:乙醇的用途及其结构、性质的预测
【迁移】水是弱电解质,乙醇为非电解质。乙醇与钠反应和前面做过的水与钠反应的现象进行比较,可以得出什么结论?
相同条件下,乙醇与钠的反应比水与钠的反应缓和得多。乙醇羟基中的氢原子不如水分子中的氢原子活泼。
课堂探究
环节二:探究乙醇的催化氧化反应及机理
前面说到,乙醇可以用作燃料,你能写出反应的化学方程式吗?
【情境】 酒的主要成分是乙醇,那么人喝酒为什么会醉呢?下面是一份饮酒基因的检测报告,酒在人体中经历了什么样的转化过程?
课堂探究
环节二:探究乙醇的催化氧化反应及机理
【实验】乙醇的催化氧化实验:
将铜丝在火焰上烧热会有哪些现象?将烧热的铜丝插入无水乙醇中又会观察到什么现象呢?
铜丝由红色变成黑色;铜丝由黑色变成红色,反复多次后闻到刺激性气味。
课堂探究
环节二:探究乙醇的催化氧化反应及机理
铜丝颜色经过多次改变,它发生了什么反应呢?起到了什么作用?
反应开始时参与反应的铜单质与经过反应后被还原出来的铜单质一直没有发生变化,所以铜作催化剂。
通过化合价的变化指出乙醇所发挥的作用是?
乙醇被氧化作还原剂,具有还原性
乙醇分子断裂的是哪些键?
课堂探究
环节二:探究乙醇的催化氧化反应及机理
什么样的醇才能被催化氧化呢?
羟基相连的碳原子上有氢原子
你知道了人为什么喝多了酒就会醉吗?
乙醇在乙醇脱氢酶的作用下会生成乙醛,乙醇脱氢酶活性越高,乙醇转化为乙醛的速度越快;乙醛在乙醛脱氢酶的作用下生成乙酸,乙醛脱氢酶活性越高,乙醛转化为乙酸的速度越快,乙酸最后分解为 CO2 和 H2O。
课堂探究
环节三:乙醇的氧化反应及应用
交警检查酒驾运用了什么原理?根据什么来判断司机饮酒是否超过规定量?
运用乙醇具有还原性,能被强氧化剂氧化并使其变色的原理。乙醇能被酸性高锰酸钾溶液或酸性重铬酸钾溶液氧化,生成乙酸。交警检查酒驾的装置中含有橙色的酸性重铬酸钾,遇到乙醇时由橙色变为绿色。
小结
布置作业
动手实践:取一根洁净、红亮的铜丝,前端绕成螺旋状;点燃酒精灯,先使螺旋部位在酒精灯外焰处灼烧,然后慢慢移向内焰,迅速取出。在这一过程中,你观察到了哪些现象 应如何解释这些现象 写出有关变化的化学方程式。上述实验对你了解如何使用酒精灯有什么启示
谢谢大家
同课章节目录
- 第五章 化工生产中的重要非金属元素
- 第一节 硫及其化合物
- 第二节 氮及其化合物
- 第三节 无机非金属材料
- 实验活动4 用化学沉淀法去除粗盐中的杂质离子
- 实验活动5 不同价态含硫物质的转化
- 第六章 化学反应与能量
- 第一节 化学反应与能量变化
- 第二节 化学反应的速率与限度
- 实验活动6 化学能转化成电能
- 实验活动7 化学反应速率的影响因素
- 第七章 有机化合物
- 第一节 认识有机化合物
- 第二节 乙烯与有机高分子材料
- 第三节 乙醇与乙酸
- 第四节 基本营养物质
- 实验活动8 搭建球棍模型认识有机化合物分子结构的特点
- 实验活动9 乙醇、乙酸的主要性质
- 第八章 化学与可持续发展
- 第一节 自然资源的开发利用
- 第二节 化学品的合理使用
- 第三节 环境保护与绿色化学
