第二章 第二节 烯烃 炔烃 第2课时--人教版高中化学选择性必修第三册教学课件(共22张PPT)
文档属性
| 名称 | 第二章 第二节 烯烃 炔烃 第2课时--人教版高中化学选择性必修第三册教学课件(共22张PPT) |  | |
| 格式 | pptx | ||
| 文件大小 | 62.3MB | ||
| 资源类型 | 试卷 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2025-07-08 09:10:15 | ||
图片预览







文档简介
(共22张PPT)
第2课时 炔烃
第二节 烯烃、炔烃
化学
1.以氧炔焰切割视频导入,激发对炔烃的学习兴趣,明确学习主题。
2.依据结构决定性质,掌握炔烃物理性质递变规律与结构,理解通式并会写同分异构体,提升知识迁移与归纳能力。
学习目标
3.通过学习炔烃氧化、加成、加聚等化学性质及书写相关化学方程式,理解反应中化学键变化,培养知识迁移和推理能力。
重难点:
炔烃的结构和性质之间的关系。
学习重难点
情境导入
应用:乙炔燃烧时产生的氧炔焰可用来切割或焊接金属。
课堂探究
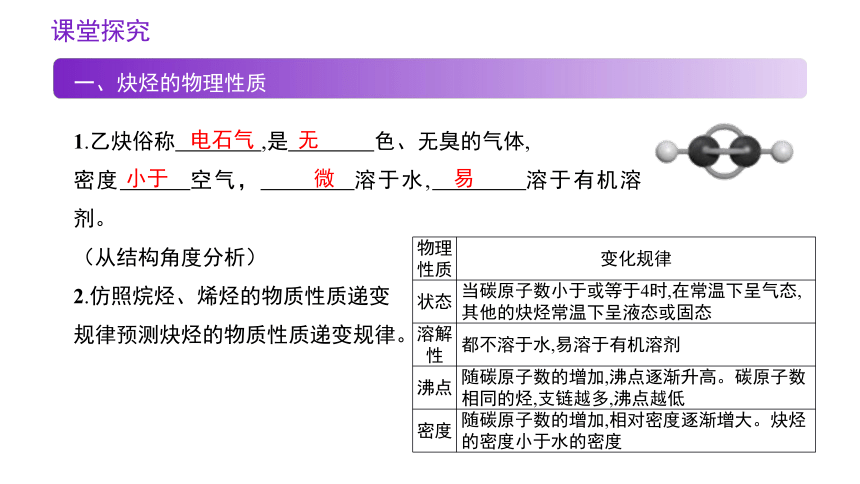
一、炔烃的物理性质
1.乙炔俗称 ,是 色、无臭的气体,
密度 空气, 溶于水, 溶于有机溶剂。
(从结构角度分析)
2.仿照烷烃、烯烃的物质性质递变
规律预测炔烃的物质性质递变规律。
电石气 无
小于 微 易
物理性质 变化规律
状态 当碳原子数小于或等于4时,在常温下呈气态,其他的炔烃常温下呈液态或固态
溶解性 都不溶于水,易溶于有机溶剂
沸点 随碳原子数的增加,沸点逐渐升高。碳原子数相同的烃,支链越多,沸点越低
密度 随碳原子数的增加,相对密度逐渐增大。炔烃的密度小于水的密度
课堂探究
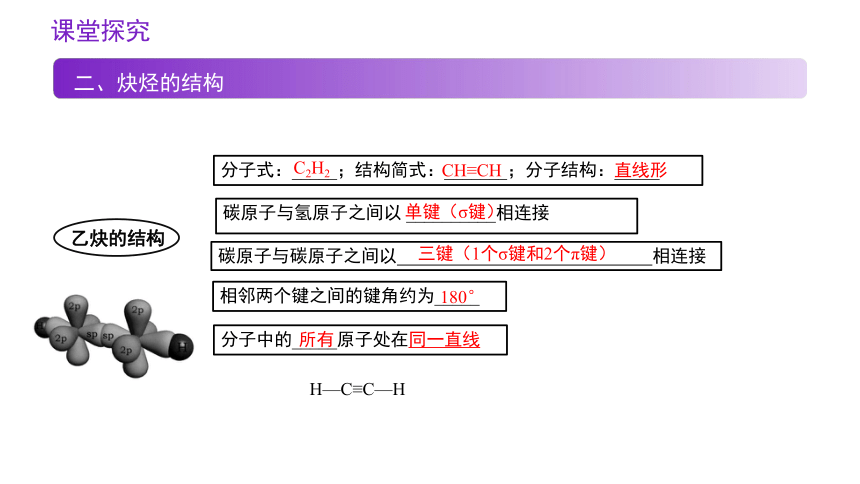
二、炔烃的结构
乙炔的结构
分子式:_____;结构简式:_______;分子结构:_____
C2H2
碳原子与氢原子之间以 __________相连接
CH≡CH
碳原子与碳原子之间以 相连接
直线形
相邻两个键之间的键角约为_____
分子中的_____原子处在同一直线
180°
所有
单键(σ键)
三键(1个σ键和2个π键)
H—C≡C—H
课堂探究
二、炔烃的结构
【思考与讨论】
1.符合通式CnH2n-2(n≥2)的一定是炔烃吗
2.写出戊炔所有属于炔烃的同分异构体的结构简式。
3.乙炔是直线形分子,丙炔呢
不一定,二烯烃、及单环烯烃也符合此通式。
CH≡C—CH2—CH2—CH3、CH3—C≡C—CH2—CH3、
丙炔相当于乙炔中的一个氢原子被甲基代替,所以不是直线形分子。
课堂探究
三、炔烃的化学性质
甲烷
乙烯
乙炔
含碳量不同导致燃烧现象
有所不同,可用于三者鉴别
O2
4CO2+2H2O
2C2H2+ 5
1. 乙炔的氧化反应
①可燃性
点拨:乙炔在氧气中燃烧时氧炔焰温度可达3 000 ℃以上,故常用它来焊接或切割金属。
课堂探究
三、炔烃的化学性质
1. 乙炔的氧化反应
思考这些现象说明乙炔具有什么化学性质?
能用酸性高锰酸钾溶液除去甲烷中的乙炔吗
课堂探究
三、炔烃的化学性质
2. 加成反应
①将纯净的乙炔通入溴的四氯化碳溶液中,发生反应的过程可分步表示:
②写出乙炔与H2反应的化学方程式
课堂探究
三、炔烃的化学性质
2. 加成反应
①使溴水褪色
CH≡CH+Br2 CH=CH
Br
Br
CH=CH+Br2 CH—CH
Br
Br
Br
Br
Br
Br
1 , 2 -二溴乙烯
1 , 1 , 2 , 2 —四溴乙烷
②催化加氢
CH≡CH+H2
催化剂
△
CH2=CH2
(少量氢气)
(足量氢气)
催化剂
△
CH≡CH+2H2
CH3CH3
课堂探究
三、炔烃的化学性质
【练习】写出1-丁炔与足量氢气完全反应的化学方程式,并分析反应中化学键和官能团的变化。
CH≡CCH2CH3+2H2 CH3CH2CH2CH3
1-丁炔与足量氢气完全反应,碳碳三键官能团消失,两个π键都断开,形成4个C—Hσ键。
某炔烃通过催化加氢反应得到2-甲基戊烷,由此推断该炔烃可能的结构简式?
2号碳原子与相邻三个碳原子之间不可能形成碳碳三键,所以碳碳三键只能位于3、4号碳原子或4、5号碳原子之间。
2. 加成反应
课堂探究
三、炔烃的化学性质
2. 加成反应
△
CH≡CH+H2O CH3CHO
△
CH≡CH+HCl CH2=CHCl
催化剂
氯乙烯
乙醛
乙炔与水加成后的产物乙烯醇
(CH2=CH—OH不稳定,很快转化为乙醛)
写出乙炔分别与HCl及H2O以1∶1比例反应时的化学方程式。
课堂探究
三、炔烃的化学性质
2. 加成反应
【练习】写出丙炔与HCl(1∶1)反应的化学方程式
CH≡CCH3+HCl
CH2=CClCH3
CH≡CCH3+HCl
CHCl=CHCH3
课堂探究
三、炔烃的化学性质
3. 加聚反应
nCH ≡ CH [ CH=CH ]n
催化剂
(制导电高分子材料)
导电塑料——聚乙炔
【思考】乙炔加聚的产物能使溴水褪色吗
可以,聚乙炔中含有碳碳双键。
课堂探究
四、炔烃的制备
制备乙炔(俗称“电石气”):
【实验原理】
【实验试剂】
CaC2+2H2O C2H2↑+Ca(OH)2
电石(CaC2)、饱和食盐水、硫酸铜溶液
①为避免反应速率过快,常用饱和食盐水代替水。
②硫酸铜溶液可除去乙炔中混有的H2S等杂质气体。
我国古时曾有“器中放石几块,滴水则产气,点之则燃”的记载
课堂探究
四、炔烃的制备
制备乙炔(俗称“电石气”):
课堂探究
四、炔烃的制备
制备乙炔(俗称“电石气”):
【思考】
(1)简述实验中各装置的作用。
(2)导气管口附近塞入少量棉花的作用是什么
(3)用饱和食盐水代替水的目的是什么
(4)乙炔通入酸性高锰酸钾溶液前为什么需要除去硫化氢
(5)制取乙炔不能用启普发生器或具有启普发生器原理的实验装置,原因是什么
课堂探究
四、炔烃的制备
(1)装置A,反应装置,作用:产生乙炔。
装置B,除杂装置,作用:除去杂质H2S。
装置C,检验装置,作用:检验乙炔是否产生。
装置D,反应装置,作用:乙炔与溴的四氯化碳溶液反应。
装置E,尾气处理装置,作用:除去未反应的乙炔。
(2)用试管作为反应容器制取乙炔时,由于CaC2和水反应剧烈并产生泡沫,为防止产生的泡沫涌入导气管,应在导气管附近塞入少量棉花。
(3)减小反应速率。
(4)硫化氢有还原性会干扰实验,可用硫酸铜溶液或氢氧化钠溶液除去硫化氢,Cu2++H2S==CuS↓+2H+。
(5)①碳化钙吸水性强,与水反应剧烈,不能随用随停。②反应过程中放出大量的热,易使启普发生器炸裂。③生成的Ca(OH)2呈糊状,易堵塞球形漏斗。
课堂小结
【任务】①乙炔的结构、性质、制备;②烷烃、烯烃、炔烃的对比。
谢谢大家
第2课时 炔烃
第二节 烯烃、炔烃
化学
1.以氧炔焰切割视频导入,激发对炔烃的学习兴趣,明确学习主题。
2.依据结构决定性质,掌握炔烃物理性质递变规律与结构,理解通式并会写同分异构体,提升知识迁移与归纳能力。
学习目标
3.通过学习炔烃氧化、加成、加聚等化学性质及书写相关化学方程式,理解反应中化学键变化,培养知识迁移和推理能力。
重难点:
炔烃的结构和性质之间的关系。
学习重难点
情境导入
应用:乙炔燃烧时产生的氧炔焰可用来切割或焊接金属。
课堂探究
一、炔烃的物理性质
1.乙炔俗称 ,是 色、无臭的气体,
密度 空气, 溶于水, 溶于有机溶剂。
(从结构角度分析)
2.仿照烷烃、烯烃的物质性质递变
规律预测炔烃的物质性质递变规律。
电石气 无
小于 微 易
物理性质 变化规律
状态 当碳原子数小于或等于4时,在常温下呈气态,其他的炔烃常温下呈液态或固态
溶解性 都不溶于水,易溶于有机溶剂
沸点 随碳原子数的增加,沸点逐渐升高。碳原子数相同的烃,支链越多,沸点越低
密度 随碳原子数的增加,相对密度逐渐增大。炔烃的密度小于水的密度
课堂探究
二、炔烃的结构
乙炔的结构
分子式:_____;结构简式:_______;分子结构:_____
C2H2
碳原子与氢原子之间以 __________相连接
CH≡CH
碳原子与碳原子之间以 相连接
直线形
相邻两个键之间的键角约为_____
分子中的_____原子处在同一直线
180°
所有
单键(σ键)
三键(1个σ键和2个π键)
H—C≡C—H
课堂探究
二、炔烃的结构
【思考与讨论】
1.符合通式CnH2n-2(n≥2)的一定是炔烃吗
2.写出戊炔所有属于炔烃的同分异构体的结构简式。
3.乙炔是直线形分子,丙炔呢
不一定,二烯烃、及单环烯烃也符合此通式。
CH≡C—CH2—CH2—CH3、CH3—C≡C—CH2—CH3、
丙炔相当于乙炔中的一个氢原子被甲基代替,所以不是直线形分子。
课堂探究
三、炔烃的化学性质
甲烷
乙烯
乙炔
含碳量不同导致燃烧现象
有所不同,可用于三者鉴别
O2
4CO2+2H2O
2C2H2+ 5
1. 乙炔的氧化反应
①可燃性
点拨:乙炔在氧气中燃烧时氧炔焰温度可达3 000 ℃以上,故常用它来焊接或切割金属。
课堂探究
三、炔烃的化学性质
1. 乙炔的氧化反应
思考这些现象说明乙炔具有什么化学性质?
能用酸性高锰酸钾溶液除去甲烷中的乙炔吗
课堂探究
三、炔烃的化学性质
2. 加成反应
①将纯净的乙炔通入溴的四氯化碳溶液中,发生反应的过程可分步表示:
②写出乙炔与H2反应的化学方程式
课堂探究
三、炔烃的化学性质
2. 加成反应
①使溴水褪色
CH≡CH+Br2 CH=CH
Br
Br
CH=CH+Br2 CH—CH
Br
Br
Br
Br
Br
Br
1 , 2 -二溴乙烯
1 , 1 , 2 , 2 —四溴乙烷
②催化加氢
CH≡CH+H2
催化剂
△
CH2=CH2
(少量氢气)
(足量氢气)
催化剂
△
CH≡CH+2H2
CH3CH3
课堂探究
三、炔烃的化学性质
【练习】写出1-丁炔与足量氢气完全反应的化学方程式,并分析反应中化学键和官能团的变化。
CH≡CCH2CH3+2H2 CH3CH2CH2CH3
1-丁炔与足量氢气完全反应,碳碳三键官能团消失,两个π键都断开,形成4个C—Hσ键。
某炔烃通过催化加氢反应得到2-甲基戊烷,由此推断该炔烃可能的结构简式?
2号碳原子与相邻三个碳原子之间不可能形成碳碳三键,所以碳碳三键只能位于3、4号碳原子或4、5号碳原子之间。
2. 加成反应
课堂探究
三、炔烃的化学性质
2. 加成反应
△
CH≡CH+H2O CH3CHO
△
CH≡CH+HCl CH2=CHCl
催化剂
氯乙烯
乙醛
乙炔与水加成后的产物乙烯醇
(CH2=CH—OH不稳定,很快转化为乙醛)
写出乙炔分别与HCl及H2O以1∶1比例反应时的化学方程式。
课堂探究
三、炔烃的化学性质
2. 加成反应
【练习】写出丙炔与HCl(1∶1)反应的化学方程式
CH≡CCH3+HCl
CH2=CClCH3
CH≡CCH3+HCl
CHCl=CHCH3
课堂探究
三、炔烃的化学性质
3. 加聚反应
nCH ≡ CH [ CH=CH ]n
催化剂
(制导电高分子材料)
导电塑料——聚乙炔
【思考】乙炔加聚的产物能使溴水褪色吗
可以,聚乙炔中含有碳碳双键。
课堂探究
四、炔烃的制备
制备乙炔(俗称“电石气”):
【实验原理】
【实验试剂】
CaC2+2H2O C2H2↑+Ca(OH)2
电石(CaC2)、饱和食盐水、硫酸铜溶液
①为避免反应速率过快,常用饱和食盐水代替水。
②硫酸铜溶液可除去乙炔中混有的H2S等杂质气体。
我国古时曾有“器中放石几块,滴水则产气,点之则燃”的记载
课堂探究
四、炔烃的制备
制备乙炔(俗称“电石气”):
课堂探究
四、炔烃的制备
制备乙炔(俗称“电石气”):
【思考】
(1)简述实验中各装置的作用。
(2)导气管口附近塞入少量棉花的作用是什么
(3)用饱和食盐水代替水的目的是什么
(4)乙炔通入酸性高锰酸钾溶液前为什么需要除去硫化氢
(5)制取乙炔不能用启普发生器或具有启普发生器原理的实验装置,原因是什么
课堂探究
四、炔烃的制备
(1)装置A,反应装置,作用:产生乙炔。
装置B,除杂装置,作用:除去杂质H2S。
装置C,检验装置,作用:检验乙炔是否产生。
装置D,反应装置,作用:乙炔与溴的四氯化碳溶液反应。
装置E,尾气处理装置,作用:除去未反应的乙炔。
(2)用试管作为反应容器制取乙炔时,由于CaC2和水反应剧烈并产生泡沫,为防止产生的泡沫涌入导气管,应在导气管附近塞入少量棉花。
(3)减小反应速率。
(4)硫化氢有还原性会干扰实验,可用硫酸铜溶液或氢氧化钠溶液除去硫化氢,Cu2++H2S==CuS↓+2H+。
(5)①碳化钙吸水性强,与水反应剧烈,不能随用随停。②反应过程中放出大量的热,易使启普发生器炸裂。③生成的Ca(OH)2呈糊状,易堵塞球形漏斗。
课堂小结
【任务】①乙炔的结构、性质、制备;②烷烃、烯烃、炔烃的对比。
谢谢大家
